阿司匹林对Ⅰ型成骨不全小鼠脂肪来源间充质干细胞增殖和成骨分化的影响
2019-05-23刘硕刘义王建海赵玉霞李光
刘硕 刘义 王建海 赵玉霞 李光
天津医科大学基础医学院遗传学系,天津 300070
成骨不全症(osteogenesis imperfecta,OI)又称脆骨病,是一种少见的遗传性骨骼发育障碍疾病。根据Sillence分型,OI可分为Ⅰ~Ⅳ四种类型,其中Ⅰ型成骨不全症状较轻,最为常见[1]。OI的临床症状主要表现为骨质脆弱、反复多发性骨折、骨畸形、蓝巩膜等。绝大多数OI患者(85%~90%)编码Ⅰ型胶原蛋白α链的COL1A1或COL1A2基因发生突变,引起胶原合成不足或结构异常,进而导致骨骼、皮肤、牙本质、巩膜等胶原丰富的结缔组织发生病变[2]。另外,受胶原分泌减少所造成的微环境影响,OI患者的间充质干细胞(mesenchymal stem cells,MSCs)向成骨分化的能力降低,倾向于分化为脂肪细胞[3]。
阿司匹林(aspirin,Asp),又名乙酰水杨酸,是一种广泛使用的非甾体类抗炎药,最初因解热、镇痛的功效被应用于临床。流行病学调查[4]发现,定期服用阿司匹林可提高绝经后妇女的骨密度。近年的研究[5-6]表明,阿司匹林对MSCs的成骨分化有促进作用。但是,研究者[7-9]大多采用来源于野生基因型动物的MSCs,而阿司匹林对成骨不全来源的MSCs的成骨分化是否有同样的促进作用,至今未见报道。
本研究利用实验室建立的COL1A1缺失突变的Ⅰ型成骨不全小鼠(oim),从其脂肪组织中分离得到脂肪间充质干细胞(adipose derived mesenchymal stem cells,ADSCscol1a1+/-),探讨阿司匹林对ADSCscol1a1+/-增殖和成骨分化的影响及可能的作用机制,为阿司匹林用于成骨不全的治疗奠定一定的理论及实验基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:选取6~8周龄、基因型为col1a1+/-的C57/BL6小鼠(oim)。
1.1.2 主要试剂:组织基因组DNA提取试剂盒(美国Biomiga公司);α-MEM培养基(美国Hyclone公司);胰蛋白酶(美国Gibco公司);1×PBS 缓冲液(北京索莱宝公司);胎牛血清(以色列Biological Industries公司);阿司匹林(上海阿拉丁公司);地塞米松、抗坏血酸、β-甘油磷酸钠(美国Sigma公司);青霉素100 U/mL、链霉素100 U/mL(美国Hyclone公司);MTS试剂(美国Promega公司);CD 29/44/45(美国eBioscience公司);细胞凋亡检测试剂盒(德国Miltenyi公司);碱性磷酸酶检测试剂盒、碱性磷酸酶染色试剂盒(上海碧云天公司);Trizol试剂(美国Life Technologies公司);反转录试剂盒(美国Promega公司);荧光定量PCR试剂盒(德国Qiagen公司)。
1.2 实验方法
1.2.1 小鼠基因型鉴定:新生雄性小鼠2周龄时剪尾尖提取DNA,以鼠尾DNA为模板进行PCR反应,反应体系如表1所示。反应条件为:预变性95 ℃,5 min;变性95 ℃,30 s;退火60 ℃,30 s;延伸72 ℃,45 s(35循环);延伸72 ℃,5 min。
表1 oim小鼠基因型鉴定的反应体系
Table 1 Reaction system for genotypic identification of oim mice

反应体系(25 μL)2×Rapid Taq Master Mix12.5 μL双蒸水(ddH2O)9.5 μL上游引物1 μL下游引物1 μLDNA模板1 μL
1.2.2 ADSCscol1a1+/-的分离、培养:选取6~8周龄的oim雄性小鼠,采用颈椎脱臼法处死,并用75%乙醇浸泡消毒。无菌剪取小鼠腋下、腹股沟、背部等处的脂肪组织浸泡于α-MEM培养基中,将脂肪组织剪成细小碎块后转移至50 mL离心管,加入0.2%Ⅰ型胶原酶,37 ℃摇床上消化50 min后加1 mL胎牛血清。将细胞悬液用40 μm筛网过滤,离心后弃去上清,将细胞沉淀用含15%胎牛血清的α-MEM培养基重悬,以1×106/cm2接种于10 cm细胞培养皿。于37 ℃、5% CO2培养箱中培养,3 d后换半液,5~7 d后细胞生长至80%时传代。所有实验均使用传代培养至第3代的ADSCscol1a1+/-。
1.2.3 ADSCscol1a1+/-的鉴定:流式细胞荧光分选技术(FACS)检测其表面间充质干细胞相关Marker,包括CD 29、CD 44和CD 45;将ADSCscol1a1+/-以1× 105/孔接种到24孔板,分别用成骨和成脂诱导培养基诱导培养,14 d后成骨诱导组进行ALP染色,成脂诱导组进行油红O染色。
1.2.4 MTS增殖实验:将ADSCscol1a1+/-以1× 104/孔接种到96孔板,隔天换液,对照组加入150 μL含DMSO的α-MEM培养基,实验组分别加入150 μL含0.5、1、1.5、2、5、10 mmol/L阿司匹林的α-MEM,每3天换液,培养5 d后每孔加入20 μL MTS,37 ℃孵育4 h,用酶标仪在490 nm波长下测定吸光度。
1.2.5 细胞凋亡检测:将ADSCscol1a1+/-以3× 105/孔接种到6孔板,隔天换液,对照组加入含DMSO的α-MEM,实验组加入含1.5 mmol /L阿司匹林的α-MEM。3 d后收集细胞,根据试剂盒说明书操作,标记Annexin V-FITC及PI抗体,FACS检测荧光强度。
1.2.6 ADSCscol1a1+/-的诱导分化:将ADSCscol1a1+/-分为3组,对照组加入含DMSO的培养基,单纯成骨诱导组加入含DMSO的成骨诱导培养基,成骨诱导+阿司匹林组加入含1.5 mmol /L阿司匹林的成骨诱导培养基,每3天更换一次培养液。成骨诱导培养基的制备见表2。
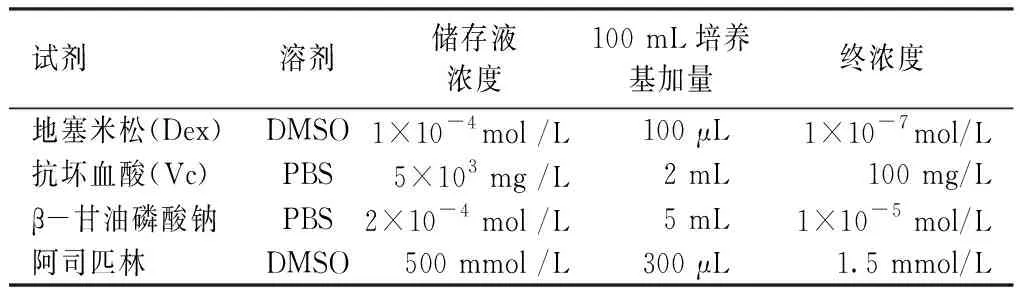
表2 成骨诱导培养基的配制Table 2 Preparation of induction medium
1.2.7 碱性磷酸酶(ALP)染色及活性检测:将ADSCscol1a1+/-以1× 105/孔接种到24孔板,分组培养,7 d后根据试剂盒说明书进行ALP染色;将ADSCscol1a1+/-以3×104/孔接种到12孔板,分组培养,7 d后收集上清,将上清进行5倍稀释后按说明书步骤检测ALP活性。
1.2.8 成骨相关基因转录水平检测:将ADSCscol1a1+/-以3× 105/孔接种到6孔板,分组培养, 14 d后收集细胞,Trizol法提取总RNA,反转录成cDNA,采用实时荧光定量PCR反应(qPCR)测定成骨相关基因的转录水平,引物序列见表3。实验以gapdh作为内参,2-ΔΔCt法进行相对定量分析。

表3 qPCR检测目的基因引物序列Table 3 Primers of target genes detected by qPCR
1.3 统计学处理
2 结果
2.1 Ⅰ型成骨不全小鼠的基因型鉴定
以鼠尾DNA为模板的PCR产物经过1%琼脂糖凝胶电泳后的结果(图1)显示,col1a1部分敲除小鼠(oim)的PCR扩增产物为533 bp;野生型小鼠(WT)的PCR扩增产物为1 623 bp。
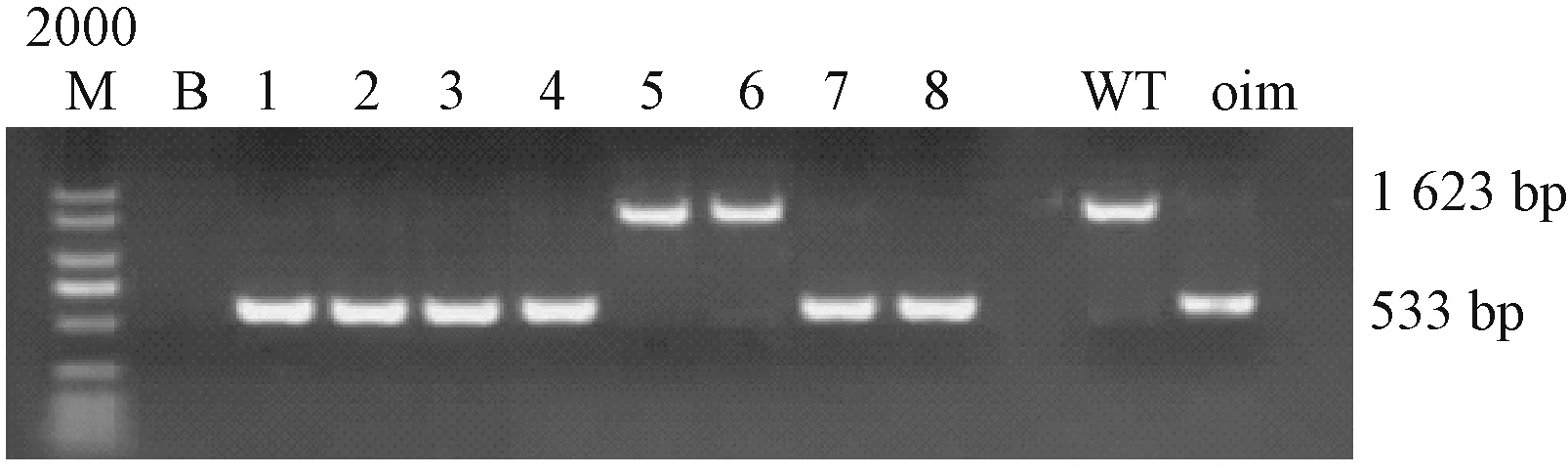
图1 PCR鉴定oim小鼠基因型2 000 M:2 000 bp DNA Ladder Marker;B:空白对照;WT:WT对照;oim:oim对照。Fig.1 Identification of genotypes of oim by PCR2 000 M:2 000 bp DNA Ladder Marker;B:Blank;WT:WT control;oim:oim control.
2.2 ADSCscol1a1+/-的培养及鉴定
ADSCscol1a1+/-的细胞形态如图2 A所示,原代培养(P0)中,第3天换液时有大量圆形悬浮细胞,4~5 d贴壁细胞增多,可见散在集落式分布,5~7 d细胞呈梭形或不规则形,细胞体积增大,相邻集落融合,铺满培养皿底80%以上即可进行传代。传代后细胞(图2 A,P1)呈长梭形,后期呈漩涡式生长,增殖较快,3 d左右可传代1次。流式鉴定结果(图2B)显示,培养至第3代的ADSCscol1a1+/-(图2 A,P3)高表达间充质干细胞相关Marker CD 29和CD 44,不表达白细胞Marker CD 45。经成骨、成脂诱导培养基分别诱导后,ALP染色和油红O染色结果(图2C)显示成骨、成脂诱导成功,证明分离得到的ADSCscol1a1+/-具有多向分化潜能,为典型的间充质干细胞。
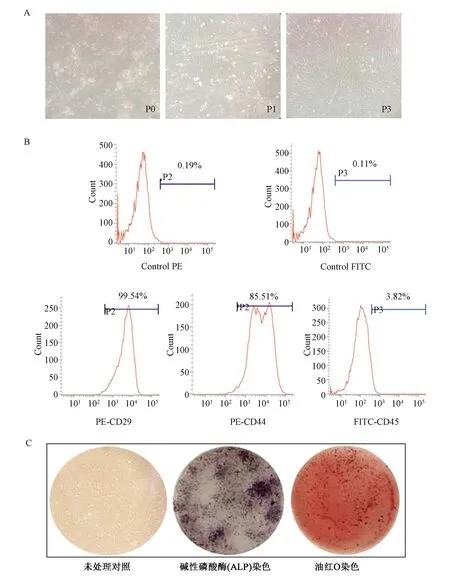
图2 ADSCscol1a1+/-的培养及鉴定A:原代、第1代和第3代ADSCscol1a1+/-的培养观察(10×);B:ADSCscol1a1+/-的流式鉴定;C:ADSCscol1a1+/-的成骨、成脂分化潜能鉴定。Fig.2 Culture and identification of ADSCscol1a1+/-A:ADSCscol1a1+/-culture of P0, P1 and P3; B: FACS identification of ADSCscol1a1+/-; C: Osteogenesis and adipogenic differentiation identification of ADSCscol1a1+/-.
2.3 阿司匹林对ADSCscol1a1+/-增殖及凋亡的影响
将ADSCscol1a1+/-用含有不同浓度阿司匹林的完全培养基培养5 d,MTS增殖实验结果(图3 A)表明,阿司匹林在低、中浓度(0~2 mmol/L)时可促进ADSCscol1a1+/-增殖,高浓度(5~10 mmol/L)时则抑制增殖,且在1.5 mmol/L时促进增殖的效果最佳(***P<0.001;*P<0.05),因此,后续实验均选择1.5 mmol/L的浓度对细胞进行处理。流式分析阿司匹林处理5 d的ADSCscol1a1+/-的凋亡情况,与未处理的对照组相比,阿司匹林组的凋亡细胞所占比例明显减少(图3B,P<0.05),显示阿司匹林具有抑制ADSCscol1a1+/-凋亡的作用。

图3 阿司匹林对ADSCscol1a1+/-增殖及凋亡的影响A:不同浓度阿司匹林处理后MTS增殖吸光度检测柱状图(***P<0.001;*P<0.05);B:1.5 mmol/L阿司匹林处理5 d后流式细胞仪检测凋亡细胞所占比例(*P<0.05)。Fig.3 Effects of aspirin on the proliferation and apoptosis of ADSCscol1a1+/-A:MTS assay post different concentrations of aspirin treatment (***P<0.001;*P<0.05); B:Percentage of apoptotic cells detected by FACS after 5 days of 1.5 mmol/L aspirin treatment(*P<0.05).
2.4 阿司匹林对ADSCscol1a1+/-成骨分化的影响
将ADSCscol1a1+/-分组进行成骨诱导,7 d后ALP染色及活性测定结果(图4 A)显示,与对照组或单纯成骨诱导组相比,成骨诱导+阿司匹林组的ALP染色深、活性显著升高(P<0.001)。同时,利用qPCR对成骨相关因子的表达量进行分析,结果表明与单纯成骨诱导组相比,阿司匹林处理组的Ⅰ型胶原蛋白和骨钙蛋白的编码基因col1a1和bglap以及成骨相关转录因子runx2和osterix的mRNA表达量均有明显上调(图4B,*P<0.05;**P<0.01)。以上结果表明,阿司匹林有促进ADSCscol1a1+/-向成骨方向分化的作用。

图4 阿司匹林对ADSCscol1a1+/-成骨分化的影响A:ADSCscol1a1+/-分组成骨诱导后的ALP染色鉴定(10×)和ALP活性检测(***P<0.001);B:qPCR检测ADSCscol1a1+/-分组成骨诱导后成骨相关基因的转录水平(*P<0.05;**P<0.01)。Fig.4 Effect of aspirin on osteogenic differentiation of ADSCscol1a1+/-A:ALP staining and ALP activity detection of ADSCscol1a1+/-after osteogenic induction (***P<0.001); B:Transcription level of osteoblast-associated genes were detected by qPCR after osteogenic induction(*P<0.05;**P<0.01).
2.5 阿司匹林促进ADSCscol1a1+/-成骨分化的机制
Wnt信号通路和TGF-β信号通路是两个经典的成骨相关信号通路。qPCR检测ADSCscol1a1+/-成骨诱导7 d后Wnt通路中关键因子β-catenin以及TGF-β通路中bmp2的mRNA表达量,结果显示这两个因子在成骨诱导+阿司匹林组中的表达显著高于单纯成骨诱导组(图5 A、5B,*P<0.05;**P<0.01)。说明阿司匹林可能通过激活Wnt/β-catenin通路和BMP2介导的TGF-β通路来促进ADSCscol1a1+/-向成骨方向分化,但具体机制仍有待于深入研究。
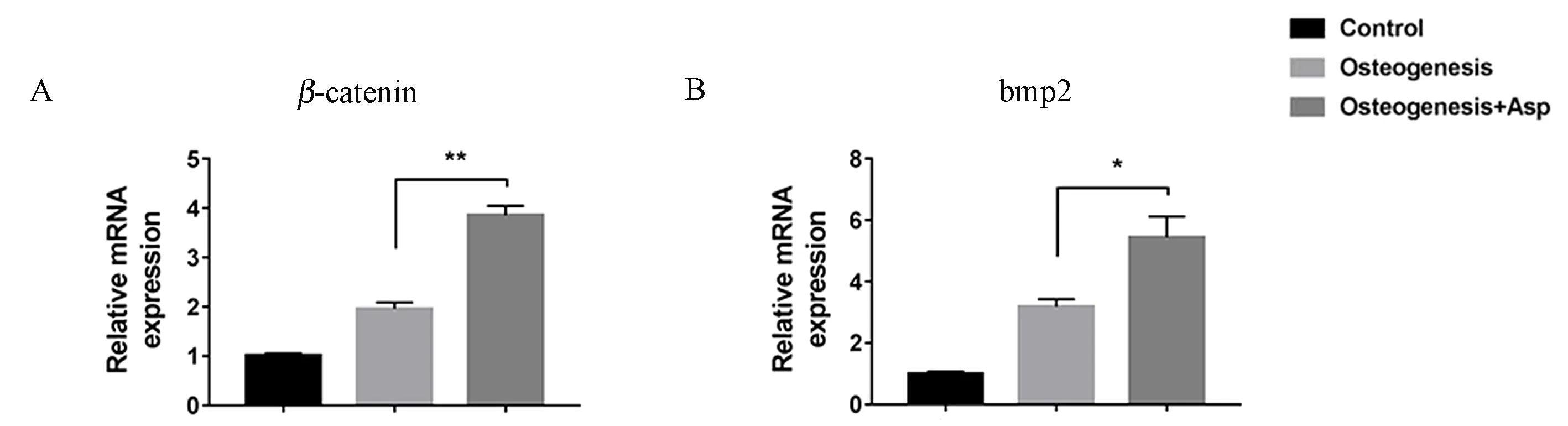
图5 阿司匹林对ADSCscol1a1+/-中β-catenin和bmp2转录水平的影响Fig.5 Effect of aspirin on transcriptional expression of β-catenin and bmp2 in ADSCscol1a1+/-
3 讨论
目前,临床上对OI的治疗以外科手术为主,双膦酸盐、生长激素等药物为辅,但这些治疗无法从根本上改变患者的胶原合成缺陷。为此,研究者们致力于探讨基因治疗、干细胞治疗等前景广阔的疗法[10-11]。OI患者的干细胞在治疗过程中应用的多为骨髓MSCs,但骨髓MSCs只占骨髓单核细胞的0.01%~0.1%,自骨髓中分离获得的细胞数量有限,提取过程还会对人体骨骼造成伤害。相比之下,ADSCs具有与骨髓MSCs相似的分化潜能与低免疫原性,而且来源广泛,只需少量脂肪组织即可获得大量的干细胞,对人体损伤也较小,适宜自体或异体移植[12]。研究[13-14]发现,OI患者及小鼠来源的MSCs成骨分化能力减弱,成脂分化能力增强,采用药物促进其成骨分化,可对OI的治疗产生积极影响。因此,寻找能够促进MSCs成骨分化又安全有效的药物意义重大,本实验首次证实了阿司匹林对oim小鼠来源ADSCs的成骨分化具有促进作用。
近年来,阿司匹林在骨代谢和MSCs成骨分化方面的作用不断被发现。Carbone等[15]的流行病学统计表明,服用阿司匹林的患者骨密度有显著提高。Cao等[8]证明阿司匹林在体外能促进骨髓MSCs的增殖及成骨分化,并且可促进MSCs在迷你猪骨缺损处的骨生成作用;Liu等[9]的研究揭示阿司匹林作用于人脱落乳牙干细胞后可促进其成骨分化;Abd等[7]发现阿司匹林处理牙周膜干细胞后,其增殖能力有所提高且成骨分化增强。这些研究证实,阿司匹林具有促进MSCs成骨分化和加速骨组织修复的作用。
本实验以oim小鼠来源的ADSCscol1a1+/-为研究对象,发现低、中浓度(0~2 mmol/L)的阿司匹林可促进细胞增殖。另外,阿司匹林处理5 d后凋亡细胞所占比例明显下降,这可能是因为阿司匹林对肿瘤坏死因子(TNFα)有抑制作用[16],从而抑制了ADSCscol1a1+/-的凋亡。ALP是成骨早期表达的标志性分子之一,ALP染色和活性检测均表明,阿司匹林可增加ADSCscol1a1+/-的ALP表达量。qPCR结果显示,成骨诱导+阿司匹林组的col1a1、bglap等成骨相关基因的表达水平有明显上调。笔者的结果首次证明,阿司匹林对oim小鼠来源的ADSCs具有促进成骨分化的作用。
作为一种非选择性的环氧合酶(cyclo- oxygenase,COX)抑制剂,阿司匹林与多种生物信号途径相关[18-20]。Liu等[9]的研究显示,阿司匹林是通过TERT/ Wnt/β-catenin通路促进脱落乳牙干细胞的成骨分化。 MSCs的成骨分化受到多种信号途径的调控,除Wnt/β-catenin通路外,影响较大的还有TGF-β/BMPs信号通路[21-24]。笔者的qPCR结果表明,Wnt通路中的β-catenin和TGF-β通路中bmp2基因转录水平均有明显上调。因此阿司匹林可能通过Wnt/β-catenin以及TGF-β这两个经典的成骨相关信号通路影响ADSCscol1a1+/-的成骨分化,但具体的机制还需要进一步研究[25-28]。
综上,本研究首次发现阿司匹林可促进Ⅰ型成骨不全小鼠ADSCs的成骨分化,作用的途径可能是Wnt/β-catenin和TGF-β信号通路,这为阿司匹林以及ADSCs应用于成骨不全的治疗奠定了一定的理论和实验基础。
