硫酸钙对小鼠骨髓间充质干细胞分化和迁移的影响
2019-05-23刘佳周刚陈丹娜黄春霞
刘佳 周刚 陈丹娜 黄春霞*
1. 长沙医学院基础医学院,湖南 长沙 410219 2. 中南大学生命科学院,湖南 长沙 410013
硫酸钙(calcium sulfate, CaSO4)是使用历史悠久且简单的骨移植材料之一,已使用超过100年[1],可应用于口腔外科[2]、颅面外科[3]、骨科手术[4],效果确定。科学界对于CaSO4利于骨再生主要有几种解释,CaSO4等钙化合物材料在被植入后降解时,创造了富含钙的环境,其所诱导的生物反应与骨重塑过程中产生的生物反应相似[5]。Walsh等[6]认为,在CaSO4吸收过程中产生的pH值降低会导致相邻骨释放骨形态发生蛋白(BMPs)。此外也有课题组[1]提出,在CaSO4治疗的部位增加了血管生成。目前,CaSO4成骨效应的细胞机制和分子机制仍不十分清楚。
前期,笔者将间充质干细胞(mesenchymal stem cells, MSCs)接种在脱蛋白骨支架上,对大鼠的临界大小骨缺损模型进行修补[7]。笔者注意到,当没有接种MSCs的脱蛋白骨支架作为对照组植入到骨缺损时,组织学切片可以观察到丰富的宿主细胞进入支架。脱蛋白骨中起主要作用的成分是钙。因此,本研究的目的是利用体外细胞培养的方式,探讨CaSO4对MSCs成骨分化和迁移能力的直接作用,推测其中的联系,探索构建临床实用的无细胞骨移植简易支架的可能性。
1 材料与方法
1.1 材料
1.1.1 实验动物: SPF级KM小鼠,雌性,6~8周,体重(28±2) g,由湖南斯莱克景达实验动物有限公司提供,长沙医学院科研中心标准动物室饲养。
1.1.2 实验仪器: 显微镜(奥林巴斯公司);qRT-PCR分析(Thermo Fisher公司)在湘雅医学院生命科学院进行。
1.1.3 实验试剂: TRIzol(Invitrogen公司);高效反转录试剂盒和Taqman探针(Applied Biosystems公司);CaSO4粉末、明胶(Sigma公司)。
1.2 方法
1.2.1 含CaSO4明胶预先包被细胞培养板:CaSO4按照0.1、0.8、1.5 g/L浓度溶于0.1%明胶/PBS中,设为高、中、低浓度组,经70 μm孔径的滤器过滤,包被培养板的孔。不含CaSO4的0.1%明胶/PBS溶液包被培养板为对照组。经过处理的培养皿在4 ℃保存。
1.2.2 MSCs的分离和培养:小鼠实验严格遵守长沙医学院动物实验的伦理条例进行。将小鼠麻醉后,以快速颈椎脱臼法处死,取出胫骨和股骨。剪去两侧关节头,用培养基将细胞冲出,用DMEM(含10%胎牛血清、2 mmol/L谷氨酰胺和双抗)对细胞进行培养。3 d后,更换培基,去掉未贴壁的细胞。当附着的细胞汇合到80%时,经胰蛋白酶消化后传代,2~4代细胞被用于后续实验。
1.2.3 细胞生长曲线:取对数生长期的细胞进行酶消化后,以6×104/mL的细胞密度接种于已经包被有高、中、低浓度CaSO4/明胶的24孔板和对照组24孔板,均置6个平行孔培养细胞。用台盼蓝拒染法,每天计存活细胞数,共计10 d,据所获平均拒染活细胞数绘制细胞生长曲线。
1.2.4 qRT-PCR分析:MSCs在含有高、中、低浓度CaSO4环境中培养1、4、7、10 d后收集细胞,用TRIzol法制备总RNA,用分光光度法进行RNA定量分析。按照高效反转录试剂盒说明书,对纯化的RNA进行反转录后,每个RT-PCR扩增体系使用50 ng的cDNA,每个样品重复2次。使用Osterix因子和骨钙素(Osteocalcin)作为探针、GAPDH 作为内参对基因表达进行定量分析。相对定量数据fold induction以标准化单位表示。
1.2.5 刮痕合拢实验分析细胞迁移:按照参考文献[8]进行。在明胶/CaSO4包被的12孔板中接种1 mL密度为6×104/mL MSCs,培养至细胞汇合。然后,融合的细胞被最小平头tip头(0.1~10 μL)刮出痕迹,用培养基轻柔清洗,袪除脱落的细胞。继续培养48 h,用奥林巴斯显微镜拍摄细胞迁移后,利用ImageJ软件分析划痕合拢程度。实验重复4次。
1.2.6 琼脂糖斑法分析细胞迁移:按照参考文献[9]进行。低熔点琼脂糖溶于PBS,制成1%琼脂糖溶液,然后高温。为制备琼脂糖斑点,在1.5 mL的Eppendorf试管中加入100 μL融化的1%琼脂糖溶液,再混合100 μL PBS或0.2、1.6、3 g/L 的CaSO4溶液,实验组终浓度为0.1、0.8、1.5 g/L。细胞培养6孔板上点两个2 μL的斑点,一个含CaSO4,一个则不含,4 ℃凝固10 min。MSCs进行胰蛋白酶消化后,取6×105个细胞均匀接种在含有斑点的培养皿中。细胞培养24 h后,用4%多聚甲醛固定,在显微镜下拍照,利用ImageJ软件分析斑点区被侵袭的程度。实验重复2次。
1.3 统计学处理
使用SPSS 10.0软件进行计量资料统计,多组比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 CaSO4对MSCs生长曲线的影响
以活细胞数均值绘制的生长曲线显示,各组均在第6~7天进入平台期,CaSO4中、低浓度组细胞生长曲线和对照组相似,MSCs增殖未受到CaSO4影响。反倒是高浓度CaSO4组细胞生长受抑制,3~10 d活细胞远低于其他组,生长曲线平缓,见图1。
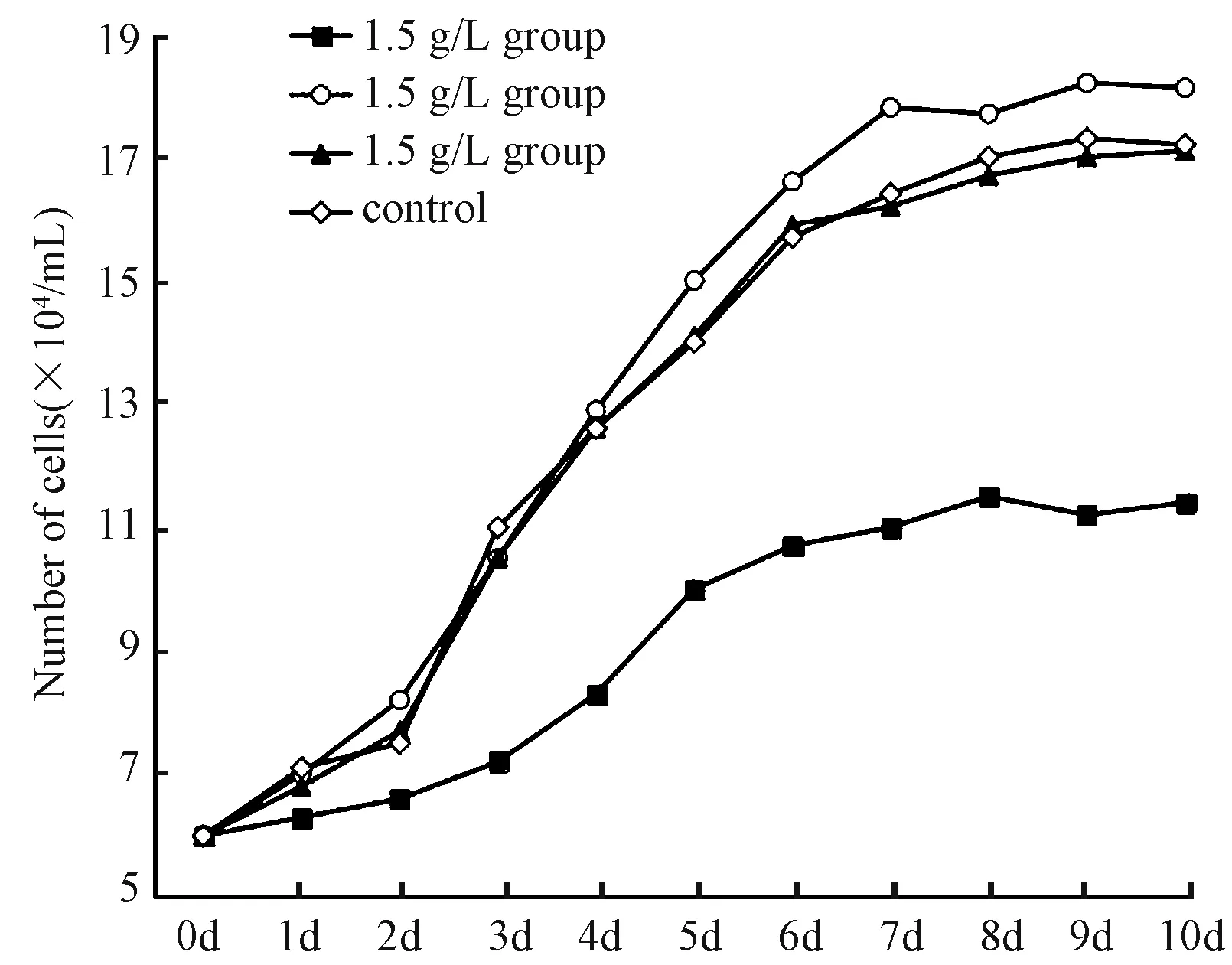
图1 不同浓度CaSO4对细胞生长的影响Fig.1 Effect of CaSO4at different concentrations on cell growth
2.2 CaSO4对成骨基因表达的影响
在不同CaSO4浓度作用于细胞1、4、7、10 d后,笔者通过定量RT-PCR测定了各组Osterix因子和骨钙素表达。如图2 A、图2B所示,中浓度0.8 g/L的CaSO4在1 d内降低了Osterix的表达,而骨钙素的表达量在1~4 d内均略降低,Osterix因子和骨钙素的mRNA的表达从第4~10天逐渐增加。这些结果表明,CaSO4对MSCs分化成骨细胞产生了双重作用。1~4 d内,CaSO4对成骨基因的表达有轻度的抑制作用,第4天是个分水岭,4 d后渐进性上调Osterix因子和骨钙素等成骨基因的表达。而高浓度1.5 g/L的CaSO4自始至终都在降低Osterix和骨钙素的表达,提示高浓度的CaSO4抑制MSCs分化成骨细胞。低浓度0.1 g/L的CaSO4对成骨基因的表达影响不明显。
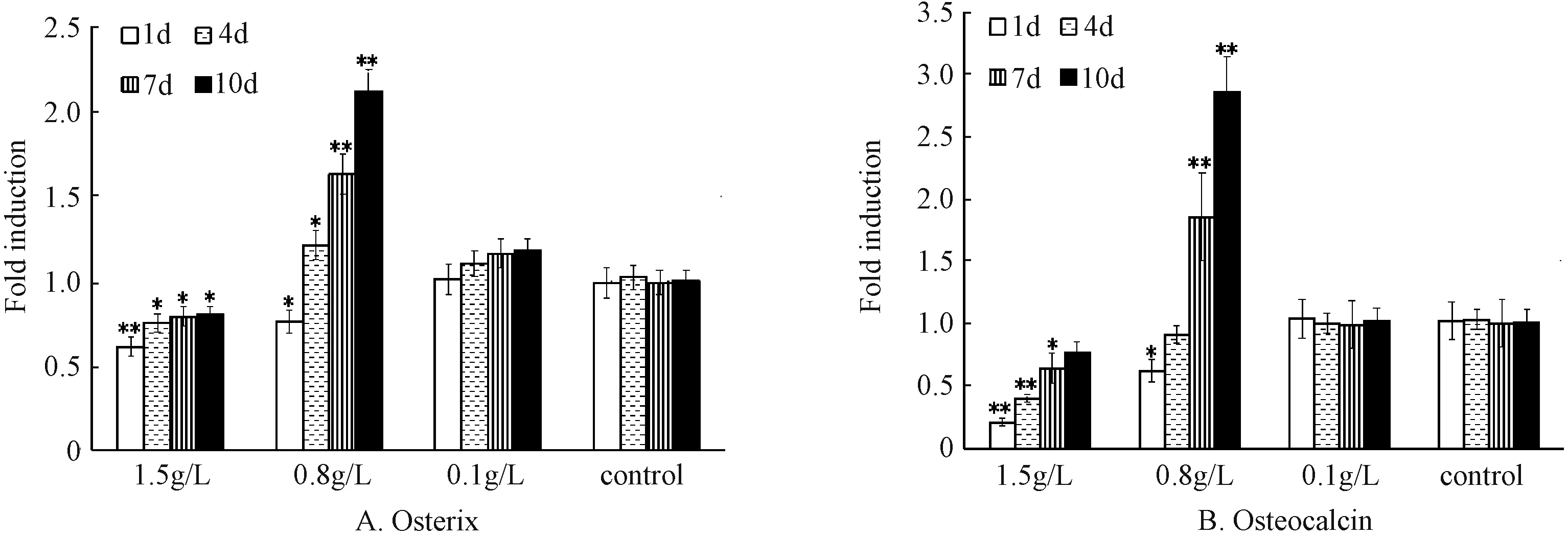
图2 不同浓度CaSO4对Osterix因子和骨钙素表达的影响(与对照组相比,*P<0.05,**P<0.01)Fig.2 Effects of CaSO4 at different concentrations on Osterix factor and osteocalcin expression(compared with the control group,*P<0.05,**P<0.01)
2.3 CaSO4诱导MSCs迁移
为了评估MSCs的迁移,笔者使用刮痕合拢实验来检验在不同CaSO4浓度的影响下,令细胞迁移48 h后的情况。笔者观察到CaSO4对MSCs迁移的影响与浓度密切相关。与对照组相比,0.8 g/L浓度下的细胞迁移最活跃(图3B),迁移后合拢面积达到了(81.1±3.5)%。而暴露于剂量高达1.5 g/L的高浓度组细胞迁移幅度小,合拢面积为(24.6±5.1)%,细胞本身的生长增殖状态也较差,细胞稀疏而且胞质中颗粒多(图3 A)。低浓度组细胞的合拢面积为(49.8±4.4)%,迁移程度比对照组[(36.2±2.6)%]稍大(图3C、图3D)。
为了证实CaSO4对MSCs迁移的影响,继续进行了琼脂糖斑点试验。在CaSO4中浓度时,观察到细胞迁移程度更大,侵袭面积更大[(91.4±6.1)%];CaSO4高浓度时,MSCs的迁移幅度小,侵袭面积[(18.8±10.4)%]甚至远不及对照组[(50.5±8.0)%]和低浓度组[(59.7±9.4)%]。这些结果表明,体外CaSO4诱导的MSCs迁移与浓度依赖性相关,0.8 g/L可以有效的促进迁移。
3 讨论
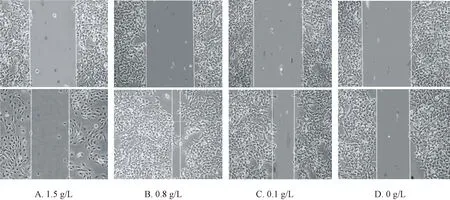
图3 刮痕合拢实验检测CaSO4对MSCs的迁移能力的影响(每组上图为迁移前,下图为迁移后)Fig.3 Effects of CaSO4on the migration capacity of MSCs detected by wound healing assay (The images above are before the migration, and the images below are after the migration)

图4 斑点实验检测CaSO4对MSCs的迁移能力的影响Fig.4 Effects of CaSO4on the migration capacity of MSCs detected by agarose spot experiment
复杂化的社会生活带来了多样化的危险,也带了医疗新挑战,例如高速交通工具事故可能带来的多发性复杂骨损伤。骨损伤发生后,成骨诱导开始启动。成骨诱导是指内源或者外源的多能干细胞(主要是MSCs)受到外在因素的调节,分化形成成骨细胞等骨祖细胞的过程,是细胞水平和分子水平的多阶段级联反应,包括细胞的趋化移动以及几轮的细胞增殖和分化。在重塑骨过程中,骨基质中常有大量的信号分子,这些可溶性信号形成的化学梯度创造了一个成骨诱导的微环境,促进骨祖细胞迁移进入骨再生区域。有研究[10]表明,BMP-2、BMP-4、PDGF及TGF-β等因子对MSCs迁移有促进作用。而BMP靶基因包括成骨细胞的转录因子如Osterix、Runx2[11]、Dlx3/5和 Smad 蛋白家族[12],均对成骨细胞的分化和迁移至关重要[13],也和骨质疏松症等疾病的发生发展密切相关。MSCs迁移是个复杂的多因素调控过程,对迁移有促进作用的因子还不止这些,钙可能也是一个因素。
在前期实验中,笔者将脱蛋白骨植入后,其中释放的钙可能成为基质趋化因子,引起MSCs定向迁移,因此才能在没有附着细胞的脱蛋白骨支架上看到实验动物自身少量细胞迁移进去的现象[7]。因此,假设CaSO4可以作为一个引导信号,诱导正在成骨分化的细胞移动。CaSO4是微溶的,即使到饱和溶液,其离子浓度也不大,容易因吸收而变化。为此,此次实验利用明胶作为钙结合剂,提供一个钙持续释放的稳定环境。
实验中,笔者首先评估了CaSO4对MSCs增殖和分化的影响。中低浓度的CaSO4对MSCs增殖没有明显的影响,但是中浓度的CaSO4对MSCs分化产生了两相效应,开始时短暂抑制分化,CaSO4在1 d内降低了Osterix的表达,而骨钙素的表达量在1~4 d内均轻度降低;随后是成骨基因表达的逐步增加,经过4~10 d的培养后Osterix和骨钙素均增加,提示CaSO4促进了MSCs成骨分化。之后的细胞迁移实验表明CaSO4有能力激发MSCs迁移,而且CaSO4浓度为0.8 g/L时效果最佳。另外笔者还观察到,高浓度的CaSO4干扰了MSCs迁移。这和另外一个现象相印证,在受伤或炎症部位的细胞外液中含有高浓度的钙,不利于成骨分化和迁移,反而容易引起细胞凋亡[14]。
本研究结果表明,中浓度的CaSO4可以诱导MSCs成骨相关基因表达,可能促进干细胞的成骨分化,同时促进细胞迁移,强化祖细胞的招募,有利于完成对骨损伤区的修复。CaSO4支架有望成为无细胞的骨修复简易支架。而未开启成骨分化的MSCs的迁移显著低于分化细胞,可能因为对趋化因子的反应较低。Gonzalez课题组的研究[15]也表明,在以钙为主的生物材料或培养基中存在额外的钙离子,会使MSCs增强成骨基因表达和成骨细胞分化,与本研究结果一致。
