家蚕bmo-miR-0031-3p体内下调丝素轻链基因BmFib-L的表达
2019-05-23陈艳花蒋涛王雪珍钱平唐顺明沈兴家
陈艳花,蒋涛,王雪珍,钱平,唐顺明,沈兴家
(1.江苏科技大学生物技术学院,江苏省蚕桑生物学与生物技术重点实验室,江苏 镇江 212018;2.中国农业科学院蚕业研究所,农业农村部蚕桑遗传改良重点实验室,江苏 镇江 212018)
微RNA(microRNA,miRNA)是一类内源性功能小RNA,在动物中广泛参与细胞分化、形态发育、神经系统发育、肌肉发育和维持细胞存活等方面的调控[1-3],主要在转录后水平通过降解靶基因信使RNA(messenger RNA,mRNA)、抑制翻译等作用机制调控基因表达[4-5]。miRNA主要通过相对保守的第2—8位碱基(种子序列)与靶基因完全或不完全结合发挥调控作用[6]。这种匹配调控扩大了miRNA对靶基因调控的可能性,出现了单个miRNA调节一组mRNA和多个miRNA调节单个mRNA的现象。在蚕丝蛋白表达过程中,miR-965和miR-1926均能结合丝素轻链基因BmFib-L的3´非翻译区(3´untranslated region,3´UTR),抑制靶基因的表达[7];let-7在人体内通过结合不同靶基因,参与肺癌和乳腺癌的调控[1,8]。研究表明,miRNA并不是单一结合靶基因的3´UTR,还可能结合5´UTR及蛋白质编码区(coding sequence,CDS),从而实现抑制或促进表达调控的功能[9-11]。
家蚕(Bombyx mori)是世界上重要的经济性昆虫,也是鳞翅目中具有中国特色的重要的模式生物。丝腺是蚕丝蛋白合成的特异性组织,且具有在5龄后期表达的时间特异性。蚕丝蛋白高效的合成特性引起了许多研究者的兴趣并在分子水平上对蚕丝蛋白的合成机制进行了深入的研究。蚕丝蛋白由丝素和丝胶组成,通过共价键或非共价键形成紧密的结构。研究表明,蚕丝蛋白表达系统是一个复杂的调控网络系统,除了通用转录因子调控外,还有丝腺组织特异的反式作用因子。转录因子SGF-1在中部丝腺参与Ser-1基因的表达[12];蛋白因子BMFA既能与丝素轻链基因BmFib-L结合,还能负调控P25基因[13]。miRNAs、丝腺转录因子和蚕丝蛋白之间存在调控关系,如bmo-miR-2755*不但能下调BmFib-L基因的表达,还能促进P25基因的表达[14];bmo-miR-2758能抑制丝腺特异转录因子FMBP-1的表达[15]。
由于现有的研究仍无法解释蚕丝蛋白精密合成的调控机制,所以基于miRNA揭示蚕丝蛋白表达机制仍有待进行更深入的研究。本实验室SONG等[16]前期对家蚕4、5龄幼虫后部丝腺小RNA进行了高通量测序,获得了35个新的可能参与蚕丝蛋白调控的miRNAs。本研究通过RNAhybrid软件预测其中可能对BmFib-L表达具有调节作用的miRNAs,获得了1个候选bmo-miR-0031-3p(曾称为miR-0031*,以下简称“miR-0031-3p”),分别构建miR-0031-3p表达载体pcDNA3.0[ie1-egfp-pre-miR-0031-3p-SV40]和BmFib-L3´UTR 重组质粒pGL3.0[A3-luc-Fib-L-3´UTR-SV40],以及人工合成miR-0031-3p的模拟物(mimic)和抑制物(inhibitor),然后分别在BmN细胞和5龄第2天幼虫中验证miR-0031-3p对BmFib-L表达的调控作用,证实了miR-0031-3p在细胞和个体水平上能够下调BmFib-L的表达。该研究结果对阐明家蚕miRNA功能和蚕丝蛋白表达调控的分子机制具有重要的意义。
1 材料与方法
1.1 材料、试剂与仪器
家蚕品系P50,由农业农村部蚕桑遗传改良重点实验室(江苏省蚕桑生物学与生物技术重点实验室)保存,解除滞育的越年蚕卵或浸酸后的蚕卵于25℃条件下催青,孵化后用常规新鲜桑叶饲养。
家蚕卵巢培养细胞BmN、丝素轻链基因BmFib-L3´UTR表达载体pGL3.0[A3-luc-SV40]、miRNA表达载体pcDNA3.0[ie1-egfp-SV40]和包含海肾萤光素酶报告基因的质粒pRL-CMV均由农业农村部蚕桑遗传改良重点实验室保存或构建。质粒DNA、RNA提取试剂盒,反转录试剂盒,ExTaq酶,连接载体pMD19-T均购自日本TaKaRa公司。引物合成与DNA测序由生工生物工程(上海)股份有限公司完成。miR-0031-3p的模拟物和抑制物由广州市锐博生物公司合成。转染试剂EntransterTMH4000购自北京英格恩生物科技有限公司,萤光素酶检测试剂盒购自南京诺唯赞生物科技有限公司,TC-100细胞培养基购自德国Applichem公司,胎牛血清购自美国Corning公司,荧光定量试剂盒(SYBR Green PCR kit)为德国Qiagen公司产品。
萤光素酶检测仪(20/20 luminometer)由美国Promega公司生产,DP80型荧光显微镜由日本Olympus公司生产。荧光定量PCR仪(LightCycler®96 RT-PCR system)为美国Roche公司产品。
1.2 调控BmFib-L表达的候选miRNA的生物信息学预测
从NCBI数据库中获取BmFib-L3´UTR序列(登录号NM_001044023)和SONG等[16]对5龄第3天家蚕幼虫丝腺组织测序获得的家蚕miRNAs,通过在线靶基因预测工具RNAhybrid(https://bibiserv2.cebitec.uni-bielefeld.de/rnahybrid),根据5´端种子序列第2—8位碱基的配对水平和折叠自由能(<-83.7 kJ/mol),筛选出1个对BmFib-L具有潜在调控作用的候选家蚕miRNA——bmo-miR-0031-3p(简称“miR-0031-3p”),进行后续的验证实验。
1.3 候选miRNA表达特征的半定量反转录聚合酶链式反应检测分析
解剖家蚕5龄第3天幼虫,获取头、表皮、中肠、马氏管、气管、脂肪体、前部丝腺、中部丝腺、后部丝腺、血淋巴细胞、精巢及卵巢共12个组织,分别提取相应组织的总RNA,于-80℃条件下冷藏,备用。
根据miRNA的特性,设计miR-0031-3p特异的反转录引物、上游引物及通用的下游引物(表1)。以后部丝腺的总RNA为模板进行反转录,获得第一条链cDNA;以此cDNA为模板进行聚合酶链式反应(polymerase chain reaction,PCR),得到的PCR产物用4%琼脂糖凝胶电泳检测,切胶回收长度在50~100 bp区间的片段。将目的片段与载体pMD19-T连接,送至生工生物工程(上海)股份有限公司测序验证。
序列验证正确后,将全部12个组织的总RNAs按照上述方法进行反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)扩增,以BmU6为内参基因,得到的产物用4%琼脂糖凝胶电泳检测,采用Gel-ProAnalyzer凝胶成像软件分析候选miR-0031-3p在不同组织中的相对表达量。
1.4 miR-0031-3p和BmFib-L 3´UTR重组表达载体的构建
在NCBI数据库中获取miR-0031-3p的前体序列pre-miR-0031-3p,并在该片段上下游各延伸近80 bp作为扩增的目的片段,采用NCBI Primer BLAST设计上下游引物(表1),进行PCR扩增,回收产物并与载体pMD19-T连接,然后转化大肠埃希菌感受态细胞,涂布并挑取单菌落培养,送至生工生物工程(上海)股份有限公司测序验证。将测序正确的重组pMD19-T载体在LB培养基中培养12 h,按照试剂盒说明书提取质粒。用限制性内切酶HindⅢ和BamHⅠ对pre-miR-0031-3p载体质粒进行双酶切,回收目的片段,再与经相同双酶切(HindⅢ/BamHⅠ)的质粒 pcDNA3.0[ie1-egfp-SV40]连接,构建候选miR-0031-3p的重组表达载体pcDNA3.0[ie1-egfp-pre-miR-0031-3p-SV40],对表达载体再进行双酶切鉴定,将酶切鉴定正确的重组质粒于-20℃条件下保存,备用。
靶基因BmFib-L3´UTR重组表达载体pGL3.0[A3-luc-Fib-L-3´UTR-SV40]的构建步骤同上,引物见表1,限制性内切酶为XbaⅠ和FseⅠ。
1.5 miR-0031-3p调控BmFib-L表达的细胞水平验证
为了验证miR-0031-3p对BmFib-L表达的调控作用,首先在卵巢来源的BmN细胞中进行实验。处理组:共转染pcDNA3.0[ie1-egfp-pre-miR-0031-3p-SV40]+pGL3.0[A3-luc-Fib-L-3´UTRSV40]+pRL-CMV;阳性对照组:共转染pcDNA3.0[ie1-egfp-SV40]+pGL3.0[A3-luc-Fib-L-3´UTRSV40]+pRL-CMV。转染液中3种质粒以4∶4∶2比例混合,每孔细胞共转染1.6 μg质粒DNAs,按照转染试剂EntransterTM-H4000的说明书操作。

表1 相关基因引物序列Table 1 Primer sequences for related genes
为了进一步验证miR-0031-3p对靶基因表达的影响,人工合成miR-0031-3p的模拟物(mimic)和抑制物(inhibitor)。设置2个实验处理组:共转染mimic+pGL3.0[A3-luc-Fib-L-3´UTR-SV40]+pRLCMV,共转染inhibitor+pcDNA3.0[ie1-egfp-premiR-0031-3p-SV40]+pGL3.0[A3-luc-Fib-L-3´UTRSV40]+pRL-CMV。同样以转染阳性对照组质粒的细胞为对照,进行3次独立实验,每次设置3个重复。
转染48 h后,在荧光显微镜下观察含增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的细胞,评估其转染效率;收集细胞,按照试剂盒说明书进行裂解处理,用双萤光素酶报告试剂盒在萤光素酶检测仪(20/20 luminometer)上检测上清液中萤光素酶活性,以萤火虫萤光素酶活性值与海肾萤光素酶活性值的比值作为报告基因的相对活性,以此衡量miR-0031-3pz在体外对BmFib-L表达的调控作用。
1.6 miR-0031-3p调控BmFib-L表达的个体水平验证
为了验证miR-0031-3p在家蚕体内对BmFib-L表达的调控作用,分析了在miR-0031-3p过表达和抑制状态下BmFib-L表达的变化。用转染试剂分别孵育pcDNA3.0[ie1-egfp-SV40]、pcDNA3.0[ie1-egfp-pre-miR-0031-3p-SV40]和模拟物(mimic),并注射到5龄第2天的幼虫体腔内,然后用新鲜桑叶在25℃条件下饲养该幼虫,36 h后解剖蚕体,获取后部丝腺,以2条家蚕的丝腺组织为一组提取总RNA,对靶基因BmFib-L的表达进行定量分析。方法同上,用转染试剂孵育抑制物(inhibitor),在5龄第2天的幼虫体腔内注射抑制内源性miR-0031-3p,分析BmFib-L表达的变化,以注射pcDNA3.0[ie1-egfp-SV40]的幼虫为阳性对照。
1.7 数据统计与分析
用SPSS 19.0软件分析不同处理组之间的差异显著性,数据结果以“平均值±标准差”表示。用DNAstar软件对基因序列进行分析。
2 结果与分析
2.1 对靶基因BmFib-L表达具有潜在调控作用的miRNA预测结果
在NCBI数据库中下载BmFib-L3´UTR序列和SONG等[16]测序获得的miRNAs,利用软件RNA-hybrid预测两者的结合位点,筛选出了miRNA的种子序列能与靶位点完全匹配的miR-0031-3p(图1),其最小自由能为-96.3 kJ/mol,后文将研究其对BmFib-L基因表达的调控作用。
2.2 候选miRNA表达谱特征的半定量RT-PCR检测分析结果
以5龄第3天幼虫后部丝腺总RNA为模板,反转录后合成第一条链cDNA;再以此cDNA为模板,以miR-0031-3p成熟体的特异性引物进行PCR扩增,得到的产物片段大小约80 bp,测序结果与SONG等[16测序获得的序列一致,说明引物设计正确,可用于后续实验。

图1 miR-0031-3p对BmFib-L mRNA 3´UTR潜在结合位点的生物信息学预测Fig.1 Prediction of potential binding site of miR-0031-3p at BmFib-L mRNA3´UTR
对5龄幼虫各组织的总RNA的半定量RT-PCR分析结果显示,miR-0031-3p不但在其他组织中有表达,而且在后部丝腺中也具有一定的表达量(图2)。据此推测,miR-0031-3p对在后部丝腺高量表达的靶基因BmFib-L的表达存在空间调控的可能性。
2.3 miR-0031-3p和BmFib-L 3´UTR表达载体的构建结果
用特异性引物扩增大小为241 bp的前体序列pre-miR-0031-3p和大小为342 bp的BmFib-L3´UTR序列,经测序验证,序列正确。构建在BmNPV ie1启动子调控下的pre-miR-0031-3p的表达载体pcDNA3.0[ie1-egfp-pre-miR-0031-3p-SV40]和在BmA3启动子控制下与萤光素酶基因融合的BmFib-L3´UTR重组载体pGL3.0[A3-luc-Fib-L-3´UTR-SV40](图3A),经酶切鉴定正确(图3B),可用于后续实验。

图2 半定量RT-PCR检测miR-0031-3p在不同组织中的表达Fig.2 Expression profiling of miR-0031-3p by semiquantitative RT-PCR
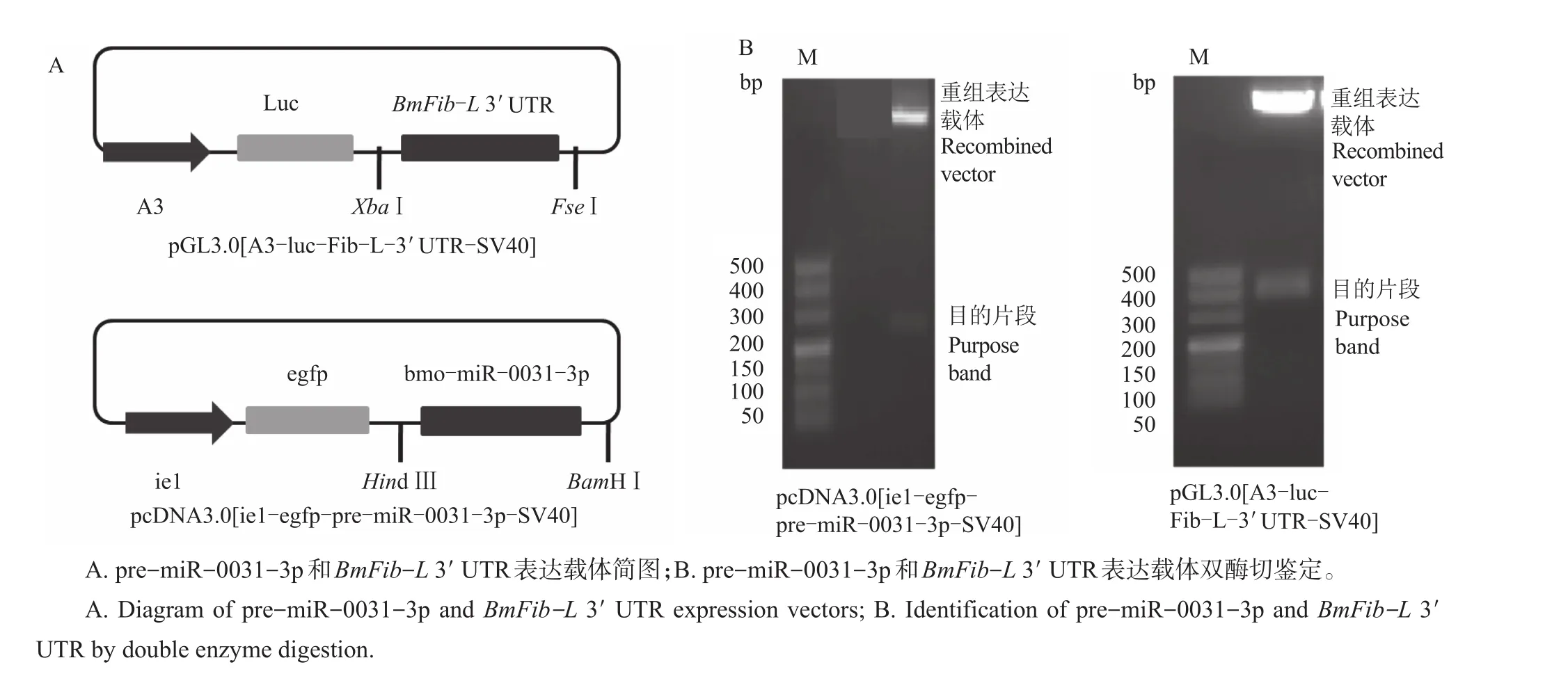
图3 Pre-miR-0031-3p和BmFib-L 3´UTR表达载体的构建Fig.3 Construction of pre-miR-0031-3p and BmFib-L 3´UTR
2.4 miR-0031-3p在BmN细胞中对BmFib-L表达的抑制
将构建好的载体分别在处理组(含miR-0031-3p表达载体)和对照组(不含miR-0031-3p表达载体)中共转染BmN细胞,48 h后利用荧光显微镜观察。结果(图4A)显示,多数细胞呈现绿色荧光,表明载体转染效率较高。萤光素酶活性检测结果表明,处理组的萤光素酶活性与阳性对照组相比显著下降(图4B)。
用模拟物(mimic)和抑制物(inhibitor)分别转染BmN细胞,48 h后收集细胞,检测萤光素酶活性。结果显示,与对照组相比,模拟物转染组的萤光素酶表达量极显著降低,抑制物转染组的萤光素酶表达量极显著上升(图4C)。说明miR-0031-3p在细胞水平可显著抑制BmFib-L基因的表达,也表明合成的模拟物和抑制物具有生物活性,可用于后续体内实验。
2.5 家蚕体内miR-0031-3p对BmFib--L表达的抑制
在家蚕体内过表达miR-0031-3p,36 h后,BmFib-L的表达量相较于阳性对照显著下降;而注射抑制物(inhibitor)的个体中BmFib-L的表达量显著高于阳性对照组(图5)。证明miR-0031-3p在体内对靶基因BmFib-L的表达具有抑制作用。
3 讨论
基于生物信息学软件的miRNAs预测,是研究miRNAs对靶标基因调控功能的第一步,且随着分子生物学技术的发展和对miRNAs认知的深入,更多的miRNAs独特的性质或者结构特征被编入生物信息学软件的程序中,但是这些软件无法做到完全精准地筛选,仍需要大量的相关验证实验来佐证。本实验从前期分析中获得对丝素蛋白基因表达具有潜在调控作用的家蚕miRNAs[16],获得了1个候选miR-0031-3p,生物信息学预测表明,miR-0031-3p在BmFib-L3´UTR有结合位点,且分别在细胞水平和个体水平上证实miR-0031-3p对BmFib-L表达有抑制作用。

图4 miR-0031-3p在BmN细胞中对BmFib-L的表达调控Fig.4 BmFib-L expression regulated by miR-0031-3p inBmN cells
家蚕5龄幼虫,特别是处于第3—5天盛食期的5龄幼虫,体内蚕丝蛋白大量合成,这与各种水平的协同调控密不可分。家蚕蚕丝蛋白基因表达系统是一个复杂的调控网络系统,不仅有转录因子(transcription factor,TF)的协同参与,还有家蚕miRNAs的参与[17]。转录水平的调控,主要是由于反式作用因子与顺式作用元件结合,正调控或负调控蚕丝蛋白基因的表达[18]。而大量研究表明,bmo-miRNAs在转录后水平对蚕丝蛋白基因的表达起着抑制作用[7,14]。家蚕丝素由BmFib-L、BmFib-H和P25这3个基因的表达产物按照6∶6∶1的比例组成,如何维持这种特定的比例,以及在这些基因的表达过程中,miRNAs在转录后水平的调控是否对其具有某种影响,尚不得而知。

图5 在体内过表达和抑制表达miR-0031-3p后BmFib-L的表达检测Fig.5 BmFib-L expressionin vivo under the conditions of miR-0031-3p overexpression and inner miR-0031-3p inhibition
正是由于多种基因在不同水平上的相互作用,才使得对基因表达调控网络的研究更加复杂。对miRNAs和转录因子协同调控靶基因机制的研究表明,两者之间可以形成多种多样复杂的调控回路。对哺乳动物和酵母的基因组研究发现,miRNA和TF能协同调控共有的靶基因,在miR-TF共调节的网络中,TF可以调节miRNA,或受miRNA调节,形成多样性的前馈环路(feed forward loop,FFL)[19]。miRNA和TF除了前馈环路,还有复杂的反馈调节,如PITX3特异性地诱导miR-133b的转录,而其自身活性在转录后通过FFL被miR-133b下调[20]。总之,由于丝腺细胞转录因子和众多miRNAs对蚕丝蛋白基因表达的协同和拮抗调控,才使得蚕丝蛋白最终能够高效地合成。但是,要清楚地阐明蚕丝蛋白表达调控的分子机制,还需要更多更深入的研究。
