脑血流自动调节:从理论到临床转化及检查流程的标准化
2019-05-23韩珂胡汉华
韩珂,胡汉华
脑血流(cerebral blood flow,CBF)存在于人脑中一个约600 km长,具备协同作用且相互连接的血管网内。在此血管网系统中,脑动脉、小动脉和毛细血管为大脑提供O2、能量和营养,而脑静脉将CO2和代谢废物从大脑中排出。脑几乎没有能量储备,必须通过血流持续供应O2和能量。
脑血管的适应性调节机制有助于保证脑在各种条件下均可获得充足且适当的血液供应。包括:平均动脉血压(arterial blood pressure,ABP)在一定范围内变动时,保持脑灌注稳定能力的CA;脑内动脉PaCO2/pH改变时,保持脑灌注稳定的血流动力学反应的脑血管运动(舒缩)反应性(cerebral vasomotor reactivity,VMR)。以上2种调节机制针对的是静息状态的脑血流调控。此外,细胞活性增加时,CBF通常也会增加,这是通过神经血管耦联(neurovascular coupling,NVC)调整脑灌注以适应大脑活动增强时细胞功能增加的高代谢需求,又被称为功能性充血,目前是一个比较活跃的研究领域。
上述3种脑血管的适应性调节机制均通过神经血管单元(neurovascular unit,NVU)起作用。传统NVU位于脑循环的末段,由小动脉、微血管、壁细胞如血管平滑肌细胞和周细胞、内皮细胞、星形胶质细胞、神经元及小静脉构成。上述结构不但在神经血管耦联中各司其职(如壁细胞具有收缩性,能够直接调控血管的直径和血流),而且与动脉、小动脉和脑微循环毛细血管段的神经元之间相互作用;同时通过介导脑血管扩张和收缩的细胞信号通路进而调控CBF使其增加和减少[1-3]。在许多神经系统疾病的早期阶段,当CBF调节的细胞和分子机制异常,CBF、O2输送和神经元活动不匹配,出现神经血管功能连接中断,神经血管将失耦联[4-5]。近年来,NVU的概念逐渐扩展为更大范围的“血管神经网络”[6-8],包括在生理和病理条件下维持脑血流所需的全部细胞及结构,除了传统的毛细血管内皮细胞、周细胞和被星形细胞端足包裹的基底层、内皮细胞、神经元和星形胶质细胞,还包括平滑肌细胞、非毛细血管内皮细胞、血管周围神经、成纤维细胞、平滑肌祖细胞和免疫系统细胞及侧支血管、血管周围神经和静脉。正是依赖于这个血管神经网络的精细和复杂的协同合作,才实现了脑血流的精确调控,支持了大脑正常的稳态和功能。
TCD可以同步动态监测颅内血管的血流速度(cerebral blood flow velocity,CBFV)。假设颅内血管的直径不变,血流速度可以代表脑血流。通过TCD监测颅内血管的血流速度,得以实现实时同步监测生理或病理条件下由外部或者内部刺激诱发的NVU的变化和反应,进而分析这些机制调控下的脑血流改变。
由于人体研究更适合阐述CA的机制,本文结合团队多年的临床研究积累的经验,主要关注的是人体CA的生理和临床转化应用,包括CA检查流程的的标准化。
1 脑血流自动调节的生理
CA的概念由Lassen等在1959年首次提出,是当ABP在60~150 mm Hg之间波动时,CBF保持稳定的能力。CA保护脑,避免低血压导致的脑灌注不足,或高血压导致的脑充血、过度灌注[9]。
CA的基础是通过小动脉和毛细血管括约肌调节脑血管的阻力(cerebrovascular resistance,CVR)。关于机制,主要是4种学说,包括肌源性、神经源性、内皮性和代谢反应机制。肌源性张力是压力增高时小动脉及其平滑肌收缩,压力降低时舒张[10]。跨壁压力快速变化(ΔP=10~25 mm Hg/s)将触发血管直径的即时变化[11]。跨壁刺激开始和血管机械应答开始之间的潜伏期通常<250 ms[12]。代谢机制发生在较小的血管,局部微环境的变化会影响血管舒缩反应,例如,低于自动调节下限的低血压导致了脑血流降低,进而导致CO2蓄积,由于调节存在则小血管扩张,PaCO2每增加1 mm Hg,脑血流增加近4%。相反,高于CA上限的高血压导致高灌注和CO2减少,相应地血管收缩,PaCO2每降低1 mm Hg,脑血流减少4%[13]。该反应已经被归因于脑血管平滑肌对H+的反应[14]。神经源性机制也被称为“神经血管耦联”,包括对中、小直径血管的控制。神经元分泌具有血管活性的神经递质,如血管扩张剂乙酰唑胺、NO及血管收缩剂5-羟色胺和神经肽Y[15]。通过红外视频显微技术观察大鼠的神经元之间和邻近的微血管,发现微血管对神经元间去极化的反应是收缩[16]。内皮性机制是指内皮细胞产生了多种信号,如内皮细胞分泌血管扩张剂NO等,以及血管收缩剂如内皮素-1、血栓素A2等,影响正常和疾病状态下脑血管的张力[17]。
CA分为2种类型:静态的自动调节和动态的自动调节。sCA是调整脑血流适应在数分钟或者数小时内缓慢/渐进改变的血压,是在TCD技术应用临床之前,因无法实现同步,故记录的是滞后的数据。TCD问世后,由于具有高时间分辨率,可以实现即时同步,故dCA可以在数秒钟内对血压的即时变化做出反应,允许持续测量CA,实现对血流动力学的逐波分析。
CA及脑血流与昼夜、运动、强迫呼吸(伴随着动脉血PaCO2的变化)、体位和功能活动均有关,饮食、月经周期的激素改变、麻醉剂也是影响因素。所以,在队列研究(在相同条件下评估每例患者)或者个体前、后比较的纵断面研究中,进行CA实验时,必须要考虑这些波动因素的影响,以便实现标准化操作,提高该检查的可重复性及多中心之间比较结果。
2 脑血流自动调节的检查方法
动物研究发表始于20世纪60年代。与爬行动物比较,人类更易受直立重力影响,因此,关于CA的机制可能不同。而且随着TCD的引入,直接无创地研究人体受试者已经成为可能。CA的检查方法分类见表1。
sCA是通过药物干预实现脑灌注(血)压的变化。
dCA包括外界诱发血压或者自发血压波动2种类型。其中外界诱发的dCA是通过刺激-反应的方法,分析血压快速下降之后,脑血流速度的动态变化(直到脑血流速度再次达到稳定)。简而言之,是给予无创的即时或者周期性的刺激。方法主要如下:①下肢袖带释放实验,用血压袖带阻断双下肢近端(大于收缩期血压)2~3 min,然后快速放气[18]。由于诱发了收缩期血压快速下降(大约20 mm Hg),正常情况下,脑血流速度将每秒上升达20%。下肢袖带释放实验禁忌证是下肢血管病或者下肢骨折[19]。该刺激不能代表日常生活中的生理状况(如体位变化或者药物刺激)。下肢袖带释放实验是在仰卧位进行的,因此,卧床的患者也适用。②颈动脉压迫实验或者短暂充血反应实验,指在尽量靠近颈部的位置压迫颈总动脉(注意:压迫实验有效的标准是颈总动脉血流速度至少下降30%~50%),3 s后再解除压迫[20]。由于压迫引起了小动脉的代偿性舒张,诱发了短暂的充血反应(transient hyperemic response,THR),计算公式为:THR系数(transient hyperemic response ratio,THRR)=充血时血流速度/基线血流速度,其中充血时血流速度=压迫解除后2个收缩期血流速度的均值;基线血流速度=压迫前5个收缩期血流速度的均值。正常值是1.105~1.29。压颈动作有产生栓子的风险,且患者不舒服,限制了该方法的重复应用。③瓦氏动作(valsalva maneuver,VM)持续用力吹气,维持在30~40 mm Hg,持续15 s能引起血压变化及相应的CA反应[21]。但是,胸膜腔内压的增高也会导致颅内压增高,进一步降低灌注压,及存在呼气末PaCO2增高的可能,是影响CA的干扰因素。④规律的缓慢呼吸是另一个有效的方法,但同样的,也存在增加潮气量及诱发测试期间低碳酸血症的风险[22]。⑤“坐-立位实验”模拟生理状态下的血压下降,受试者坐位持续5 min(下肢抬高90°),转为立位持续1 min,5 min后再重复一遍坐位和立位[23]。该方法与下肢袖带释放实验的结果类似,已被证实是有效的[24]。⑥其他诱发血压波动的方法,如周期性蹲坐、被动抬头直立倾斜实验、等长握力练习(需要患者配合)及冷压实验,其中一个较复杂的技术是下肢负压实验,将双下肢置于呈正弦波的负压舱(桶)中,实现血压的周期性变化,该负压导致下肢血流的重新分布和血压下降[25]。但这个过程可使肥胖者不适,也不太可能被实现,更被批评可能导致损伤CA本身。
与外界诱发的CA方法不同,自发的dCA是记录血压和脑血流的自发的波动。该方法始于20世纪90年代,由于不需要受试者配合任何诱发动作,简单易行,在临床应用广泛,目前是CA的主流检查方法[26-28]。但由于之后处理的分析方法不同,对检查数据设置的要求也不同,而且数据的分析方法较复杂。
3 脑血流自动调节的分析方法
基于血流、血压呈线性关系的假设,分析数据的常用指标如下:脑血管阻力(cerebrovascular resistance,CVR)=均值BP/均值CBF(单位:mm Hg·mL-1·min-1)[29]。在TCD的研究中,CVR指数(CVR index,CVRi)=均值BP/均值CBFV(单位:mm Hg·cm-1·s-1)。搏动指数(pulsatility index,PI)=(收缩期峰值血流速度-舒张期末血流速度)/均值血流速度。PI值是量化微小血管收缩、舒张阻力的常用工具,它与稳定条件下的CVR的意义不同,在描述CA的特征时PI似乎没那么有用,因为条件改变时,PI并不总是以与CVR相同的方式做出反应[30]。另一个量化CA的方式是当脑血流接近0时的BP值即为临界关闭压(critical closing pressure,CrCP,单位:mm Hg)。

表1 CA的检查方法
更复杂的分析d C A特性的是时域分析和频域分析[26-28,31-35]。自动调节指数(autoregulation index,ARI)可用于时域分析[31]。应用该指数的技术背景是假设脑血流速度被动随血压下降,利用计算机构建了ABP骤降后,CBFV变化的10个(0~9)标准应答模型曲线。如果被评估的曲线符合这个模型且ARI=0,则代表无CA,ARI=9,则代表CA最佳,故ARI 0~ARI 9,代表对血压下降的调节能力越来越强。这种分析方法最初针对的是下肢袖带释放实验,也被广泛用于其他检查方法[24]。而自动调节斜率指数(autoregulatory slope index)作为ARI的替代,评估CA响应斜率的陡度,显示出与ARI良好的相关性。恢复率(the rate of recovery,ROR)=[(CVR指数的差值/时间差)/平均ABP的差值]×(脑血流速度/s),是通过分析血压下降刺激脑血流速度的恢复时间,评估CA的有效性。
另一个在时域内评估CA的分析方法是血压和脑血流速度之间的相关系数(the correlation coefficient,Mx),或者皮尔森相关系数[32]。每5 s的平均值为一个单位,再以每3 min为单位(共36个单位时间)计算均值,然后将所得数值进行灌注压与平均脑血流速度的相关性分析,这个相关系数被定义为平均速度指数,若为0或负值,提示CBFV和CPP之间无关或负相关,即血压与脑血流速度之间存在时间差,并非完全同步变化,故CA未受损,调控正常;若为正值,提示CBFV和CPP之间正相关,即完全同步变化,故CA受损。Mx是CA随时间变化的一个新的持续监测的指标。与传递函数分析不同的是,当线性关系不存在时Mx仍然有效。
传递函数分析(transfer function analysis,TFA)是评估频域的方法,用于分析逐波的血压和脑血流之间的关系[26-28,30,35]。简言之,通过分析输入信号血压和输出信号脑血流之间的即时变化,量化CA[30]。该分析方法的参数是3个:增益(或振幅),相位差,一致性函数(简称一致性)。有效的CA使增益衰减,因此,低增益代表CA存在,而高增益提示CA的有效性减弱。CA存在时血压和血流之间的相位差是正值,当CA能力下降时,则伴随着相位差消失,转化为时域,相位差为0(血压和血流振荡之间无时间延迟)代表CA消失[30,36]。一致性描述的是血压和血流之间的线性关系,一致性高提示呈线性关系,而一致性接近0提示无线性关系。不同频段内各个参数的值和意义不同,需要进行区分,低频振荡(也称为M波)可能反映了交感神经张力的变化,这是由平均ABP的自发变化引起的,而极低频振荡(也称为B波)似乎反映了颅内压的自发振荡,并由其他机制触发。CA的分析方法见表2。
4 自发的动态脑血流自动调节标准化方案的探讨
针对诸多的CA的检查方法,对应的CA的分析方法也诸多,但至今无公认的金标准。CA的概念代表了BP(刺激或输入信号)和CBF(反应或输出信号)之间的动态关系,假设CA被简化为一个线性控制系统,由于临床广泛采用的检查方法是自发动态的CBFV与BP波动法,那么基于BP自发波动的TFA是目前研究中常用的分析方法。其理论基础是TFA可获取频率依赖的增益和相位评估,而且还能根据一致性函数评估这些数据的可靠性,所以《传递函数分析dCA:源于国际CA研究网络的白皮书》推荐了TFA的参数和设置,旨在完善和标准化dCA,使检测结果更稳定、更可靠[35]。本团队自1998年首次发表应用频域方法分析自发dCA的研究以来,在临床研究中积累了关于仪器设备的选择、操作步骤、检查参数、报告内容及临床解读的丰富的实践经验[26]。
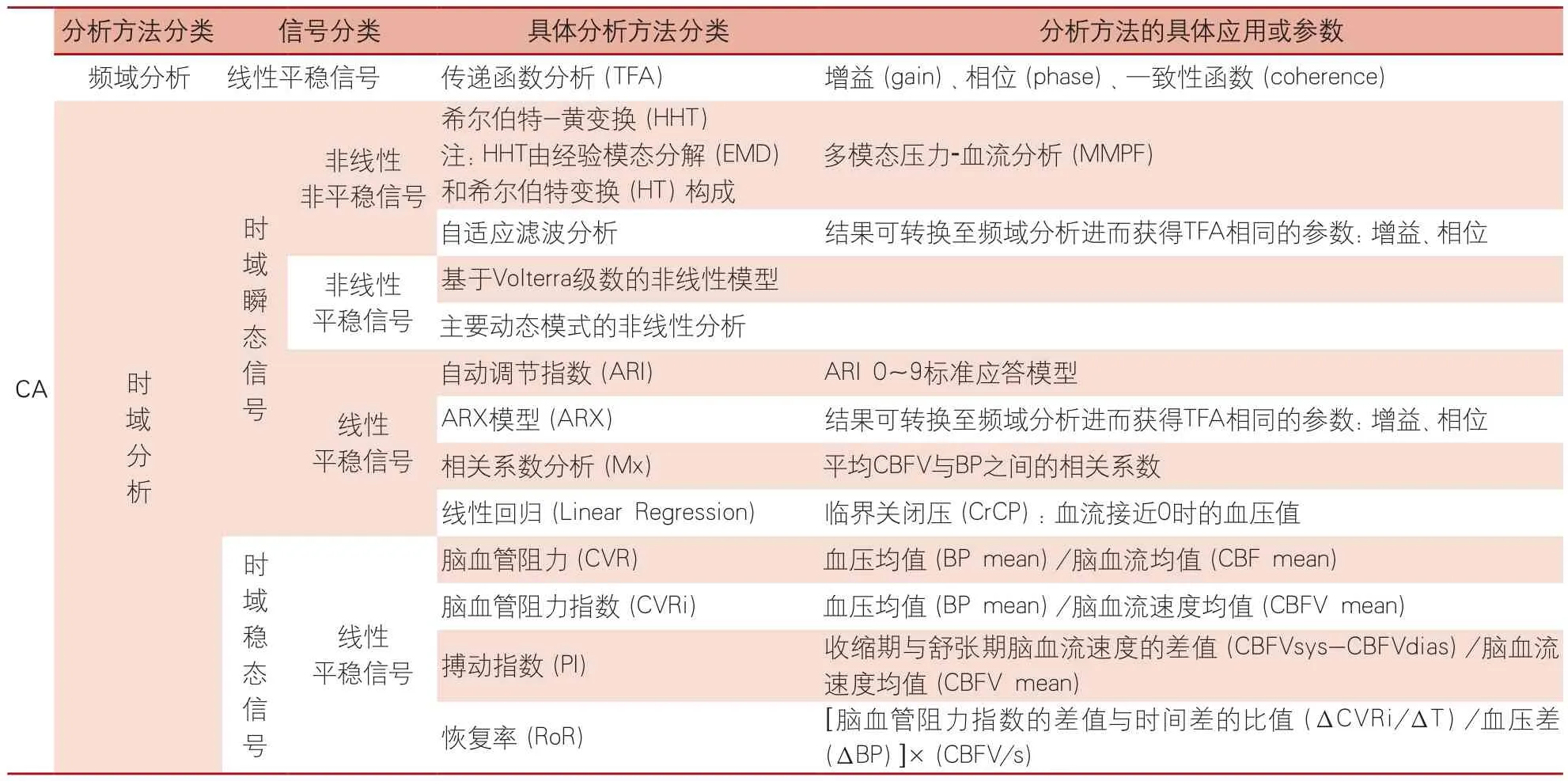
表2 CA的分析方法
4.1 仪器设备 以TFA分析方法为例,临床应用中的常规配置:①TCD仪。是无创的检查设备。配备2.0/1.6 MHz监护探头及监护头架,或者选配4.0/8.0 MHz探头及其配套的监护头架(目前深圳市德力凯医疗设备股份有限公司可定制)。需要配备实时的血流监护软件。②无创性连续逐波血压监测仪。此仪器是无创的检查设备。配备手指动脉容积夹(即指套,此为消耗品),容积夹按照尺寸分大、中、小规格,分别匹配不同粗细的手指。配备校正血压用的袖带血压。③呼气末CO2分析仪(或模块)。此仪器是无创的检查设备。常采用红外线法或者质谱仪法测定呼气末CO2。配备规格相同的鼻导管(一次性的消耗品)。④连续心电监测仪。此仪器是无创的检查设备。选配。目前大多数仪器通过CBFV的波形可以间接算出心率,但一些专业软件需要配备连续心电监测。⑤数据整合设备。选配。是整合以上多个数据达到同步输入、输出的设备(如多功能数据采集卡)。⑥选配其他设备。根据临床研究的需要,监测参数不同,选择有创或者无创的检查设备,如近红外光谱仪(near-infrared spectroscopy,NIRS),用于无创测量局部脑氧饱和度;脑组织血氧监测仪,用于无创测量局部组织氧分压;脑血氧和血流监测一体机,属新型设备,是以色列Ornim医疗有限公司的CerOx(将近红外与局部低功率超声结合,配无创探头);颅内压监测仪,配颅内导管,用于有创测量颅内压;脑血流和无创连续血压监测一体机,是新型设备,深圳市德力凯医疗设备股份有限公司的EMS-9D Pro(实现了脑血流及无创连续逐波血压监测的同步输入输出,配无创自动监护探头、压力感应指套等)。⑦专业分析软件。包括离线分析和在线即时分析软件。
4.2 操作步骤
①对检测环境及受试者的一般要求。检测需要在有空调的环境中,理想温度是22~24 ℃。如果检测静息状态下自发的CA(基线),应该尽量避免干扰,如视觉或者听觉刺激(包括人员进出的干扰)。由于昼夜节律的变化,推荐在相似的时间段检测,以保证可重复性。
受试者检查前至少4 h避免饮用含咖啡因的饮料、巧克力和难消化食物,还须在检查前至少12 h避免运动和摄入酒精。保健品和各种药物也能影响分析结果(如TFA),需要根据实验目的酌情考虑。受试者应休息15 min(确保血压、心率和心搏量稳定)后,取仰卧位(需同时记录头的位置)或者坐位(需双下肢不交叉)检测。
②选择脑血流速度信号。记录MCA血流速度之前,先戴监护头架,固定好探头,将TCD机器调为双通道单深度模式,监测双侧MCA,深度分别为50~65 mm,取样容积10~15 mm3,增益的调整以血流速度频谱的包络线平滑,无毛刺样改变为宜(在临床工作中发现,DWL TCD机器增益调整为38或者52时,其频谱包络的平滑效果最佳;而德力凯TCD机器对增益无特殊要求)。
双侧颞窗穿透不良者,可尝试监测双侧PCA,深度分别为60~70 mm,取样容积10~15 mm3,鉴于CA评估对脑血流速度包络线平滑度的要求比较高,在MCA获取失败的条件下,PCA的失败率也较高。本团队尝试应用4~8 MHz探头及头架(自行研制)监测双侧ICA颅外段评估CA,与同侧MCA比较,也是一个有效的选择,尽管ICA和MCA的调节结果存在差异[37]。
③选择血压信号。记录连续逐波血压之前,需要高度校准器对戴指套侧的手指与心脏的高度差进行校准,避免手的位置的高低对准确性的影响。需要同时用袖带血压校正逐波血压的准确性。后期的数据分析需要保持血压信号的连续性,故建议校正完成后,关闭血压的自动校正功能。
④选择呼气末CO2信号。记录CO2波形之前,先将鼻导管的鼻子端放到鼻孔下边,另一端的采样管经过滤器连接到CO2仪器的进气口。CO2波形的高度代表CO2浓度。由于吸气中无CO2,呼气中出现CO2,正常情况下,吸气期间CO2波形是逐渐下降,呼气期间逐渐上升。波形出现的频率是呼吸频率。监测CO2信号,用于判断自主呼吸,以便调整呼吸维持稳定,避免过度通气或者通气不足。因CO2会显著影响CBF,故应记录和重视任何明显的PaCO2波动(如>1 mm Hg)。
⑤调试不同设备的信号使之同步化。是否同步化对CA参数的差异性很大(尤其对相位的干扰),所以要特别注意不同设备的信号是否存在延迟输出的问题。
⑥记录时间。因TFA分析要求至少是连续5 min的BP和CBFV数据,所以至少连续监测5 min,要求是在生理条件稳定,BP和CBFV的自发波动不间断的数据。由于Finapres的BP设备存在“physiocals”功能,会造成BP缺失的短片段,建议BP校正后关掉该功能,从而避免影响数据分析。
实践中,鉴于临床采集数据的可用性,建议连续监测10 min。本团队比较了5 min和10 min的数据分析结果,虽然两者的有效性是一致的[38],但考虑到多中心的可比性,建议还是标准化分析5 min数据。
4.3 参数的预设 仅以TFA分析方法为例,该参数预设为TFA分析前的数据准备。
①采样频率。推荐BP和CBFV连续信号进行模拟-数字转换时最小采样频率为50 Hz(即≥50 Hz)。实践中,考虑到设备及数据存储的可行性,通常推荐设置较Nyquist频率高4~5倍。
②数据的格式。BP和CBFV信号的记录采用2种格式,原始波形和(每搏心跳时的)平均BP和平均CBFV。2种格式的相关性很好,但相比较而言,原始波形更易被伪迹等干扰所影响,故推荐采用每搏心跳数据,即将BP舒张值的时间作为每个心动周期的起点、终点,根据波形曲线下面积计算每个心动周期的平均BP和CBFV。
③检查数据是否可用。分析BP和CBFV数据之前,首先检查信号是否存在伪迹,如伪迹连续存在超过3个心动周期,可以由线性插值插补,不会影响分析结果。如果伪迹等干扰持续时间过长则应删除该段数据。但关于通过线性插值的插补而删除的异位搏动的最大个数,一般认为0.03~0.07 Hz频率范围插补的缺失<10 s不会影响分析结果,而0.07~0.5 Hz频率范围每50 s内缺失达5 s,则分析结果不可靠,该数据应弃之。
④缺失数据的处理。通常采用插值法,包括线性插值和仿样插值,推荐采用仿样插值(即三阶多项式)。
⑤为了推进标准化,推荐如下设置,最小的再采样频率4 Hz,去趋势(无),正态化(无),滤波(无),防漏窗(Hanning取样窗),窗长(≥100 s),窗的叠加度(50%),平滑化[用系数为(1/4,1/2,1/4)三角形平均窗],一致性临界值(95%CI,基于自由度或者Monte Carlo模拟)。
备注:关于设置④~⑤建议感兴趣者查阅英文原文或中文译文[35,39]。
⑥参数单位的选择。一致性函数无单位。相位的单位用角度(α0)或者弧度(αrad),两者可以直接换算[公式α0=(αrad/π)×180]。增益的单位用绝对值(cm·s-1·mm Hg-1)或百分比(%·mm Hg-1)。
4.4 报告 以TFA分析方法的结果为例。
4.4.1 报告内容 需要描述特定频带范围内的一致性、增益、相位的均值。具体包括3部分:①频率的范围。频率的范围为0.02~0.5 Hz,最常用的频带分段如下:极低频0.02~0.07 Hz,低频0.07~0.2 Hz,高频0.2~0.5 Hz。②每个频率范围内的参数。包括一致性、增益、相位(即时间差)。③对应参数的平均值及标准差。报告内容是低、中、高频段分别对应的一致性、增益、相位的均值和标准差。
备注:如果可能,还需要提供每个频段内BP和CBFV的功率谱密度,以及BP和CBFV的均值和自身的变异度。由于低于0.02 Hz频率的BP和CBFV的相位和增益不可信,所以频率的下限为0.02 Hz。如果数据的频谱分辨率高且数据长超过5 min,可以尝试分析频率低于0.02 Hz(如0.008 Hz)的数据,但需附加说明相关细节。
4.4.2 报告解读 结合了近年临床研究的实践。
参考值:一致性(极低频:0.51;低频:0.62;高频:0.57);增益(单位:cm·s-1·mm Hg-1,极低频:0.68,低频:0.96,高频:1.20);相位(单位:角度,极低频:53.0,低频:25.4,高频9.38)(备注:考虑到白皮书中的数据未统一标准校正,故此参考值中的相位值偏低。)
一致性,正常情况下在0~1之间变化,表示CBFV随BP变化而变化,通常应>0.4。如果太小,提示CBFV随BP变化呈非线性关系,可靠性差,则该数据不适于TFA分析。如果等于1,提示CBFV随BP变化而完全同步变化,正常情况下呈线性关系的CBFV随BP的变化是存在时间差的,虽然貌似可靠性好,但是代表调节消失。通常在高频段内一致性高,接近1;低频段内一致性相对低,故认为CA主要在低频段内发挥作用。
相位差,通常在0°~90°变化,表示调节能力从差到好,通常在高频段内几乎为0°,表示CBFV随BP同步变化,提示CA差;低频段内是60°左右,提示CA好。
增益,通常>1或者<1之间变化。通常在高频段内>1,表示BP无衰减的传递到CBFV,提示CA差;低频段内<1,表示BP传递到CBFV有衰减,提示CA好。
备注:在输入、输出数据呈线性关系的前提下,“相位”参数较其他TFA的参数更稳定。
5 脑血流自动调节的应用
已知某些临床情况,包括脑外伤、蛛网膜下腔出血、急性脑出血、急性呼吸窘迫综合征、重症监护室的败血症和相关谵妄患者、重度急性脑炎、缺血性卒中(包括ICA狭窄,MCA狭窄等血管狭窄)、糖尿病、血管迷走神经性晕厥、神经退行性病变(如痴呆)、严重的高血压、进行外科手术的患者等,尤其是在重症监护条件下,CA对于维持稳定的脑灌注非常重要。本文针对临床的关注度,重点介绍个体化最佳血压/灌注压的调控、急性缺血性卒中、AD的CA的应用现状。
5.1 个体化平均动脉压的调控 目前CA监测的最新应用是,通过监测CA,估算每个个体的最佳平均ABP和最佳脑灌注压,并明确床边CA监测的可行性。Lucia Rivera-Lara等[40]的综述总结了成人和儿童的观察性研究是通过个体的CA曲线,估算不同人群的最佳脑灌注压和最佳平均ABP,且评估高于或者低于最佳脑灌注压或者平均ABP与预后之间的关系。研究表明,脑灌注压或者平均ABP与CA监测确定的最佳值有显著差异者,更易预后不良,而且在床边连续监测CA是可行的,并且有望被直接用于调控急性期的血压,具有潜在的指导个体化血压管理的应用价值。
有4项研究调查了成人的急性脑外伤,以自动调节监测的最佳ABP为基线,评估其高血压和(或)低血压与功能预后的相关性。其中一项收集了327例患者的用“压力反应指数”评估最佳脑灌注压的研究发现,过低的脑灌注压增加了致命性结局的发生率,而过高的脑灌注压与严重残疾比例增加相关[41]。与该研究结果相似,一项用“低频CA指数”评估最佳脑灌注压的55例患者的队列研究发现,实际的脑灌注压接近低频自动调节指数(基于最佳脑灌注压)与生存率增加相关,而多变量模型发现,实际的脑灌注压和最佳脑灌注压之间的平均绝对差值是死亡率增加的独立相关因素[42]。另一项对18例患者的队列研究发现,用“压力反应指数”估算最佳脑灌注压,实际脑灌注压和最佳脑灌注压之间存在较大差异(>10 mm Hg)的患者,更易预后不良[43]。与上述研究相反,一项用新参数“低频样本压力反应指数”的研究,则未发现最佳脑灌注压与死亡或重度残障之间的相关性,但该指数本身对结局和最佳脑灌注压的估算的预测价值也很低[44]。
针对脑出血(n=25)和动脉瘤性蛛网膜下腔出血(n=38)的研究分别显示,用“压力反应指数”评估最佳脑灌注压和预后的关系,未发现两者之间有显著的相关性[45-46]。而对121例心脏手术患者的观察性研究发现,基于“脑血氧定量指数”预估的低血压,与脑细胞损伤及神经胶质纤维酸性蛋白增高(血清中脑损伤的特征性的生物标记物)相关[47]。
儿童的观察性研究是通过床边监测CA评估最佳平均ABP[48-50]。28例新生儿缺氧缺血性脑病的研究用“血红蛋白容积指数”评估低于最佳平均ABP的血压及与21~32个月后存在运动和认知障碍即预后不良之间的相关性,发现低温治疗复温期间血压严重低于最佳平均动脉血压的新生儿的预后差[50]。另一项纳入30例6个月~16岁的创伤性脑外伤儿童的队列研究也报告了类似的结果,脑灌注压与最佳脑灌注压之间的差异中负偏差的持续时间和波幅的大小与预后不良(GCS评分≥4分)是相关的[48]。
值得注意的是,不同人群和可能存在并发症的患者,估算的最佳平均ABP或者最佳脑灌注压的平均值或者中位数是不同的。例如,脑出血患者的平均最佳脑灌注压(85 mm Hg)比脑外伤患者(75 mm Hg)高,动脉瘤性蛛网膜下腔出血伴血管痉挛者其最佳脑灌注压(98 mm Hg)比无血管痉挛者(78 mm Hg)高。与最佳脑灌注压相比,脑外伤的血压过高或过低均与严重残疾有关,而在接受心脏手术的患者中,仅仅动脉压过低与脑细胞损伤有关,考虑在严重的急性脑损伤、颅内压增高和脑顺应性差的患者中,可能部分是由于脑灌注压过大,静水压力增高导致脑水肿恶化,从而使颅内压进一步增高[41]。
目前关于指南中推荐的血压管理的目标值是非个体化的,遗留了许多疑问,如长期高血压者的最佳血压是多少?相对于无脑损伤的患者,急性脑损伤和颅内压增高患者的脑灌注压的下、上限有不同吗?上述研究通过CA的调控实现的个体化的最佳血压,由于其为脑及其他器官提供了最佳的灌注,故与临床结局预后改善密切相关,说明了实现个体化血压管理的重要性。利用CA实现评估最佳脑灌注压或者血压是一个值得重点关注的领域。目前存在的问题是该项新技术缺乏随机对照实验数据来确定以最佳血压或最佳脑灌注压为基础进行治疗的临床疗效。未来,有望以自动调节为导向,通过前瞻性、大规模、随机对照临床研究评估,实现个体化血压的调控。
5.2 缺血性卒中 另一个重点关注的领域是急性缺血性卒中。Marcel J.H. Aries等[29]发表的系统综述,总结了23项研究(其中16项针对急性卒中,7项针对慢性卒中)。讨论了3个问题:①CA受损了?为什么?CA受损似乎与缺血后血管内皮和平滑肌的功能丧失相关。②受损的范围多大?不仅较大的梗死,而且腔隙性梗死患者的CA也受损。另一方面,CA受损发生在双侧半球,不局限于症状侧。但是,由于缺乏纵断面研究,腔隙性梗死的CA受损是由慢性小血管病引起的,还是由急性梗死引起的,目前尚不清楚。一项小型研究证实了急性缺血性卒中者双侧大脑半球的CA受损,与皮层下卒中相比,皮层卒中的CA受损略明显,而不是显著差异。③时间进程是什么?随访调查研究显示,最初几天内CA的受损恶化,较大卒中患者2周后仍持续存在,而小卒中患者,2周后受损会恢复。据报道,恢复期会持续3个月。慢性卒中患者,因为恶性高血压患者的CA受损,卒中后慢性期CA持续受损时,其动脉高压可能扮演了一个角色。而在微血管病的患者中,也发现了CA受损,并且与慢性白质病变的严重程度显著相关。除了慢性高血压的CA受损,CA的相位的界值移向血压较高侧。这似乎是有意义的,因为大脑可以更好地被保护去预防高血压。但是,在全身低血压的情况下,大脑可能更易受到低灌注的影响。最近,一些研究者假设,对于老年高血压患者,药物降低血压可能改变CA,从而导致认知功能损伤。
CA也已经被用于评估ICA狭窄血流动力学改变的严重度和缺血性卒中的风险。侧支循环是重要因素之一,但是,通过小动脉舒张降低脑灌注的完整的CA的代偿可能也扮演了一个角色[51-52]。研究发现,一般说来,与对侧比较,患侧动脉至少达到70%的狭窄,才能引起狭窄侧血管的CA降低。尽管对此存在争议,但与CA未受影响侧比较,调节受损侧的卒中风险高,受损的CA本身代表了一个独立的危险因素[53]。颈动脉手术中评估CA,发现术后CA功能的整体(部分)有恢复[54-56]。关于MCA重度狭窄者的研究显示,CA受损出现在狭窄侧。双侧ICA重度狭窄/闭塞者其CA也下降。对比而言,PCA中度狭窄者,未发现CA的显著改变,潜在的原因可能是狭窄程度低。
5.3 痴呆 这是一个新兴的领域,由于在AD小鼠模型中,CA受损严重,因此假设受损的CA在AD的病程进展中起作用(如未保护脑免受血压波动的影响,因此导致了短暂的低灌注或者高灌注)。但人类研究的初步数据未证实CA对AD的影响[57]。然而,脑小血管病占全世界痴呆症的40%左右,包括AD,而且最近的流行病学、临床、病理学和实验研究累积的数据表明AD与早期神经血管功能障碍是有关的,有待于进一步的研究来阐明AD与CA之间的联系[58-66]。
总之,结合临床研究的实践,在白皮书的基础上,细化了CA的标准化方案,包括检查方法(推荐:记录自发的动态的血压、血流及呼气末CO2的数据)和分析方法(推荐:TFA分析),为临床科研及进一步开展临床日常诊疗工作提供了可能,助力于相关医院转化应用参考。期待未来更多的中心借助CA的研究解决更多的临床问题,如对血压/灌注压的个体化调控,对痴呆的早期筛查和干预等热点问题。
