miR-30a的表达与上皮性卵巢癌患者预后的关系
2019-05-21
(1.河北大学附属医院妇产科,河北 保定 071000;2.河北大学公共卫生学院,河北 保定 071000)
卵巢癌是发病率最高的三大妇科恶性肿瘤之一,其中约90%为上皮性卵巢癌( epithelial ovarian cancer,EOC)。该病发病早期无特异性症状,易发生侵袭及转移,治疗后易复发和出现化疗耐药,导致其成为妇科肿瘤中病死率最高的疾病[1]。近年来尽管外科治疗方法和手段飞速发展,新的化疗药物和方案不断涌现,但是EOC患者的预后依然没有取得显著改善[2]。因此,寻找新的诊断和预后标志物有助于对EOC患者进行早诊断、早治疗,改善其预后。微小RNA(microRNA, miRNA)可介导基因转录后表达水平,研究发现多种miRNA参与卵巢癌的细胞增殖与分化、侵袭与转移及细胞周期调控等过程,但miR-30a与EOC的关系尚未见相关报道[3]。本研究采用实时荧光定量qRT-PCR法检测EOC患者组织中miR-30a的表达水平,并结合相关临床资料进行生存分析,探讨miR-30a在EOC发生发展及预后中的作用。
1 对象和方法
1.1 研究对象
收集2009年1月至2014年3月在河北大学附属医院妇科住院手术的病人139例,所有病例术后病理学证实为EOC。患者年龄39~68岁(中位年龄54.6岁),其中初治原发肿瘤73例,初治转移肿瘤44例,复发EOC患者22例。初治EOC患者术前未行其他相关手术及辅助治疗,复发卵巢癌患者均满足二次减灭术适应证。组织学分期高/中分化( G1/G2) 86例,低分化( G3) 53例;有/无淋巴结转移者51/88例;有/无腹膜转移者65/74例。FIGO分期:Ⅰ/Ⅱ期94例,Ⅲ/Ⅳ期45例。手术切除肿瘤和癌旁组织进行甲醛固定、石蜡包埋集中待检。标本的使用得到河北大学附属医院伦理委员会批准。
1.2 实验方法
qRT-PCR法检测miR-30a的表达。Superscript II Reverse Transcriptase 1st strand cDNA、TRIzol Reagent、总RNA分离试剂Trizol购自美国Invitrogen公司。miRNA的提取按照美国Ambion公司提供的mirVanaTM miRNA Isolation Kit试剂盒中的步骤进行操作。通过实时荧光定量PCR仪(美国ABI7300型)测定miRNA水平。反应条件:95 ℃处理10 min,95 ℃、60 ℃分别处理15 s、30 s,重复循环40次,以RNU6作为参照,60 ℃时提取荧光信号。所有反应运行3遍。通过2-ΔΔCT方法计算miR-30a的表达量。
1.3 统计学方法
所有资料采用SPSS 22.0统计软件包建立数据库并进行统计分析。其中计量资料采用t检验;计数资料采用χ2分析;采用Kaplan-Meier法进行生存分析并绘制生存曲线;Cox回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-30a在EOC患者组织中的表达

图1 miR-30a在EOC患者肿瘤和癌旁组织中的表达
采用qRT-PCR法对139例EOC患者肿瘤和癌旁组织进行检测发现,肿瘤组织miR-30a的相对表达量高于邻近癌旁组织,差别有统计学意义(t=2.847,P<0.001) ,见图1。
2.2 miR-30a与EOC患者临床病理特征的关系
在139例EOC患者中,有65例miR-30a呈低水平表达,74例呈高水平表达。miR-30a高表达含量与低分化的组织学分期(χ2=9.452,P=0.002)、发生淋巴结转移(χ2=4.256,P=0.039)、发生腹膜转移(χ2=8.182,P=0.004)、较差的FIGO分期(χ2=8.539,P=0.003)有关,差异均有统计学意义;与年龄无关(χ2=2.742,P=0.098)。见表1。

表1 miR-30a与EOC患者临床病理特征的关系
2.3 miR-30a的表达与EOC患者预后的关系
miR-30a低表达组的中位生存时间为50.7个月,高表达组为41.6个月,EOC患者miR-30a高表达者生存期较短,差异有统计学意义(χ2=8.764,P=0.003),见图2。miR-30a的表达是EOC患者生存的独立预测因素,HR=2.702(95%CI为1.285~5.702),见表2。
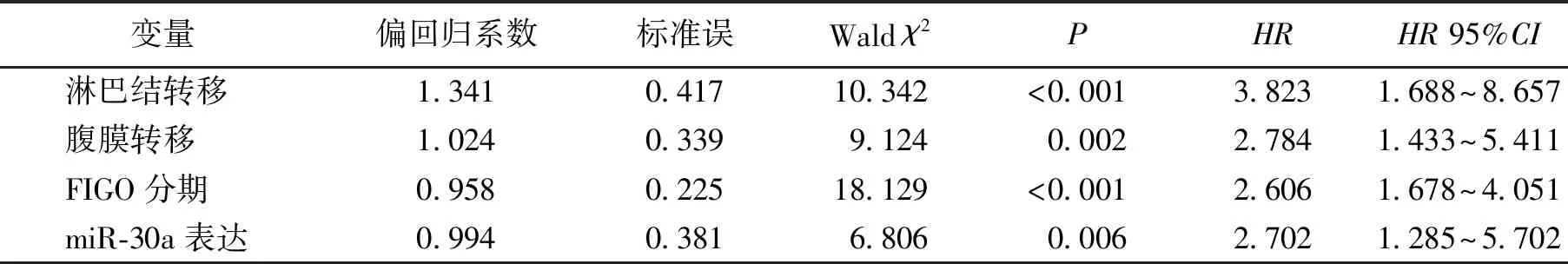
表2 EOC患者多变量Cox回归分析结果

图2 EOC患者不同miR-30a表达水平生存分析
3 讨论
miRNA是一类长度为20~25个核苷酸的非编码蛋白质的小分子RNA,可根据碱基互补配对原则结合于靶基因miRNA后对靶基因发挥干扰或降解效应进而影响其表达,有助于调控基因的转录水平。研究表明参与人体多种生理和病理过程,包括细胞增殖与分化、侵袭与凋亡和细胞周期调控等[4]。
miRNA在生物标本中高度稳定,具有组织学特异性,可起到癌基因或者抑癌基因的作用,通过调节肿瘤基因或其通路基因的表达来影响肿瘤的发生发展过程[5]。因此,对特定肿瘤的miRNA进行检测有助于对患者进行早诊断、早治疗,改善其预后。
miR-30a位于染色体6q上,与一些疾病密切相关,已被发现在胃癌、肝癌、直肠癌中呈异常表达[6-8]。miR-30a可通过调节下游ZEB2和Notch1等基因的表达,影响miR-200c的表达,抑制乳腺癌细胞的侵袭和远端扩散,控制肿瘤在体内的生长和转移[9-11]。Zhang等发现miR-30a过表达通过降低体外培养的前列腺癌细胞周期蛋白CCNE2的表达显著抑制细胞生长,降低体内致瘤性[12]。在甲状腺癌中,miR-30a降低了细胞侵袭和迁移、上皮-间充质转化标志物水平、赖氨酸氧化酶(LOX)表达和转移能力,在甲状腺癌发生发展中起到关键性作用[13]。借助新一代测序技术(NGS),Tsukamoto等研究发现miR-30a在子宫内膜癌患者血浆中异常表达,可作为子宫内膜癌潜在的无创标志物[14]。
尽管miR-30a与肿瘤的相关研究较多,但与EOC的关系尚未见相关报道。本研究采用实时荧光定量qRT-PCR法检测139例EOC患者组织中miR-30a的表达水平,发现肿瘤组织miR-30a的相对表达量高于邻近癌旁组织,且miR-30a高表达含量与低分化的组织学分期、发生淋巴结转移、发生腹膜转移、较差的FIGO分期有关。生存分析发现EOC患者miR-30a高表达者生存期短于低表达者,经多变量分析表明miR-30a的表达是EOC患者生存的独立预测因素。前期其他学者的研究证明miR-30a抑制肿瘤的生长和转移,肿瘤组织中的miR-30a表达低于正常组织,而本文的研究结果相反,其原因可能为本研究所观察对象既有初治原发肿瘤,又有初治转移肿瘤和复发EOC患者,而笔者的前期研究表明,在化疗耐药性卵巢癌中miR-30a表达高于化疗敏感性EOC[14],因此初治转移肿瘤和复发EOC中的高表达miR-30a可能使得本研究与其他研究结果存在差异,接下来笔者将进一步采用多中心随机对照临床试验,增加样本量,严格对EOC患者分组,深入研究miR-30a在卵巢癌发生发展及预后中的作用机理和通路。
综上所述,miR-30a的表达是EOC独立的预后因素,可能成为EOC新的诊断与预后标志物。
