拟南芥CKI1基因上游转录调控因子筛选及鉴定
2019-05-21刘振宁袁黎VenkatesanSundaresan余小林
刘振宁,袁黎,Venkatesan Sundaresan,余小林
拟南芥基因上游转录调控因子筛选及鉴定
刘振宁1,2,3,袁黎2,4,Venkatesan Sundaresan2,余小林3
1. 临沂大学农林科学学院,临沂 276000 2. 加州大学戴维斯分校植物科学系,加利福尼亚州戴维斯 95616,美国 3. 浙江大学农业与生物技术学院,杭州 310058 4. 西北农林科技大学园艺学院,杨凌 712100
拟南芥CKI1 (cytokinin independent 1)是双组分信号系统中一个组氨酸激酶蛋白,通过作用于下游组氨酸磷酸转移蛋白激活双组分信号通路,在调控胚囊中央细胞命运分化和发育过程中具有重要作用。然而目前对于基因上游转录调控因子还知之甚少。本研究分析了不同长度的启动子在拟南芥胚囊中的活性,并利用酵母单杂交技术对上游转录调控因子进行了筛选和鉴定。结果表明,位于内含子区域中的片段表现出与启动子全长相一致的表达活性。进一步选取3个串联重复的片段用于构建诱饵表达载体,同时,选取拟南芥雌蕊构建cDNA文库,通过酵母单杂交筛选获得226个阳性克隆。去除低质量及冗余重复的序列后共获得66条可读序列,其中8条序列对应的基因编码具有DNA结合功能的蛋白。研究结果为进一步揭示基因的转录调控机制提供了重要参考信息。
;转录调控;酵母单杂交;拟南芥
双组分信号系统(two-component system, TCS)最初是在研究大肠杆菌()氮调节蛋白系统时发现的[1]。最简单的双组分信号系统包括用于感应输入信号的组氨酸激酶(histidine kinase, HK)和用于调节输出信号的反应调节因子(response regulator, RR)两种元件,原核生物常以简单的双组分信号系统形式存在。在细菌、酵母、粘液菌和植物中,双组分信号系统进化为包括组氨酸激酶(histidine kinase, HK)、组氨酸磷酸转移蛋白(histidine phosphotransfer, HP)和反应调节因子(response regulator, RR)的多步磷酸化传递的双组分信号系统。
CKI1(AT2G47430)是第一个被发现的具有细胞分裂素受体特征的组氨酸激酶蛋白,在不添加细胞分裂素的培养基上,的过量表达能够导致特异的细胞分裂素应答反应[2,3]。CKI1蛋白主要定位于内质网和细胞质膜上[3~5]。Deng等[6]采用qRT-PCR方法研究了基因的表达模式,发现主要在拟南芥()的开放花、角果和花蕾中表达。Hejatko等[7]利用原位杂交技术和启动子GUS融合蛋白分析表明,在胚囊发育的FG1 (female gametophyte 1)时期到成熟胚囊期FG7时期均稳定表达,尤其在成熟胚囊期的中央细胞中表达量比较高,在卵细胞和助细胞中的表达量比较低。另外,在拟南芥花序的维管组织中也有明显的表达信号[8]。功能缺失突变体()植株的营养生长阶段没有明显的表型,但雌配子体表现为50%败育的表型。遗传学实验证据表明,功能缺失的突变体其T-DNA插入位点不能通过母本传递到子代中,因而也无法获得纯合的功能缺失突变体。对突变体胚囊的细胞学观察表明,突变体胚囊的败育发生在FG4时期向FG5时期的转换期[4,6,7,9]。水稻()中同源基因()的功能缺失突变体也表现出雌配子体败育表型[10]。本课题组前期研究发现,CKI1通过作用于下游AHP2、AHP3和AHP5调控中央细胞的命运分化[5,11,12],但是目前仍不清楚该基因的转录调控机制。Dobisova等[13]对转基因株系进行EMS诱变,对上游转录调控因子进行筛选,发现基因的表达受到光敏色素蛋白的调控,并且启动子区域存在大量G-box和GATA motif等光周期响应元件,进一步通过酵母单杂交实验也证明PIF3和CCA1等受光敏色素蛋白调控的转录因子能够与启动子区域互作。但是筛选到的光敏色素蛋白相关转录因子的突变体并没有表现出突变体的表型,由此推测,在胚囊发育 的阶段还存在其他转录调控因子能够调控的表达。
酵母单杂交是根据在细胞内DNA结合蛋白与DNA顺式作用元件结合调控报告基因表达的原理,用来鉴定调控基因转录的上游转录因子基因的一种有效方法[14]。随着酵母单杂交系统的不断发展和完善,该方法近年来已被广泛用于克隆和鉴定各种动植物的转录因子。本研究利用酵母单杂交技术对上游转录调控因子进行了筛选和鉴定,为进一步揭示基因的转录调控机制提供了新的数据及重要信息。
1 材料与方法
1.1 材料
拟南芥Col-0野生型为本实验室保存。拟南芥种子先用含20% Bleach和0.1% Tween 20的消毒液进行表面消毒10 min,然后使用灭菌的双蒸水清洗3~5遍,置于MS培养基上培养。待幼苗两周大的时候,将幼苗转移到带有培养基质(草炭∶蛭石∶珍珠岩为6∶3∶2)的穴盘中培养,培养条件保持16 h光照/8 h黑暗周期,温度为22℃,相对湿度为60%。
1.2 不同片段长度CKI1启动子载体的构建
因为酵母基因组比植物基因组小得多,酵母启动子一般都比较短,如果整合到酵母基因组中的外 源启动子太长,可能会影响目的蛋白和启动子中顺式作用元件结合的效率,而且会造成更多的假阳性[15,16]。因此,酵母单杂交一般选用几到几十bp的特定顺式作用元件或者尽可能短的有启动活性序列来构建诱饵表达载体。首先将基因启动子平均分成若干区段,分别设计引物序列进行扩增,引物序列见表1。然后通过Ⅰ和Ⅰ双酶切克隆到-CAMBIA1300中间载体中,构建带有相应启动子片段的--CAMBIA1300表达载体(图1)。
1.3 转基因株系的筛选和观察
经过测序验证后,构建成功的表达载体通过电转化法转入农杆菌AGL1菌株中,并通过浸花转化法转入到拟南芥野生植株中[17,18]。待转化的拟南芥植株种子成熟,收集和干燥种子,然后通过上述拟南芥种子表面消毒和播种方法,将种子在含有25 mg/L潮霉素B的MS培养基中进行筛选,最后将筛选获得的幼苗转移到培养基质中正常培养。

表1 本研究使用的引物信息
下划线序列表示引物中相应的酶切位点。

图1 不同长度的CKI1基因启动子活性分析载体构建示意图
启动子区域包括4段5′UTR(粉色区域)、3段内含子(蓝色区域)和5′UTR上游序列(紫色区域)。F、F1、F2、F3、F4、F5和R1、R2、R3分别为上、下游引物。
对拟南芥胚囊中荧光信号进行观察。首先在载玻片上滴几滴灭菌的双蒸水,然后在解剖镜下将选取的雌蕊在双蒸水中使用解剖针解剖开,仅留下胚珠,去除多余的组织,盖上盖玻片,立即在荧光显微镜(Zeiss, Axioskop 2 plus)下观察拍照。
1.4 诱饵表达载体的构建与酵母遗传转化
诱饵表达载体的构建和酵母遗传转化参照酵母单杂交试剂盒(Clontech公司,美国)进行。为提高转录因子和顺式作用元件的识别率和结合率,在诱饵表达载体构建中,本研究使用3个串联重复的片段。首先,使用Ⅰ和Ⅰ双酶切将第1个片段克隆到AbAi载体中,然后使用Ⅰ和Ⅰ双酶切将第2个片段克隆到AbAi载体中,最后使用Ⅰ单酶切将第3个片段克隆到AbAi载体中,完成Bait-AbAi载体的构建。每一步载体构建均经过了酶切和测序验证。然后将诱饵表达载体用BⅠ限制性内切酶切成线性质粒,转入YIH酵母菌株感受态中。最后选取5个单菌落,使用Matchmarker Insert Check PCR Mix 1试剂盒(Clontech公司,美国)进行菌落PCR鉴定含有诱饵表达载体的阳性菌落,选取阳性菌落备用。
1.5 抑制诱饵菌株生长的最低AbA浓度的筛选
选取阳性菌落活化,然后用适量的0.9%NaCl重悬菌液,调制600值约为0.002。分别在含0 ng/mL、100 ng/mL、150 ng/mL、200 ng/mL、250 ng/mL、300 ng/mL、400 ng/mL、500 ng/mL、600 ng/mL、800 ng/mL和1000 ng/mL等不同浓度AbA的SD/-Ura固体培养基涂布100 µL菌液,置于30℃培养2~3 d,观察酵母菌落的生长情况。
1.6 酵母单杂交文库的构建与筛选
Smyth等[19]根据拟南芥花发育不同阶段的形态特征将其划分为12个时期。本研究选取拟南芥花发育阶段在10~12时期的雌蕊提取RNA,然后将所提取的RNA按照Clontech公司单杂交文库试剂盒的操作步骤进行反转录,合成含有SMARTⅢ和CDSⅢ锚定末端的双链DNA (double strand cDNA, dscDNA)。RNA提取参照Invitrogen公司RNA提取试剂TRIzol产品操作说明书进行,RNA纯化参照QIAGEN公司RNA纯化试剂盒操作说明书进行。第一、第二链cDNA的合成、dscDNA的纯化参照Clontech公司酵母单杂交试剂盒进行。
首先将制备好的3 µg dscDNA、6 µLGADT7- Rec载体(经Ⅰ线性化处理)和20 µL鲑鱼精子DNA (10 mg/mL)转入酵母感受态中,转化液涂布在150 mm直径含250 ng/mL浓度AbA的SD/-Leu固体培养基平板上,每个板涂布大约150 µL,同时将100 µL稀释100倍的转化液涂布在SD/-Leu固体培养基平板上作为对照。将平板置于30℃培养箱中倒置培养3~5 d,观察酵母菌落的生长情况并计算转化效率。
转化效率满足要求后,将线性化的融合表达载体GADT7Rec2和获得的SMARTⅢ和CDSⅢ锚定末端的dscDNA同时转入YIH Gold[Bait/AbAi]酵母感受态中,转化液涂布在含250 ng/mL浓度AbA的SD/-Leu固体培养基平板上,在30℃条件下培养3~5 d后观察统计培养基上的单菌落数量。
1.7 阳性克隆鉴定和测序
将能够在含250 ng/mL浓度AbA的SD/-Leu固体培养基上生长的单菌落进一步在含300 ng/mL浓度AbA的SD/-Leu固体培养基上进行划线,经过3次划线后均生长的克隆被认为是阳性克隆。选取阳性克隆,摇菌,提取酵母质粒。以酵母质粒为模板,使用Matchmaker Insert Check PCR Mix 2试剂盒(Clontech公司,美国)扩增目的片段,将凝胶回收的目的片段连接到T载体上,再进一步转化到大肠杆菌中,并选取阳性克隆进行测序。引物序列见表1。
2 结果与分析
2.1 不同长度的CKI1基因启动子活性分析
根据前人对启动子活性的研究,FR2序列(1661 bp)是启动子启动活性所必需的[6,7],但对于酵母单杂交来说并不是特别理想的启动子长度。为进一步获得启动子尽可能短的功能序列,本研究在FR2启动子不同区间设计引物进行分段扩增。首先将序列截短成(1080 bp)、(1661 bp)、(698 bp)、(1279 bp)、(488 bp)、(1069 bp)、(301 bp)和(882 bp)等8个片段(图1),并分别构建了表达载体,转化拟南芥,观察转基因阳性植株胚囊中的启动子活性。结果表明,只有、、和这4段序列具有启动子活性。随后,将这一段序列再次截短为(224 bp)、(581 bp)和(382 bp)等3个片段,分别构建表达载体,转化拟南芥,观察转基因阳性植株胚囊中的启动子活性。结果表明,只有和这两段序列具有启动子的活性(图2,A~P),其表达模式与启动子全长的表达模式一致[5]。研究结果表明,能够被转录因子识别的顺式作用元件位于这个区间的内含子区域。进一步通过 PLACE和PlantCARE在线启动子预测工具对该内含子区域转录调控元件进行分析,结果表明该区域存在对光照、昼夜节律、厌氧感应,以及细胞分裂素和茉莉酸甲酯两种植物激素响应的元件(图3)。

图2 CKI1基因启动子片段F5/R2在胚囊中的启动活性
A和B:大孢子母细胞时期;C和D:功能大孢子时期~FG1时期;E和F:FG2~FG3时期;G和H:FG4时期;I和J:FG5时期;K和L:FG6时期;M~P:FG7时期。两个极核刚完成融合时,在助细胞和卵细胞中能检测到启动子活性,但随后助细胞和卵细胞中的信号消失,仅反足细胞和中央细胞中具有启动子活性。标尺为20 µm。

图3 内含子F5/R2区域中转录调控元件的预测
2.2 酵母单杂交文库的构建和筛选
2.2.1 诱饵表达载体的构建
本研究选取序列作为诱饵序列,并将3个串联重复的片段克隆到AbAi载体中,构建诱饵表达载体3×F5/R2-AbAi。鉴于诱饵表达载体存在报告载体的本底表达,本文首先测试了含有诱饵表达载体的3×-AbAi的YIH Gold酵母菌株(YIH Gold [Bait/AbAi])在不同浓度AbA中生长的情况。与对照相比,AbA能明显地抑制含有诱饵表达载体的YIH Gold菌株的生长(图4,A~J)。在含有100 ng/mL、150 ng/mL和200 ng/mL浓度AbA的培养基中依然有少数菌落的生长,而250 ng/mL浓度以上的AbA能彻底抑制酵母的生长。因此,250 ng/mL浓度的AbA被确定为后续文库筛选最合适的浓度。
2.2.2 酵母单杂交文库的建立和筛选
dscDNA经检测满足建库要求,融合表达载体GADT7Rec2转入YIH Gold[Bait/AbAi]酵母感受态中的效率为1.125×106cfu/µg,也高于1×105cfu/µg的最低转化率要求。将含有250 ng/mL AbA的SD/-Leu培养基上筛选到的单克隆菌落接种到新的含有300 ng/mL AbA的SD/-Leu培养基上继续培养,此过程重复两次。经过3次划线接种均生长的克隆,被认为是阳性克隆。经过3次筛选最终获得226个阳性克隆。

图4 测试含诱饵表达载体的YIH Gold酵母菌株在含有不同浓度AbA的培养基上的生长情况
A:不含AbA;B:100 ng/mL AbA;C:150 ng/mL AbA;D:200 ng/mL AbA;E:250 ng/mL AbA;F:300 ng/mL AbA;G:400 ng/mL AbA;H:500 ng/mL AbA;I:600 ng/mL AbA;J:800 ng/mL AbA。
2.2.3 目的序列的基因功能注释
将上述获得的226个阳性克隆进行测序,然后将测序结果与拟南芥基因数据库中的基因进行比对,去除低质量及冗余重复的序列,共获得66条可读序列。对这66条可读序列进行基因功能注释,发现8个具有DNA结合功能的蛋白,包括RING/ FYVE/PHD zinc finger家族蛋白、染色质组装修饰蛋白、组蛋白、AUX/IAA蛋白等(表2)。根据中央细胞转录组测序数据库[20],进一步分析了这8个候选基因在中央细胞中的表达情况,除了在中央细胞中不表达,其余7个基因在中央细胞中都有一定的表达量。因此,这7个基因可能是上游转录调控因子的候选基因。除了转录因子外,本研究还发现其中36个阳性克隆测序结果为一个功能未知基因—。该基因编码杂相RNA(miscellaneous RNA),是一类庞杂的小RNA分子,具有类酶催化、RNA加工和控制基因表达开关的作用[21]。目前对miscellaneous RNA研究极少,其具体的功能机制尚不清楚。
3 讨论
3.1 CKI1基因的内含子具有启动子功能
绝大多数真核生物的基因是断裂基因,由外显子和内含子间隔组成。外显子是真核生物基因中编码蛋白质的序列,而内含子为非编码蛋白序列。越来越多的研究发现,内含子并非垃圾序列,内含子对基因的表达存在调控作用。目前在很多基因的内含子中发现了基因表达的调控元件,内含子具有启动子的功能。Chang[22]发现猪基因内含子中存在重要的调控元件,可以调控转录的起始来增强基因的表达。Salgueino等[23]发现玉米泛素基因的第一个内含子能够启动表达,具有类似于启动子的功能,对该内含子结构特征的进一步研究发现该启动子具有TATA box和CAAT box。谢先芝等[24]对番茄蛋白酶抑制剂Ⅱ基因的内含子序列进行研究,发现序列具有启动子活性,能够启动下游基因的表达,序列中也存在着类似于真核基因启动子TATA box的结构。小鼠基因第一个内含子中存在一个基因,该内含子能够启动基因的表达,具有类似启动子的功能[25]。本研究通过对基因启动子的研究,发现基因第一个内含子也具有启动子活性,并且在该区域内鉴定到了能够响应光照、昼夜节律、厌氧反应与植物激素的转录调控元件。但具体哪些转录调控元件能够真正介导上游转录因子对基因的转录激活仍需要进一步研究。
3.2 CKI1基因上游转录调控因子的候选基因
转录因子是调控真核生物基因表达的重要因子,典型的转录因子都有DNA结合区,不同的转录因子与靶基因启动子的顺式作用元件特异性结合并相互作用,从而激活或抑制靶基因的表达。酵母单杂交技术是一种体内鉴定DNA与蛋白质相互作用的有效方法。该系统筛选到的蛋白质是在体内相对自然条件下有结合功能的蛋白质,比体外技术获得的结果更能体现真核基因表达调控的真实情况。通过酵母单杂交系统,本研究筛选出到7个在中央细胞中表达的转录因子基因。同时,考虑到酵母单杂交的假阳性问题,今后有必要对这7个候选基因进一步采用EMSA或者ChIP-qPCR验证酵母单杂交的筛选结果,以排除可能的假阳性。前期研究表明,基因功能缺失突变体表现出50%的雌配子体败育表型,由此推测,基因上游转录调控因子的突变体可能也具有雌配子体败育的表型。研究显示,只有[26]和[27]这两个基因的功能缺失突变体没有明显的雌配子发育异常表型,其余5个基因的突变体是否具有雌配子发育异常表型尚不清楚。因此,上述5个基因是今后需要重点关注的候选基因。
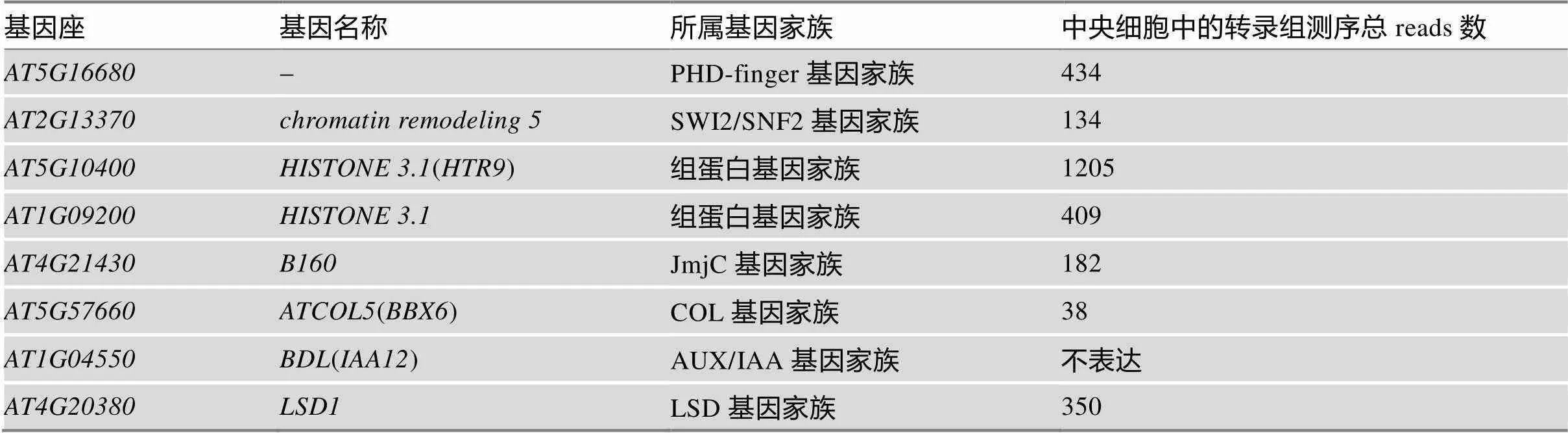
表2 目的基因的功能注释
3.3 转录调控因子基因的高通量筛选
酵母单杂交技术目前是鉴定DNA和蛋白质互作以及筛选转录因子常用的主流技术。利用特定序列的顺式作用元件或者一段启动子序列筛选目的转录因子需要构建cDNA文库,而cDNA文库存在基因冗余重复、基因序列不完整和非特异性的问题,容易产生很多的假阳性克隆和重复克隆,为后期的进一步鉴定和验证增加了大量的工作量。本研究利用酵母单杂交技术对拟南芥雌蕊的cDNA文库进行了筛选,获得了226个阳性克隆,仅获得66条可读序列,其中转录因子基因只有8个,上述阳性克隆存在着大量冗余重复的序列和低质量的序列。为提高酵母单杂交筛选转录因子的效率和特异性,转录调控因子基因的高通量筛选技术日益受到重视。Castrillo等[16]构建了包含1200个拟南芥转录因子的文库,在96孔板上通过传统的酵母配对的方式对脂肪酶基因的上游转录因子进行了高通量的筛选,找到了的上游调控基因。利用同样的方法,Ou等[28]构建了包含1589个拟南芥转录因子的文库,筛选到了8个能够调控基因表达的转录因子。Pruneda-Paz等[15]构建了包含1956个拟南芥转录因子的文库,筛选到了能够结合到基因启动子区域的转录因子。这种转录因子高通量的筛选技术能够直接筛选到与目的DNA互作的转录因子,避免了cDNA文库筛选存在的过高的假阳性问题和冗余重复序列。这些拟南芥转录因子文库在ABRC网站上都可以订购获得,无疑对特定基因上游调控转录因子的筛选大有裨益。但上述转录因子筛选文库使用的是拟南芥各器官混合建库,针对器官或组织特异性的转录因子筛选存在一定的局限性,因而进一步完善针对特定发育时期或器官、组织特异性的转录因子文库具有重要的潜在应用价值。
[1] Kamberov ES, Atkinson MR, Chandran P, Ninfa AJ. Effect of mutations in(), encoding nitrogen regulator II (NRII or NtrB), on the phosphatase activity involved in bacterial nitrogen regulation., 1994, 269(45): 28294–28299.
[2] Kakimoto T. CKI1, a histidine kinase homolog implicated in cytokinin signal transduction., 1996, 274(5289): 982–985.
[3] Hwang I, Sheen J. Two-component circuitry incytokinin signal transduction., 2001, 413(6854): 383–389.
[4] Rabiger DS, Drews GN. MYB64 and MYB119 are required for cellularization and differentiation during female gametogenesis in., 2013, 9(9): e1003783.
[5] Yuan L, Liu ZN, Song XY, Johnson C, Yu XL, Sundaresan V. The CKI1 histidine kinase specifies the female gametic precursor of the endosperm., 2016, 37(1): 34–46.
[6] Deng Y, Dong H, Mu J, Ren B, Zheng B, Ji Z, Yang WC, Liang Y, Zuo J.histidine kinase CKI1 acts upstream of histidine phosphotransfer proteins to regulate female gametophyte development and vegetative growth., 2010, 22(4): 1232–1248.
[7] Hejátko J. Pernisová M, Eneva T, Palme K, Brzobohatý B. The putative sensor histidine kinase CKI1 is involved in female gametophyte development in., 2003, 269(4): 443–453.
[8] Hejátko J, Ryu H, Kim GT, Dobesová R, Choi S, Choi SM, Soucek P, Horák J, Pekárová B, Palme K, Brzobohaty B, Hwang I. The histidine kinases CYTOKININ- INDEPENDENT1 and ARABIDOPSIS HISTIDINE KINASE2 and 3 regulate vascular tissue development inshoots.,2009, 21(7): 2008– 2021.
[9] Pischke MS, Jones LG, Otsuga D, Fernandez DE, Drews GN, Sussman MR. Anhistidine kinase is essential for megagametogenesis., 2002, 99(24): 15800–15805.
[10] Ito Y, Kurata N. Identification and characterization of cytokinin-signalling gene families in rice., 2006, 382, 57–65.
[11] Liu ZN, Yuan L, Song XY, Yu XL, Sundaresan V. AHP2, AHP3, and AHP5 act downstream of CKI1 infemale gametophyte development., 2017, 68(13): 3365–3373.
[12] Liu ZN, Yuan L, Sundaresan V, Yu X. Arabidopsis CKI1 mediated two-component signaling in the specification of female gametophyte., 2018, 13(10): e1469360.
[13] Dobisova T, Hrdinova V, Cuesta C, Michlickova S, Urbankova I, Hejatkova R, Zadnikova P, Pernisova M, Benkova E, Hejatko J. Light controls cytokinin signalingtranscriptional regulation of constitutively active sensor histidine kinase CKI1., 2017, 174(1): 387–404.
[14] Li JJ, Herskowitz I. Isolation of, a component of the yeast origin recognition complex by a one-hybrid system., 1993, 262(5141): 1870–1874.
[15] Pruneda-Paz JL, Breton G, Nagel DH, Kang SE, Bonaldi K, Doherty CJ, Ravelo S, Galli M, Ecker, JR, Kay SA. A genome-scale resource for the functional characterization oftranscription factors., 2014, 8(2): 622–632.
[16] Castrillo G, Turck F, Leveugle M, Lecharny A, Carbonero P, Coupland G, Paz-Ares J, Oñate-Sánchez L. Speedingregulation discovery by phylogenomic analyses coupled with screenings of an arrayed library oftranscription factors., 2011, 6(6): e21524.
[17] Clough SJ, Bent AF. Floral dip: a simplified method for-mediated transformation of., 1998, 16(6): 735–743.
[18] Zhang X, Henriques R, Lin SS, Niu QW, Chua NH. Agrobacterium-mediated transformation ofusing the floral dip method., 2006, 1(2): 641–646.
[19] Smyth DR, Bowman JL, Meyerowitz EM. Early flower development in., 1990, 2(8): 755– 767.
[20] Schmid MW, Schmidt A, Klostermeier UC, Barann M, Rosenstiel P, Grossniklaus U. A powerful method for transcriptional profiling of specific cell types in eukaryotes: laser-assisted microdissection and RNA Sequencing., 2012: 7(1): e29685.
[21] Nolte-’t Hoen EN, Buermans HP, Waasdorp M, Stoorvogel W, Wauben MH,’t Hoen PA. Deep sequencing of RNA from immune cell-derived vesicles uncovers the selective incorporation of small non-coding RNA biotypes with potential regulatory functions., 2012, 40(18): 9272–9285.
[22] Chang KC. Critical regulatory domains in intron 2 of a porcine sarcomeric myosin heavy chain gene., 2000, 21(5): 451–461.
[23] Salgueiro S, Pignocchi C, Parry MA. Intron-mediatedexpression in tritordeum and wheat resulting from particle bombardment., 2000, 42(4): 615– 622.
[24] Xie XZ, Wu NH. Isolation of protease inhibitor II and functional analysis of its intron in tomato., 2001, 46(11): 934–938.谢先芝, 吴乃虎. 番茄蛋白酶抑制剂Ⅱ基因的分离及其内含子功能. 科学通报, 2001, 46(11): 934–938.
[25] Wang Y, Joh K, Masuko S, Yatsuki H, Soejima H, Nabetani A, Beechey CV, Okinami S, Mukai T. The mousegene is imprinted in the adult brain, presumably due to transcriptional interference by the antisense- orientedgene.,2004, 24(1): 270–279.
[26] Okada T, Endo M, Singh MB, Bhalla PL. Analysis of the histone H3 gene family inand identification of the male-gamete-specific variant., 2005, 44(4): 557–568.
[27] Wituszyńska W, Szechyńska-hebda M, Sobczak M, Rusaczonek A, Kozłowska-makulska A, Witoń D, Karpiński S. LESION SIMULATING DISEASE 1 and ENHANCED DISEASE SUSCEPTIBILITY 1 differentially regulate UV-C-induced photooxidative stress signalling and programmed cell death in., 2015, 38(2): 315–330.
[28] Ou B, Yin KQ, Liu SN, Yang Y, Gu T, Wing Hui JM, Zhang L, Miao J, Kondou Y, Matsui M, Gu HY, Qu LJ. A high-throughput screening system fortranscription factors and its application to Med25- dependent transcriptional regulation., 2011, 4(3): 546–555.
Screening and identification ofupstream transcription regulators in
Zhenning Liu1,2,3, Li Yuan2,4, Venkatesan Sundaresan2, Xiaolin Yu3
CKI1 (cytokinin independent 1) is a histidine kinase protein involved in the two-component system, which can activate two-component signalingthe downstream histidine phospho-transfer proteins, playing the essential roles in central cell fate determination and development regulation in embryo sacs. However, studies onupstream transcription regulators are still limited. In the present study, promoter activities with varying fragments were investigated, andupstream transcription regulators were screened and identified by the yeast-one hybrid technique. Results indicatedfragments located in the intron region showed promoter activities in embryo sacs, which is consistent withfull-length promoters. Then three tandem repeats offragments were used to construct the bait expression vector, andpistils were collected for cDNA library construction. Totally, 226 positive clones were screened by the yeast-one hybrid technique, 66 readable sequences were retrieved after removing sequences with low quality and redundant repeats, among which eight proteins could act as DNA-binding proteins. These results provided some important clues to study the molecular function of CKI1 in the transcription regulation network.
; transcription regulation; yeast-one hybrid;
2018-11-21;
2019-02-28
国家自然科学基金项目(编号:31700272,31872110,31460521),山东省自然科学基金项目(编号:ZR2017PC012)和浙江省农业新品种选育重大科技专项重点项目子课题(编号:2016C02051-6-1)资助[Supported by the National Natural Science Foundation of China (Nos. 31700272, 31460521, 31872110), the Natural Science Foundation of Shandong Province (No. ZR2017PC012) and the Breeding Project of the Sci-tech Foundation of Zhejiang Province (No. 2016C02051-6-1)]
刘振宁,博士,讲师,研究方向:植物生殖发育。E-mail: liuzhenning@lyu.edu.cn
余小林,博士,教授,博士生导师,研究方向:植物功能基因组学。E-mail: xlyu@zju.edu.cn
10.16288/j.yczz.18-314
2019/4/2 17:11:57
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20190402.1711.002.html
(责任编委: 张宪省)
