组蛋白去乙酰化酶抑制剂丙戊酸肝细胞毒性相关作用机制研究
2019-05-21那存乌力吉达嘎呼
那存乌力吉,达嘎呼
0 引言
丙戊酸(Valproic acid,VPA)是一种支链短链脂肪酸,是治疗癫痫和双相情感障碍的常用药物之一[1]。在治疗癫痫中,VPA是一种有效的广谱抗惊厥药,用于治疗原发性全身强直-阵挛性、无症状和部分性癫痫[2]。VPA具有严重的不良反应,如肝毒性[3]、骨髓抑制[4]、骨细胞产生减少和骨软化。其中肝毒性主要表现为肝细胞脂肪变性及细胞凋亡[5],VPA肝毒性的机制尚不清楚[6]。此外,VPA是一类新型组蛋白去乙酰化酶(Histone deacetylases,HDACs)抑制剂,促进组蛋白乙酰化,使染色质采取松散的结构,促进各种转录因子的结合,影响基因的转录与表达。研究认为,VPA的HDAC抑制活性与多种癌症相关基因的表达增加有关,可抑制细胞生长和增加细胞凋亡[6]。相关研究发现,VPA处理肝细胞后,AKT1基因表达改变明显[7],而且AKT1的下调与线粒体异常有关。线粒体异常是引起细胞凋亡的重要机制之一。本研究探讨VPA是否通过影响PI3K/AKT/mTOR通路来影响线粒体功能,从而引起细胞凋亡,并使用HDAC抑制剂曲古抑菌素A(Trichostatin A,TSA)研究这种效应是否与其HDAC抑制剂活性相关,为了解和防治VPA肝毒性提供理论依据。
1 材料
1.1 细胞株 HepG2人肝癌细胞系,购于上海中科院,37 ℃、5%CO2培养箱中常规培养,培养液为含10%胎牛血清的RPMI-1640完全培养基。
1.2 实验试剂 胎牛血清,RPMI-1640(GIBICO,美国),MTS试剂盒(Promega,美国),DMSO,TSA(Sigma,美国),抗p-PI3K,PI3K,p-AKT,AKT,p-mTOR,mTOR,LC3B,p62/SQSTM1,pre-caspase-3,cleaved-caspase-3,Bcl-2,Bax,GAPDH抗体(Cell signaling technology,美国),抗兔,抗小鼠,抗山羊HRP二抗(中杉金桥,中国),ECL试剂盒(Thermo Fisher,美国),JC-1试剂盒(碧云天,中国),Annexin V-FITC/PI细胞凋亡双染试剂盒(Becton,Dickinson and company,美国)。
2 方法
2.1 处理与分组 取对数生长期HepG2细胞,种植于细胞培养板。VPA浓度为0、100、500 μmol/L,1、5、10 mmol/L;TSA浓度为0、50、100、500 nmol/L,1、5 μmol/L。处理时间为24 h。
2.2 细胞活性检测 用MTS试剂盒检测细胞活性。取对数生长期HepG2细胞种植于96孔板,种植密度是4×104个细胞/孔,细胞生长24 h后加药处理。处理后弃去原培养液,加入新鲜完全培养液100 μl/孔,加入试剂20 μl/孔,37 ℃、5%CO2培养箱中孵育2 h。使用分光光度仪读取490 nm处吸光度值。MTS与活细胞线粒体中的多种脱氢酶反应,形成甲瓒产物,490 nm吸光度值大小与活细胞数呈正相关。
2.3 细胞凋亡检测 用Annexin V-FITC/PI细胞凋亡双染试剂盒检测细胞凋亡情况。细胞加药处理后,用PBS清洗1次,然后用0.025%胰酶,37 ℃ 消化5 min,将细胞转移至离心管中,1 000 g离心5 min,分别加入Annexin V-FITC和PI染色,30 min内使用流式细胞仪检测。绿色荧光素FITC标记的Annexin V可以与细胞膜组分磷脂酰丝氨酸结合,指示死亡细胞。PI是核酸染料,不能通过完整细胞膜,能通过凋亡晚期细胞或死细胞膜,对细胞核进行染色。活细胞:Annexin V和PI都不能染色;早期凋亡细胞:Annexin V可以染色,PI不能染色;晚期凋亡或死细胞:Annexin V和PI都能染色。
2.4 线粒体膜电位检测 细胞经处理后,吸除培养液,根据具体实验如有必要可以用PBS或其他适当溶液洗涤细胞1次,加入1 ml细胞培养液。加入1 ml JC-1染色工作液,充分混匀。细胞培养箱中37 ℃孵育20 min。在孵育期间,按照每1 ml JC-1染色缓冲液(5×)加入4 ml蒸馏水的比例,配制适量的JC-1染色缓冲液(1×),并放置于冰浴中。37 ℃孵育结束后,吸除上清,用JC-1染色缓冲液(1×)洗涤2次。
加入2 ml细胞培养液,用荧光显微镜观察,拍摄。检测JC-1单体时可以把激发光设置为490 nm,发射光设置为530 nm;检测JC-1聚合物时,把激发光设置为525 nm,发射光设置为590 nm。JC-1是一种广泛用于检测线粒体膜电位(Mitochondrial membrane potential)△Ψm的理想荧光探针。当线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,产生绿色荧光。通过荧光颜色的转变来检测线粒体膜电位的变化,用红绿荧光的相对比例来衡量线粒体去极化的比例。
2.5 免疫印迹检测 细胞加药处理后,弃去培养液,用PBS清洗一遍,用含有NaVO4、NaF cocktail蛋白酶抑制剂、PMSF的裂解液收集细胞。将收集样本放于4 ℃裂解30 min,4 ℃、10 000 r/min离心10 min,取上清。用BCA蛋白检测试剂盒检测样本蛋白浓度,取一定量总蛋白样本,加入Loading buffer,95 ℃变性5 min。用SDS-PAGE胶电泳分离蛋白,转膜,5%脱脂奶粉封闭1 h。1抗4 ℃孵育过夜,次日,PBS-T清洗3次,二抗室温孵育1 h,PBS-T清洗3次,ECL显影剂显影,凝胶成像仪记录成像。
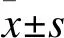
3 结果
3.1 细胞活性检测 应用MTS法检测VPA、TSA处理24 h后细胞活性,用酶标仪检测490 nm处吸光度值,吸光度值与细胞活性呈正比。结果显示,5、10 mmol/L VPA处理24 h,细胞活性明显低于空白组,差异有统计学意义(P<0.05),5 μmol/L TSA处理24 h,细胞活性明显低于空白组,差异有统计学意义(P<0.05)。因此,后续实验选用VPA的浓度为10 mmol/L,TSA的浓度为5 μmol/L。结果见图1。
3.2 细胞凋亡检测 用Annexin V-FITC/PI细胞凋亡双染试剂盒染色,检测VPA、TSA处理24 h后细胞凋亡,用流式细胞仪检测。结果显示,10 mmol/L VPA处理24 h或5 μmol/L TSA处理24 h,细胞凋亡率显著高于空白组,VPA引起细胞凋亡率高于TSA,差异有统计学意义(P<0.05)。结果见图2、图3。
3.3 线粒体膜电位检测 用JC-1染色,检测VPA、TSA处理24 h后细胞线粒体膜电位情况,用荧光显微镜检测。结果显示,10 mmol/L VPA处理24 h或5 μmol/L TSA处理24 h,细胞线粒体膜电位明显低于空白组,VPA引起线粒体膜电位降低更明显(P<0.05)。见图4。
3.4 PI3K/AKT/mTOR通路活性 用免疫印迹的方法检测VPA、TSA处理24 h后细胞PI3K/AKT/mTOR通路活性。结果显示,10 mmol/L VPA处理24 h或5 μmol/L TSA处理24 h,细胞PI3K/AKT/mTOR通路活性降低明显,VPA的抑制作用更明显,差异有统计学意义(P<0.05)。见图5。
3.5 凋亡通路检测 用免疫印迹的方法检测VPA、TSA处理24 h后细胞凋亡通路情况。结果显示,10 mmol/L VPA处理24 h或5 μmol/L TSA处理24 h,细胞Bcl-2活性明显降低,Bax活性明显升高,cleaved-caspase-3比例明显升高,VPA的作用更明显,差异有统计学意义(P<0.05)。见图6。
3.6 自噬检测 应用免疫印迹的方法检测VPA、TSA处理24 h后细胞自噬激活情况。结果显示,10 mmol/L VPA处理24 h或5 μmol/L TSA处理24 h,细胞LC3Ⅱ表达增加,p62表达明显降低,VPA的作用更明显,差异均有统计学意义(P<0.05)。见图7。
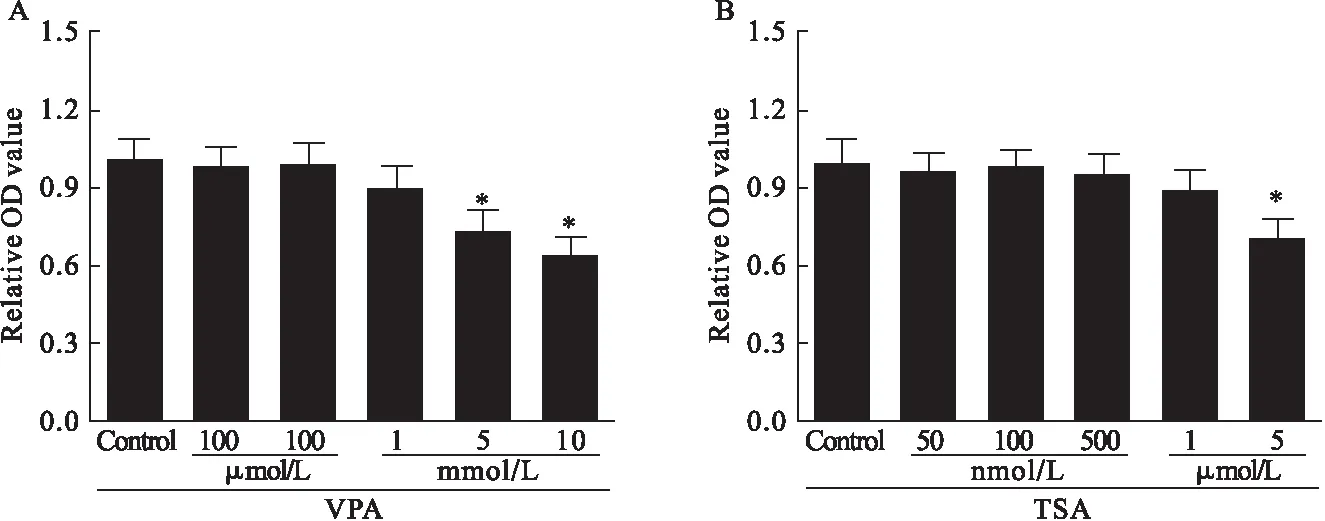
图1 VPA和TSA对细胞活性的影响

图2 VPA和TSA对细胞凋亡的影响
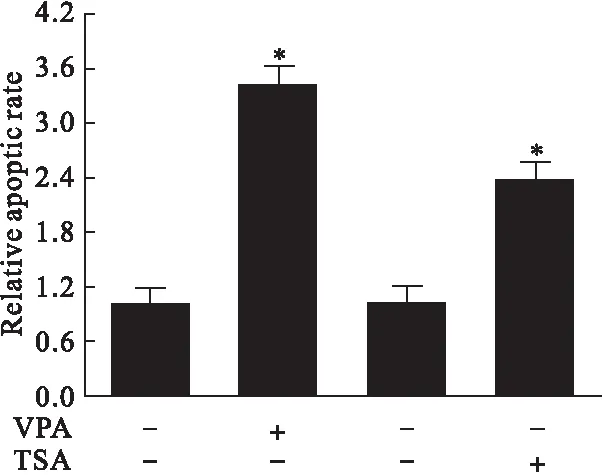
图3 VPA和TSA对细胞凋亡的影响
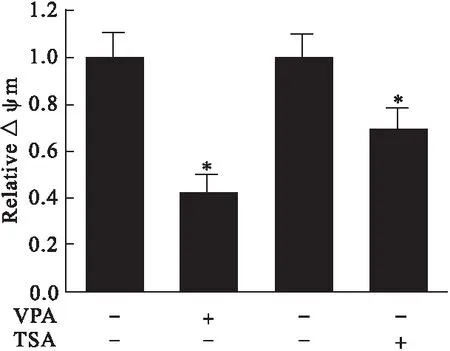
图4 VPA和TSA对线粒体膜电位的影响
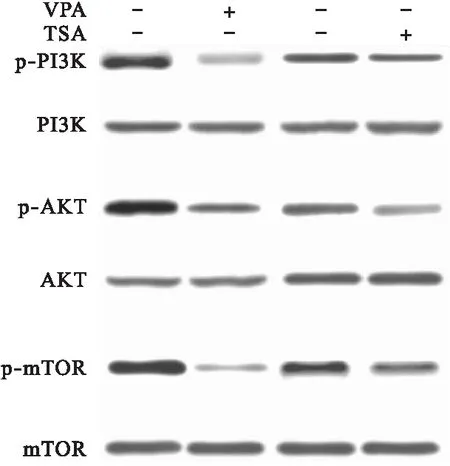
图5 VPA和TSA对细胞PI3K/AKT/mTOR通路活性的影响
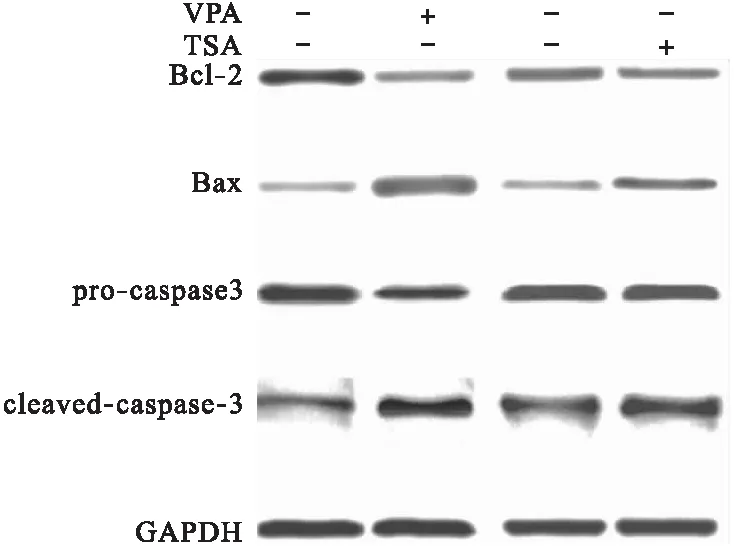
图6 VPA和TSA对细胞凋亡通路的影响

图7 VPA和TSA对细胞自噬的影响
4 讨论
目前,VPA被用于抗癫痫发作活动以及偏头痛和双相性精神障碍的治疗。虽然VPA的耐受良好,但是其肝毒性严重,且机制不明[8]。本研究结果显示,VPA可以引起人肝细胞系HepG2凋亡,与之前的研究结果相似。
有研究发现,VAP处理肝细胞后AKT1基因表达改变明显[7]。PI3K/AKT/mTOR通路是调控细胞生存、增殖的重要通路[9]。因此,本研究进一步检测了VPA处理后PI3K/AKT/mTOR通路的活性。结果显示,VPA可以抑制PI3K/AKT/mTOR通路活性降低。研究提示,VPA引起的AKT改变与线粒体异常有关,线粒体膜通透性障碍和线粒体膜电位消失可以引起线粒体肿胀破裂,而线粒体损伤将触发Bcl-2/Bax介导的线粒体凋亡通路,从而引起细胞死亡[10]。有研究发现,Bax/Bcl-2是细胞凋亡作用强弱的重要指标,caspase-3是下游重要的诱导细胞凋亡的通路。本研究显示,VPA除了降低PI3K/AKT/mTOR通路活性,还能进一步破坏线粒体膜电位,提高Bax/Bcl-2及剪切后的caspase-3比例[11]。结果提示,VPA引起的细胞凋亡与线粒体异常紧密相关。PI3K/AKT/mTOR通路是抑制自噬的重要通路,严重自噬可以导致细胞凋亡。因此,本研究检测了自噬的活化程度,结果显示,10 mmol/L VPA处理24 h或5 μmol/L TSA处理24 h,细胞LC3Ⅱ表达增加,p62表达明显降低,LC3Ⅱ和p62是衡量自噬潮的重要指标,研究结果表明,VPA和TSA可以引起自噬潮的发生。
此外,本研究进一步探讨了VPA引起的PI3K/Akt/mTOR通路活性改变与线粒体异常是否与其HDAC抑制剂活性相关。使用HDAC抑制剂TSA,检测致死剂量TSA对PI3K/Akt/mTOR通路和线粒体膜电位的影响,结果显示,虽然TSA可以抑制PI3K/Akt/mTOR通路活性,改变线粒体膜电位,但是作用效果不大。提示VPA的肝毒性与其HDAC抑制剂活性有部分相关。
综上所述,PI3K/Akt/mTOR通路抑制、线粒体异常引起的凋亡在VPA相关肝毒性中发挥重要作用,而且VPA的肝毒性与其HDAC抑制剂活性具有一定关联。
