布鲁氏菌病检测和防治方法研究进展
2019-05-21刘丽蓉邓洪宽周晓翠
丁 雪,王 岩,刘丽蓉,肖 肖,邓洪宽,周晓翠
(1. 山东理工大学生命科学学院,山东淄博 255000;2.中国动物卫生与流行病学中心,山东青岛 266032)
布鲁氏菌是一类革兰氏阴性的短小杆菌,家畜中猪、羊、牛对其最易感,可引起母畜传染性流产。人类主要通过接触带菌动物或食用病畜及其相关乳制品而造成感染[1],布鲁氏菌病(以下简称布病)是世界范围内严重危害公共卫生安全的人兽共患传染病之一。目前世界上有170 多个国家和地区存在布病流行,每年约有50万的病例,因布病造成的经济损失高达约30亿美元[2-3]。近年来,我国家畜养殖量逐年上升,布病的流行范围逐步扩大,对我国家畜养殖业和人类健康形成较大威胁。本文结合2006—2017年我国《兽医公报》公布的畜间布病疫情数据,对我国布病流行现状和研究进展展开讨论,分析布病流行趋势,以期为及时调整布病防控政策,掌握布病分布特征提供参考。
由于布病危害较大,因此感染早期的快速诊断及鉴定对于降低损失意义重大。目前,临床上的布鲁氏菌检测主要是病原分离,但该方法耗时耗力,且不能做到早期迅速诊断。近几年,随着分子生物学的迅速发展,特别是生物信息学、微生物基因组学的发展,以多重PCR、荧光定量PCR检测方法和基因检测技术为主的布病检测技术,以其操作简单迅速、高效稳定、易于操作等众多优点,成为近些年疫病检测的研究热点[4]。此外,各类疫苗的研制以及临床中西药物的联合使用,更为布病的有效防控开辟了新的途径。
1 流行状况
我国畜间布病基本经历了20世纪50~70年代的流行期、80~90年代的基本控制期以及2000年以后的反弹上升期、2010年以后的流行期4个阶段[5]。目前,我国动物布病发病数量较多的省份有内蒙古、新疆、陕西、黑龙江和山西等,其中以内蒙古最为严重。2011年,内蒙古的动物布病发病数达到117 623例,占全国动物发病总数的94.08%,是我国布病流行最为严重的地区[6],防控形势十分严峻。
从2006—2017年农业部《兽医公报》公布的相关数据(表1)可知,2011年我国畜间病例数达到了高峰,发病动物数量超过10万头(只)。2012年后,无论人间还是畜间,虽然患病省份数量仍维持在较高水平,但畜间病例数呈现下降趋势。
2 布病检测技术
2.1 细菌学检测
细菌学方法常用于实验室检测中,动物布病病原体可从流产胎儿、胎衣、奶样和血液中分离,人布病病原体可从血液、骨髓、尿液中分离。不同种属的布鲁氏菌生长状况存在差异,如牛型布鲁氏菌初分离时生长十分缓慢,且对环境要求较为严苛,需有适量的二氧化碳环境,因此鉴定时间较长,一般2~4周无菌生长,才可判定为阴性。也有报告称,采用BACTEC9240血培养系统以及骨髓培养可提高布鲁氏菌生长速率,缩短检出时间,但总体来说这种病原分离技术费时费力,且检测的准确性不高。
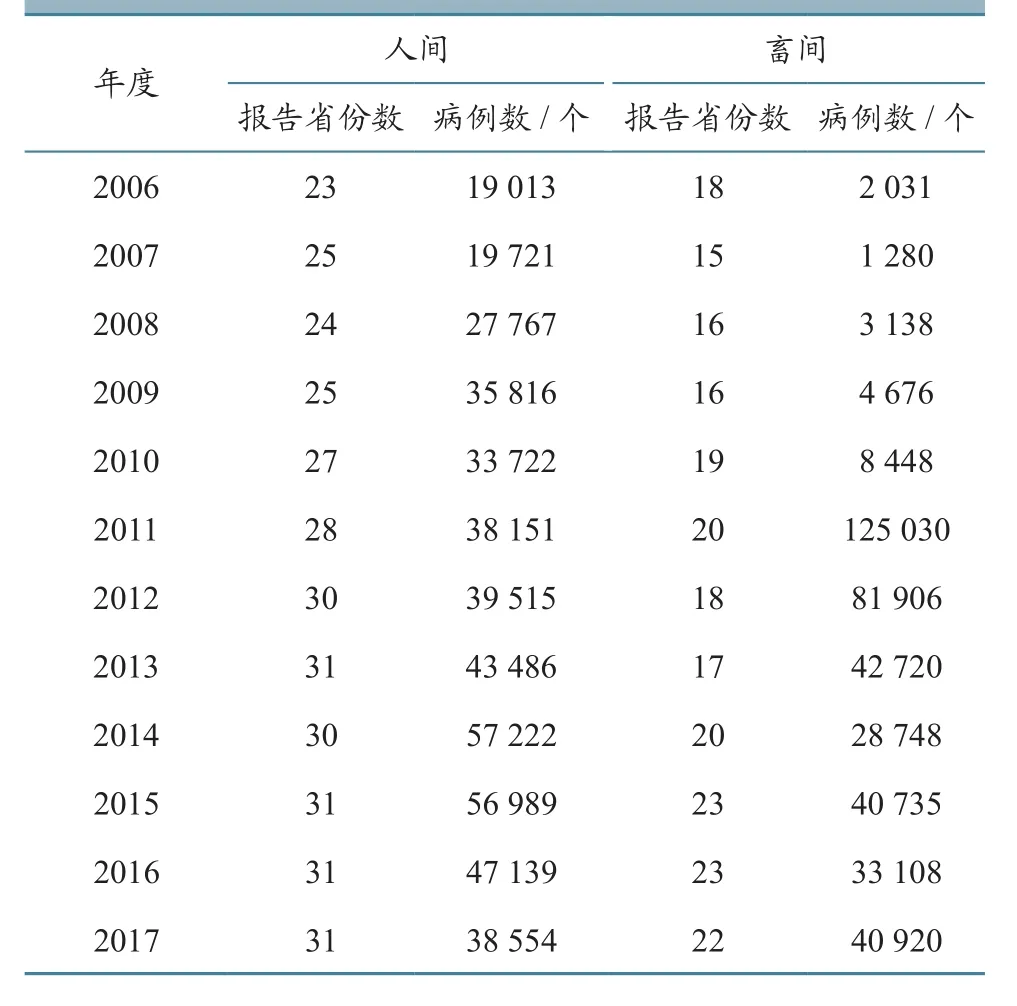
表1 人畜间布病发病情况统计
2.2 免疫学检测
2.2.1 血清凝集试验 常见的血清凝集试验有虎红平板凝集试验(RBT)和试管凝集试验(SAT),但二者的特异性和灵敏度都不高,同时也存在人为判定因素影响,在实际操作中应用不方便,因而国际贸易中不主张使用SAT试验。范伟兴等[7]在布鲁氏菌检测试验中证实,不论RBT还是SAT均有较高的假阳性和假阴性,因此可以先选择RBT进行初筛,若为阳性,再用cELISA进行确诊。杨春萍[8]用RBT和SAT比较布病检测的阳性率、敏感性及特异性,结果表明在布病的临床诊断中,使用RBT、SAT进行检测均存在一定的局限性。总之,在实际应用中,应综合采用多种检测方法对布病进行鉴定,这样才能提高诊断的准确性。
2.2.2 酶联免疫吸附试验(ELISA) ELISA方法是国际贸易中指定的诊断方法,其特点是快速、特异、灵敏,因而不断得到推广应用。该方法的灵敏性比凝集试验高,特异性也很好,既可检测IgG和IgM,又可检测IgA类抗体[9]。1976年Carlsson第一次使用间接ELISA法检测人布病。随着生物技术的高速发展,现如今牛、羊和猪等多种动物的布病iELISA方法也已经被建立[4]。该方法是利用抗原抗体之间的专一性,对抗体进行检测,可分为:双抗夹心法,多用于大分子抗原检测;间接法,常用于抗体检测;竞争法,常用于小分子抗原检测。Burriel等[10]对竞争法和间接法进行了比较分析,证明cELISA在实际操作中,能区分疫苗免疫抗体与病株感染抗体,且特异性、灵敏度都较高。我国学者杜锐等[11]对3种抗原进行筛选和优化,确定了其中之一的超声波破碎抗原为最佳的抗原,第一次建立了检测鹿布鲁氏菌抗体的间接ELISA;2003年张喜悦等[12]建立的牛布鲁氏菌ELISA方法,将热酚法提取的脂多糖(LPS)作为抗原,且试验证实效果良好,可特异性的检测布鲁氏菌;2009年赵伟栋等[13]用大肠杆菌表达的牛布鲁氏菌重组BP26蛋白作为检测抗原,包被抗原和待检血清的最佳条件通过棋盘滴定法来测定,建立了效果较好的间接ELISA方法,将该方法与普通常见的试管凝集试验进行结果比较,发现符合率为93.3%;2010年宫晓炜等[14]也建立了间接ELISA方法,在其研究中将原核表达并纯化的布鲁氏菌周质蛋白BP26作为包被抗原,用来检测牛血清的阳性率,发现符合率可达到93.0%;2011年高宇哲等[15]以大肠杆菌重组表达的VirB12蛋白作为检测抗原(该蛋白可作为检测布鲁氏菌的一种特异标识),这为布病检测提供了新思路;2015年王志明[16]将Brucella-5C10作为竞争抗体,利用牛种布鲁氏菌A99作为抗原包被酶标板,HRP标记的羊抗鼠IgG为第二抗体,组建了cELISA试剂盒,该试剂盒具有良好的特异性和灵敏度,能够更好地排除由某些菌造成的假阳性现象。近些年来,ELISA方法因其特异性好等优点已被广泛应用。陈昌海等[17]利用酶联免疫仪进行样品判定,判定时样品的需要量仅2 μL,整个反应仅需1.5 h,这样极大程度地避免了人为因素干扰,从而使布鲁氏菌检测更加快速、准确。
2.2.3 补体结合试验(CFT)、免疫荧光试验和胶体金免疫层析技术 CFT特异性强,但操作较其他方法复杂,且阳性出现时间较晚,在人医上仅用于诊断比较困难的人群。由于条件要求较苛刻,在普通兽医站难以进行,所以实际应用并不广泛,因此与ELISA相比,大多数研究人员多采用后者。早在1986年,魏涛等[18]将免疫荧光抗体试验成功应用于布鲁氏菌抗原检测。布鲁氏菌结合荧光抗体后,在荧光显微镜下呈现明亮的特异性细菌荧光,具有属的特异性,但不能区别牛、羊、猪等生物物种。免疫磁性分离技术(IMBS)是将免疫学反应与磁珠特有的磁响应性相结合的一种新兴免疫学技术[19],近年来在国内外也成为一个研究热点。2016年苗玉强[20]研究了布鲁氏菌免疫磁珠及免疫荧光检测方法,阐明了免疫磁性分离技术可以高效收集、浓缩大量样品中的少量病原微生物,而间接免疫荧光法可以短时间内快速筛查布鲁氏菌,如果将这两种方法结合起来,可以更有效地检测样品。但更多有关免疫荧光检测技术,国内相关报道较少,需要进一步研究。胶体金免疫层析技术是一类新型标记技术,具有操作简单、所需样品量少、节省物力财力的优点,更适合布病检测,近年来也得到了较为广泛的发展。朱明东等[21]研究发现该方法快速检测布病的最佳血清用量为10 μL,检测敏感性和特异性分别达到93.6%和94.9%,非常适合于布病的诊断、流行病学调查及现场应用,是一种检测布病的新手段。
2.3 分子生物学检测
2.3.1 PCR技术 PCR技术特异性强、灵敏度高、不破坏样本、操作简便,在布鲁氏菌检测、菌种鉴别等方面得到了越来越广泛地应用[22-23]。2002年Navarro等[24]利用3个引物的PCR方法检测人布鲁氏菌DNA,并对其敏感性进行比较,发现3个引物分别可扩增编码流产布鲁氏菌31 kDa基因、流产布鲁氏菌16SrRNA序列的基因和编码外膜蛋白的基因,但3个引物在检测人布鲁氏菌灵敏度上存在差异,检测范围在8 fg~20 pg。2003年王胜昌等[25]采用了PCR技术,利用内外引物PCR及套式PCR反应方法,提取、纯化了布鲁氏菌R型及S型抗原DNA,发现这两种类型均出现了预期的扩增带,与其相比较的其他菌株没有扩增带;并且这种方法灵敏性强,经过扩增后甚至可检测到1 pg的布鲁氏菌DNA。2010年孟茹等[26]通过筛选布鲁氏菌omp10、omp19、omp17、omp25、omp31和结核杆菌cfp10基因的最佳引物组合,建立二重实时定量PCR鉴别方法,利用所建立的方法及常规PCR,对24份结核痰样、11份布鲁氏菌基因粗提物及30份模拟奶样进行检测,发现与预期扩增序列同源性为100%。2012年王素华等[27]对牛布鲁氏菌外膜蛋白OMP31的基因序列设计引物,对样品进行PCR扩增后测序,发现符合率为99.7%;并且这种方法灵敏性高,最低可检测出0.9 pg/μL的DNA含量。2018年杜琳等[28]利用多重PCR法,对布鲁氏菌的保守抗原omp31、omp25进行检测,扩增出了相应的特异性片段,符合预期结果,证明通过该方法可以快速检测出所用材料中的布鲁氏菌,进而大大减少实验时间。近年来,不同种型布鲁氏菌PCR检测鉴别方法越来越多,常见的有普通PCR、多重PCR、不同种型及生物型荧光定量PCR等,其中多重PCR和荧光定量PCR在布鲁氏菌检测中应用广泛,满足了检验检疫、流行病学调查、诊断等多方面的需求。随着时代的发展,PCR技术又实现了与芯片技术、微流体技术等新技术的融合[29],可同时进行大量样品中多种病原的快速检测和分析,大大提高了检测效率,将更有助于布鲁氏菌的快速检测和分型[30]。
2.3.2 基因检测技术 郭秀兰等[31]在20世纪80年代利用DNA分子的热变性法及浓相分子杂交法,首次建立了布鲁氏菌基因检测技术,测定了布鲁氏菌18个生物型的DNA,阐明了细菌DNA基因检测技术是一种十分准确可靠的布鲁氏菌生物检测方法。随着分子生物学的发展,通过测定微生物基因的GC含量、Tm值,以及利用核酸杂交技术,可以很容易地分辨各种微生物类型,使得该方法也成为检测布鲁氏菌的一种常见、可靠的方法。
2.3.3 核酸探针与分子斑点杂交技术 该方法是通过PCR扩增差异片段,然后利用布鲁氏菌疫苗株与其他菌株基因组DNA差异序列设计探针,再将其纯化、变性后建立斑点杂交。2011年张太翔等[32]根据BM28保守序列设计引物和探针,建立了一种快速、高效鉴定牛布鲁氏菌的TaqMan实时荧光定量PCR方法。该方法不仅灵敏、特异性强而且重复性好,因此对于临床中的布鲁氏菌快速准确检测具有较大的应用价值和前景。目前,关于核酸探针及分子斑点杂交技术的相关研究报道较少,但该方法的建立也为布鲁氏菌的进一步检测开辟了一条新途径。
3 布病防治研究进展
3.1 疫苗的推广使用
由于布病的诊断治疗难度高,加之许多患者对该病不重视、治疗不配合,使得布病治疗的难度越来越大,所以现如今越来越多的研究倾向于布病疫苗的研制,这样可以提高易感人群或牲畜免疫力,从而大大降低布病的发生概率。减毒活疫苗和突变株疫苗是现阶段布病防治中常用的疫苗种类,但突变株疫苗的稳定性和安全性不高,仍需进一步研究[33]。近年来,新型基因工程疫苗发展迅速。其利用基因工程技术对现有的优质疫苗进行改造得到工程菌株、重组质粒。此外,还有DNA疫苗、蛋白质疫苗、标记疫苗等,但蛋白质疫苗自身在机体内无法复制,且生产工艺复杂、成本高,故尚未普及。李臻等[34]对布鲁氏菌M5-90疫苗株VirB2基因缺失株的构建及鉴定研究,发现基因缺失株属于标记疫苗类;此外2011年高宇哲等[15]采用基因组同源重组方法,构建了VirB12基因缺失的M5-90疫苗株(M5-90-VirB12),表明了缺失株M5-90-VirB12保持了M5-90疫苗的免疫保护效力。总体来说疫苗效果好,安全性较高,是防治布病的一种良好手段,但仍具有一定局限性,需要每年都进行接种从而保持记忆力。
3.2 药物治疗
目前,对布病最佳的药物治疗方法尚未达成共识,主要通过选取合理的抗生素来有效降低布病的复发率。临床应用表明,联合应用氨基糖苷类和多西环素,对急性或慢性布病的治疗,失败率和复发率都处于较低水平[35]。此外中药治疗疗效明确,运用灵活、药源广,对于慢性布病具有较大的作用。而中西医结合治疗可以更快地减轻布病患者的症状,缩短治疗时间,最重要的是可以减轻长期应用抗生素带来的副作用,对于布病的治疗具有很大作用。
4 展望
对于布病检测,虽然ELISA法和分子生物学法具有较大的优势,其特异性引物多、结果良好、符合率较高,但目前仍处于实验室研究层面,对于基层布病的快速检测仍存在较大困难,且暂无统一的标准。近年来,虽然疫苗研发及检测方法得到了进步,但仍需研发安全性高、副作用低、高效方便且能够推广应用的检测手段。对于布病的预防,加快新型疫苗制备,加强免疫效果评价,针对薄弱环节,加快技术创新,寻求更加方便、高效的技术手段尤为重要。
除此之外,布病虽近几年维持在一个相对较稳定水平,但总体来看,每年的发病数量仍然较高,未呈现显著性下降趋势。因此,布病防治任重道远,需要强化政府领导和各部门职责,强化与卫生部门信息交流,加强布病防治宣传教育,加强医疗工作者及普通民众对布病的认识和重视,加强动物产地检疫、屠宰检疫和流通监管,通过各方面、各途径的努力,有效控制我国布病流行。
