新城疫病毒株F48E9对CT26小鼠结肠癌的溶瘤治疗作用
2019-05-21钟建平王国松洪俊平陈毅歆
钟建平,李 睿,王国松,洪俊平,付 饶,陈毅歆,
根据国家癌症中心发布的《2017中国癌症报告》显示:与2012年相比,我国2013年癌症新发人数继续上升,累计病例数从385万增加到398万,增幅3%,占当年世界新发病例的近25%。其中,结肠癌增长趋势明显,在男性肿瘤中其发病率排第5位,在女性肿瘤中排第3位,综合死亡率排第5位,位于肺癌、胃癌、肝癌、食管癌之后。目前在临床上结肠癌以手术切除治疗为主,放疗化疗以及免疫治疗为辅[1]。手术治疗之后,结肠癌比较容易转移和复发,是结肠癌引起患者死亡的主要原因[2]。
免疫治疗是最有前景的肿瘤治疗手段之一,曾入选《科学》杂志“2013 十大科学突破”榜首[3]。基于病毒的溶瘤治疗是免疫治疗的重要途径之一,包括人类单纯疱疹病毒(HSV)、新城疫病毒(NDV)、腺病毒(Adenovirus)、柯萨奇病毒(Coxsackie virus)、麻疹病毒(measles virus,MV)、呼吸道肠道病毒(reovirus)、水疱性口炎病毒(VSV)等在内的病毒都已被证明具有溶瘤作用[4-5],可通过直接感染裂解肿瘤细胞、激活机体免疫系统等多种途径发挥肿瘤的抑制或清除作用,部分病毒株已在临床治疗中显示出良好的治疗效果,其中1株改造过的HSV溶瘤病毒已经在美国正式上市[6-8]。
NDV是一种单链负义RNA病毒,属于副粘病毒科,主要感染禽类,偶见患者感染事件,引起结膜炎[9]和温和的流感症状等[10]。从20世纪60年代至今,已有73-T、MTH-68、PV701、HUJ、La Sota等多个NDV减毒株或弱毒株开展了一期和二期药物临床试验[6, 11-13],但都没有进入三期临床试验阶段,提示现有的NDV弱毒株或减毒株的治疗效果可能不够好,因此,有必要开发疗效更好的NDV溶瘤病毒株。胡立华[14]等比较了NDV强毒株F48E9和NDV弱毒株LaSota对大肠癌细胞LS1747的体外杀伤效果,提示F48E9可能具备溶瘤治疗潜能,但该研究未在动物水平上评估F48E9溶瘤抑制效果和治疗安全性。因此,本研究拟以CT26小鼠结肠癌为模型,深入研究NDV强毒株F48E9对CT26肿瘤细胞和CT26小鼠皮下移植瘤的体内外抑制作用,并通过静脉注射小鼠评价F48E9的体内治疗安全性,从而确定NDV强毒株F48E9是否可作为候选病毒株进行后续的反向遗传学改造,为最终建立高效安全的NDV溶瘤病毒株奠定基础。
1 材料与方法
1.1病毒、细胞及实验动物 新城疫病毒株F48E9为中国农业大学王晓佳教授馈赠;结肠癌CT26细胞购自ATCC(#ATCC CRL-2638);BALB/c小鼠(6-8周龄)购自上海斯莱克实验动物有限公司(#003)。
1.2实验试剂与耗材 细胞活力检测CCK-8试剂盒购自碧云天公司(#C0040);细胞增殖多克隆抗体Ki-67购自NOVUS公司(# NB110-89717);即用型免疫组化试剂盒UltraSenitive TM SP购自福州迈新公司(#KIT9720),内含内源性氧化物阻断试剂、正常动物免疫血清(羊)、生物素标记的第二抗体及链霉素抗生物素蛋白-过氧化物酶;DAB显色试剂盒购自福州迈新公司(#DAB-0031);苏木精染色液购自SIGMA-ALDRICH公司(# HHS16);醇溶伊红染色液购自SIGMA-ALDRICH公司(#HT110116)。
1.3 方 法
1.3.1F48E9的培养、滴定 培养Vero细胞,当细胞处于对数生长期并且状态良好时,消化细胞,使用细胞计数仪计数,并将3×106个Vero细胞铺在10 cm细胞培养板中,放置在37 ℃,5% CO2的恒温培养箱中培养。培养72 h等到细胞完全覆盖细胞板时取其中一板进行消化计数并记录。使用无血清DMEM培养基稀释F48E9病毒液,再按照MOI=0.1(病毒数/细胞数,MOI)感染Vero细胞,放置在温箱中培养。培养过程中每15 min摇晃1次,孵育75 min使病毒充分吸附在细胞上,之后弃去残余的病毒液并加入10 mL 含2%血清的维持液,放入培养箱中培养。培养48 h后收取细胞,反复冻融裂解细胞3次,然后使用3 000 r/min离心细胞裂解物15 min,除去细胞碎片,分装上清液至病毒冻存管中并进行空斑形成实验滴定病毒的滴度,空斑实验方法参见文献[15],保存在-80 ℃超低温冰箱中。
对生产的病毒进行免疫荧光实验,进一步证明F48E9感染细胞的活性。消化Vero细胞,然后铺板至24孔板中,每孔2×105个细胞。细胞贴壁生长,覆盖80%~90%培养孔时,进行免疫荧光实验。一抗为本实验制备的F48E9株NP蛋白小鼠单克隆抗体4E7,二抗为TRITC标记的羊抗鼠荧光二抗,DAPI染细胞核[16]。使用荧光显微镜进行拍照并分析。
1.3.2F48E9对CT26细胞的体外感染抑制实验 胰酶消化CT26细胞,按每孔0.1 mL浓度为2×105个细胞铺至96孔板中;稀释F48E9病毒,分别按MOI=10、1、0.1、0.01感染铺板12h后的CT26细胞,每个病毒浓度梯度设置3孔重复;在感染72 h后用CCK-8试剂盒检测细胞活力的变化,实验操作方法参照试剂盒说明书。
1.3.3F48E9对CT26细胞小鼠皮下移植肿瘤的体内抑制实验 培养CT26细胞,消化制备成浓度为5×107个/ mL的细胞悬液,接种于16只6周龄BALB/c雌鼠右侧背部皮下,每只小鼠接种0.1 mL细胞,接种数量是5×106个细胞;接种后持续监测皮下肿瘤的生长状态并测量肿瘤的大小,在接种约十天后挑选10只肿瘤大小均一且体积达到80~100 mm3的小鼠进行溶瘤治疗,随机分成两组,每组5只;治疗实验组小鼠经瘤内注射0.1 mL浓度为2×107pfu的F48E9,未治疗对照组小鼠经瘤内注射0.1 mL PBS缓冲液,每隔一天注射1针,共注射5针。每天使用数字游标卡尺测量肿瘤的尺径和观察小鼠的生存情况,肿瘤体积计算公式为 V=ab2/2 (a为长径,b为短径),当小鼠皮下肿瘤任一边长的直径大于18 mm时出于动物伦理考虑判定为死亡,并实施安乐死[17]。
1.3.4F48E9溶瘤治疗CT26皮下瘤的免疫组化分析 按照上述方法构建CT26细胞皮下移植瘤,选取8只肿瘤体积为80~100 mm3的小鼠随机分成两组,每组4只;实验组为瘤内注射0.1 mL浓度为 2×107pfu的F48E9毒株,对照组为瘤内注射0.1 mL PBS缓冲液,每2 d注射1针病毒液,共注射3针;第3针注射2 d后对全部8只小鼠实施安乐死,取出肿瘤组织进行组织化学染色[18]。组织脱蜡复水后,山羊血清封闭1 h;一抗为商品化的兔多抗Ki-67抗体和PBS对照,4度孵育过夜,PBS洗3次;生物素标记的羊抗兔二抗常温孵育10 min,PBS洗3次;过氧化物酶标记的链霉素抗生物素蛋白三抗常温孵育10 min,PBS洗3次;DAB显色液显色30 s,去离子水终止显色反应。使用奥林巴斯正置荧光显微镜(BX51)和cellSens Standard软件进行拍照并分析组织化学染色结果。
1.3.5F48E9的小鼠体内安全性分析 取20只6周龄BALB/c雌鼠随机分成2组,每组10只,称量其体重;随后进行小鼠尾静脉攻毒,实验组的每只小鼠经尾静脉注射1 mL 浓度为2×107pfu的F48E9病毒,对照组为1 mL PBS缓冲液,每2 d进行1次尾静脉注射,共3针;第3针注射2 d后从实验组和对照组中各取4只小鼠实施安乐死,取出主要器官进行苏木素-伊红染色,其余小鼠每4 d称量1次体重并观察小鼠的活动状态。取浸泡后的小鼠主要器官进行包埋脱蜡复水,苏木素染色液染色,脾脏1 min,肾脏2 min,肝脏8 min,肺组织10 min。染色结束后,去离子水清洗三遍。盐酸酒精分化4 s,迅速用去离子水终止分化,去离子水清洗三遍,去离子水返蓝45 min。伊红染色1 min,去离子水终止染色。使用奥林巴斯正置荧光显微镜(BX51)和cellSens Standard软件进行拍照并分析组织化学染色结果。
1.3.6统计与分析 对于两组数据之间的比较,采用t检验进行统计分析;对于两组以上的数据采用方差分析进行显著性评估。当P<0.05时,表示结果具有统计学差异。
2 结 果
2.1F48E9株的培养和滴定 用Vero细胞株培养扩增F48E9,收获的病毒液分装保存于-80 ℃超低温冰箱中,经空斑形成试验法滴定,滴度为2×107pfu/mL。F48E9感染Vero细胞后可以形成肉眼可见的明显病毒空斑(图1A),免疫荧光试验显示用F48E9的NP特异性单抗能在感染F48E9的细胞中检测到荧光信号(图1B),表明病毒株F48E9在Vero细胞中得到特异性扩增。
2.2F48E9对CT26结肠癌细胞的生长抑制作用 F48E9株感染CT26细胞72 h后,使用CCK-8法测定细胞活力水平。结果显示,当MOI=10、1、0.1、0.01时,CT26细胞的活力分别为44.6%、53.8%、84.9%、96.2%,说明新城疫病毒F48E9株能够有效抑制CT26细胞的生长,其抑制效果与病毒的感染剂量成正相关,即感染病毒的MOI越高,对CT26细胞活力的抑制越明显(图2)。
2.3F48E9对CT26细胞小鼠皮下移植瘤的生长抑制作用 在免疫功能正常的BALB/c小鼠皮下接种CT26细胞,等肿瘤生长至体积为80~100 mm3时,实验组小鼠经瘤内注射F48E9病毒液,对照组小鼠注射PBS缓冲液,持续监测肿瘤的生长和小鼠生存情况。结果显示,实验组小鼠的皮下肿瘤始终处于抑制状态,其肿瘤体积远远小于PBS对照组(图3A,B);同时,病毒实验组小鼠的中位生存期为38 d,平均总生存期为38.4 d,PBS对照组的中位生存期为14 d,平均总生存期为15.2 d。上述结果表明,新城疫病毒F48E9能显著抑制CT26结肠癌细胞小鼠皮下移植瘤的生长,显著延长小鼠生存期(图3C)。

图1 新城疫病毒株F48E9的培养和滴定空斑实验(A)和免疫荧光实验(B)Fig.1 Culture and titration of Newcastle disease virus F48E9 strain Plaque assay (A) and immunofluorescence assay (B)
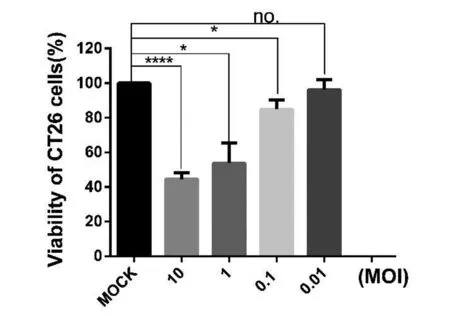
(****P<0.000 1,*P<0.05,no.P>0.05)图2 新城疫病毒株F48E9对CT26结肠癌细胞的生长抑制作用Fig.2 Inhibitory effects of Newcastle disease virus F48E9 strain on the growth of CT26 cells
2.4F48E9可抑制CT26荷瘤小鼠内肿瘤细胞的增殖 为进一步确定F48E9是否通过抑制肿瘤细胞的增殖来抑制小鼠皮下移植瘤的生长,取CT26荷瘤BALB/c小鼠进行瘤内注射实验。实验组瘤内注射3针F48E9病毒液,然后对小鼠实施安乐死,取出肿瘤组织进行免疫组织化学分析,观察细胞增殖标记物Ki-67蛋白的表达情况,对照组注射PBS缓冲液。Ki-67蛋白是一种核定位蛋白,只表达于细胞分裂期,Ki-67的过表达与细胞快速增殖密切相关。免疫组化分析结果显示,注射F48E9的小鼠皮下肿瘤细胞呈Ki-67阳性的细胞数明显少于注射PBS的对照组小鼠(图4),提示新城疫病毒株F48E9可能通过抑制小鼠肿瘤细胞的增殖来抑制小鼠皮下肿瘤的生长。
2.5新城疫病毒F48E9的安全性评估 为评估新城疫病毒F48E9的治疗安全性,取F48E9对健康BALB/c小鼠进行尾静脉注射(n=10)。注射3针病毒后,实验组和对照组各取4只小鼠进行安乐死处理,然后取主要脏器进行苏木素-伊红染色,观察注射F48E9病毒是否会引起小鼠器官损伤,对其余每组各6只小鼠持续监测其体重并观察动物活动状态。结果显示,接种F48E9病毒的小鼠活动正常,其饮食、毛色等没有出现异常情况;体重监测数据表明,病毒接种组与PBS接种组的小鼠体重未见明显差别,都没有明显的下降或波动(图5.A),存活率都是100%(图5.B);苏木素-伊红染色表明,病毒接种组和PBS接种组的染色细胞未见明显差异,组织细胞都呈正常形态(图5.C)。上述结果表明新城疫病毒强毒株F48E9对BALB/c小鼠具有良好的安全性。
3 讨 论
本文研究新城疫病毒强毒株F48E9对小鼠结肠癌CT26肿瘤细胞的体内外生长抑制作用并评价其在小鼠体内的安全性。结果显示强毒株F48E9在体外能显著抑制CT26细胞的生长,在小鼠体内能通过抑制肿瘤细胞的增殖来抑制肿瘤的生长;而且F48E9对BALB/c小鼠的治疗具有良好的安全性,尾静脉注射病毒未对小鼠造成明显的副作用。
新城疫病毒株F48E9作为国内标准强毒株,国内对F48E9的研究主要集中于禽类疫苗以及F48E9 的生物学特性等,罕见其用于溶瘤治疗的研究报道。胡立华[14]等比较了强毒株F48E9和弱毒株LaSota对大肠癌细胞LS1747的体外杀伤效果,但是没有进行体内评价实验,本研究将F48E9应用于CT26细胞BALB/c小鼠移植瘤模型的治疗研究,对F48E9的肿瘤治疗潜能有更全面的认识。国外也有利用NDV治疗CT26小鼠抑制瘤的研究报道,García-Sastre[17]等把由弱毒株NDV-B1株改造F蛋白裂解位点而得到的rNDV-F3aa用于接种在BALB/c小鼠CT26肿瘤的治疗,小鼠中位生存期由PBS对照组的13 d延长到实验组的23 d。本研究使用的F48E9溶瘤株可以将小鼠中位生存期由14 d延长至38 d,显示出更好的溶瘤治疗效果。为进一步全面认识新城疫病毒株F48E9的溶瘤治疗潜能,还需进行更多的后续研究,如应用更多种类的肿瘤细胞系进行体内外治疗潜能评价,应用人源结肠癌裸鼠模型进行肿瘤治疗评价,评估F48E9与PD-1、CTLA-4与CD47等肿瘤抗体联用的治疗效果[19-20]。

小鼠肿瘤体积的增长值(A)及其平均值(B),荷瘤小鼠生存率,P<0.01(C),治疗17 d后的肿瘤大小图像(D)。PBS组为对照组。图3 新城疫病毒株F48E9对CT26结肠癌细胞的小鼠皮下移植瘤的生长抑制作用Fig.3 Inhibitory effects of Newcastle disease virus strain F48E9 on the transplanted tumors in BALB/c mice
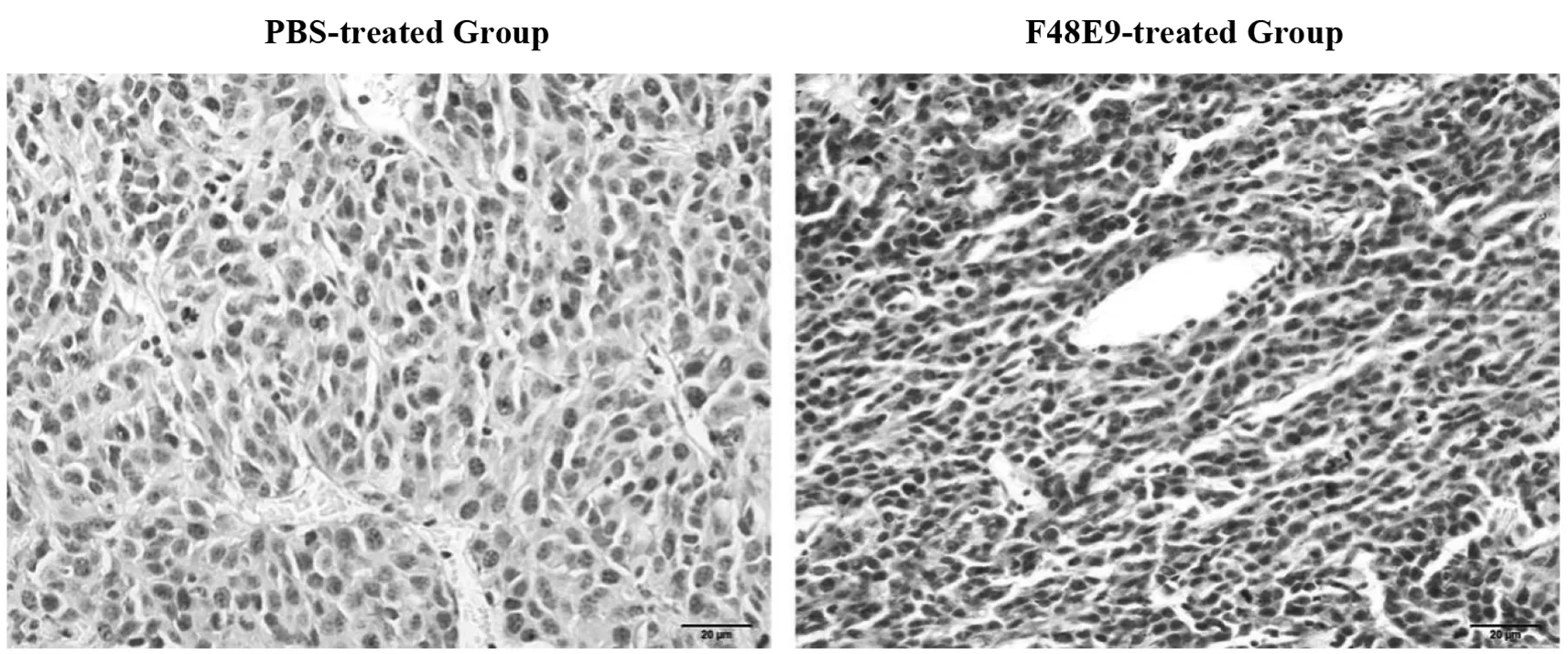
PBS对照组Ki-67蛋白呈阳性的细胞数明显高于F48E9治疗组。标尺=20 μm。图4 新城疫病毒株F48E9抑制CT26肿瘤细胞的增殖Fig.4 F48E9 strain can inhibit the proliferation of CT26 tumor cells from transplanted mice

病毒处理组和PBS对照组的小鼠体重没有明显的差异,都没有下降或者波动的现象(A),实验组和对照组的小鼠存活率均为100%(B),苏木素-伊红染色表明实验组和对照组小鼠的主要器官都没有损伤(C)。标尺=50 μm。图5 新城疫病毒株F48E9的治疗安全性评价Fig.5 Safety evaluation of Newcastle disease virus strain F48E9 in BALB/c mice
在溶瘤治疗研究中,给药治疗起始节点的早与晚对肿瘤治疗效果影响十分明显。本研究中选取的是接种约10 d,肿瘤体积较大(80~100 mm3)的小鼠进行治疗,而其他NDV溶瘤研究中选取的肿瘤体积较小,多为50 mm3以内[17,19]。尽管如此,本研究中F48E9对大肿瘤依然表现出很好治疗作用,说明NDV强毒株F48E9具有高效的溶瘤治疗作用,对中晚期大肿瘤也具备较好的治疗潜能。另外,由于小鼠个体的差异,对同一批次的小鼠接种相同数目的肿瘤细胞,肿瘤的生长速度不尽相同[21]。本研究采取的策略是挑选肿瘤形状规则大小均一的荷瘤小鼠,再随机分组,有效地避免了肿瘤治疗点肿瘤大小差异而带来的实验偏差。
关于NDV的溶瘤治疗机制研究,我们以细胞周期蛋白Ki-67作为细胞增殖标记物[22],通过组织化学染色分析了F48E9病毒处理组肿瘤组织中Ki-67蛋白的表达情况,证明Ki-67蛋白阳性细胞数明显少于PBS对照组,提示F48E9抑制细胞增殖可能是其发挥抗肿瘤的机制之一。有研究还报道了其他新城疫病毒株的溶瘤治疗机制,如Adam Vigil[23]等通过比较新城疫溶瘤毒株对接种于裸鼠和BALB/c小鼠CT26肿瘤的治疗效果,证明新城疫毒株对CT26肿瘤的治疗依赖于T淋巴细胞,又如Hong Sui[24]等使用新城疫毒株NDV-D90治疗接种于裸鼠的人源胃癌细胞,证明NDV-D90可能通过下调VGEF-A和MMP-2来抑制肿瘤血管的生成,进而抑制肿瘤的生长。因此,后续工作还需进一步系统地研究F48E9的溶瘤治疗机制。
新城疫病毒弱毒株作为一种安全的溶瘤制剂或者肿瘤疫苗载体,已得到广泛的认可,而对于新城疫病毒强度株是否适合应用于肿瘤治疗依然存在争议,考虑的主要是强毒株的安全性。本研究通过小鼠尾静脉攻毒实验,证明NDV强毒株F48E9对BALB/c小鼠没有明显的毒副作用,其体内治疗具有良好的安全性。尽管新城疫强毒株在实验小鼠体内表现出了良好的安全性,但是依然存在潜在的扩散风险,需要在后续的研究中构建F48E9株的反向遗传系统进行改造,保留其良好的溶瘤特性的同时降低潜在的风险。
总之,研究初步显示新城疫病毒强毒株F48E9对结肠癌CT26肿瘤具有较好的治疗作用且安全性良好,展示出较好的溶瘤治疗潜能,为充分认识新城疫病毒强毒株的溶瘤治疗性能提供有用的实验数据,为后续的反向遗传改造奠定实验基础。
利益冲突:无
本文引用格式:钟建平, 李睿, 王国松, 等. 新城疫病毒株F48E9对CT26小鼠结肠癌的溶瘤治疗作用[J]. 中国人兽共患病学报, 2019,35(4):292-298,319. DOI: 10.3969/j.issn.1002-2692.2019.00.026
