小麦黄花叶病毒P3蛋白致病功能域的鉴定和分析
2019-05-21亓玉华鲁燕华杨乾坤何雨娟李俊敏陈剑平
张 岩,亓玉华,鲁燕华,杨乾坤,何雨娟,李俊敏,3,陈剑平,3,*
(1.福建农林大学 植物保护学院,福建 福州 350002; 2.浙江省植物有害生物防控国家重点实验室培育基地,农业农村部/浙江省植保生物技术重点实验室,浙江省农业科学院 病毒学与生物技术研究所,浙江 杭州 310021; 3.宁波大学 植物病毒学研究所,浙江 宁波 315211)
我国土传小麦黄花叶病的病原主要为马铃薯Y病毒科(Potyviridae)大麦黄花叶病毒属(Bymovirus)的小麦黄花叶病毒(Wheat yellow mosaic virus,WYMV)[1]。WYMV由土壤中的禾谷多黏菌(Polymyxagraminis)传播,广泛分布于我国安徽、河南、江苏、湖北、陕西、四川和山东等冬小麦区[2]。由于我国的WYMV和国外发现报道的另一种同属的小麦梭条斑花叶病毒(Wheat spindle streak mosaic virus,WSSMV)十分相似,之前在日本、印度和中国被认为是引起小麦黄花叶病害的第二个病毒[3-5]。1994年Sohn等[6]报道了WSSMV法国分离物RNA1 3’端4 kb序列,1995年于嘉林等[7]报道了一个中国河南分离物RNA1 3’末端的891个核苷酸序列,发现与法国分离物仅有69.9%的序列同源性。随后,1998年Namba等[8]报道了日本WYMV基因组全长序列,与法国分离物相比,也仅有69.8%的同源性,从而表明它们是不同的病毒,在我国和日本造成小麦黄花叶病的大麦黄花叶病毒属病毒为WYMV。WYMV在小麦苗期侵染但不显症,通常在2月中下旬当气温升到6 ℃左右时开始出现症状,3月中下旬为发生盛期。气温升至15 ℃以上时出现隐症,20 ℃以上病情会停止发展,但发病对产量造成的损失仍然存在,严重影响我国冬麦区小麦的安全生产[2]。
WYMV由RNA1和RNA2两条正义单链线性RNA组成。RNA1全长7 635个核苷酸,只包含一个编码269 ku的多聚蛋白开放阅读框(open reading frame,ORF),经蛋白酶切割后形成8个成熟的蛋白,分别简称为P3、7K、CI、14K、VPg、NIa、NIb以及CP[9]。此外,在P3中还可以通过+2移码产生PIPO蛋白。RNA1的5’和3’末端非编码区分别为162和258个核苷酸。RNA2全长3 650个核苷酸,整个基因组也仅有一个ORF,编码一个约100 ku的多聚蛋白,通过切割产生2个成熟的非结构蛋白P1和P2。RNA2的5’UTR和3’UTR分别为171和767个核苷酸[2]。
P3氨基酸序列在马铃薯Y病毒科中具有较高保守性,研究表明,P3蛋白在病毒复制[10]、致病性[11-12]、克服宿主抗性[13]、细胞间移动[14-15]等方面均具有重要作用。利用野生型的马铃薯Y病毒属(Potyvirus)的芜菁花叶病毒(Turnip mosaic virus,TuMV)分离物Tu-3和Tu-2R1构建侵染性克隆,实验结果表明,交换分离物的P3部分序列后对两种病毒在甘蓝和萝卜上的症状产生显著影响,表明P3对TuMV在宿主植物上的致病性具有明显影响[16]。同时,研究表明P3 碳端(P3-C)对马铃薯Y病毒属的内质网(endoplasmic reticum,ER)定位和致病性有决定性作用。木瓜环斑病毒(Papaya ringspot virus,PRSV)的P3-C末端具有ER定位信号,对P3的功能有重要作用[17]。虽然P3在马铃薯Y病毒属中的功能已有较多研究,但大麦黄花叶病毒属中的P3是否有类似功能目前还未见报道。本研究对WYMV的P3功能进行了初步研究,为进一步深入理解土传病毒的致病机理提供了新的信息。
1 材料与方法
1.1 材料
植物材料:感染WYMV的小麦样品于本实验室-80 ℃冰箱保存,RT-PCR检测确认带毒情况;野生型本氏烟于本实验室温室种植,将小苗移植于营养土∶珍珠岩∶蛭石(体积比)为3∶1∶1的土壤中,24 ℃,光照16 h/黑暗8 h处理条件下培育。
菌株与载体:大肠埃希菌感受态(DH5α)购于南京百思禾生物科技有限公司;农杆菌感受态(GV3101)购于上海唯地生物技术有限公司;烟草脆裂病毒侵染性克隆载体为本实验室保存菌株。
1.2 试剂
琼脂糖购于翊圣生物公司;KOD FX Neo高保真扩增酶和Ligation version.2购于TOYOBO公司;Thermosensitive Alkaline Phosphatase和Therno Scientific FastDigestPstⅠ购于fermentas公司;RNA提取试剂:Trizol试剂盒购于赛默飞生物公司,氯仿购于上海凌风化学试剂有限公司;cDNA逆转录试剂盒购自天根生物公司;RT-qPCR试剂ChamQTMSYBR®qPCR Master Mix购于诺唯赞生物公司;DNA Marker、RNA Free H2O、TAE缓冲液等购自上海生工生物公司;乙醇等其他试剂均为国药集团化学试剂有限公司产品。
1.3 WYMV P3蛋白相关基因克隆
从NCBI下载WYMV P3基因序列(NCBI登录号AJ131982.1),根据DNAMAN软件预测P3基因的跨膜结构域(http://www.cbs.dtu.dk/services/TMHMM/),分别设计P3和P3碳端(P3-C,位于P3的712-981个核苷酸)、P3-C缺失单个跨膜结构域(P3-C-dN、P3-C-dC)的上下游引物,下划线为PstⅠ识别位点(表1)。
以Trizol法(具体方法参照Invitrogen公司的RNA提取试剂盒说明)提取WYMV侵染的小麦叶片RNA,通过RT-PCR扩增出P3以及P3-C特异基因片段,割胶回收PCR产物。
1.4 TRV载体构建
将含有沉默载体的质粒按照总体积60 μL体系进行单酶切处理,其中含抽纯质粒30 μL,Fast Green Buffer 6 μL,PstⅠ2 μL,其余用ddH2O补足。
其中载体质粒经酶切37 ℃处理30 min后,需加入去磷酸化酶Thermosensitive Alkaline Phosphatase以防止其发生自连,37 ℃再处理30 min后进行切胶回收备用。表达载体总体积15.0 μL,含单酶切目的基因产物6.5 μL,表达载体单酶切产物1.0 μL,Ligation version.2 7.5 μL。于16 ℃连接12 h,将连接产物转化大肠埃希菌感受态细胞并涂布在含有卡纳霉素(Kan,50 μg·mL-1)抗性的平板上筛选阳性克隆,阳性克隆经PCR鉴定后,将含有目的基因的菌液送往擎科生物公司进行DNA测序,获得重组表达质粒。
1.5 P3及P3-C致病性分析
将测序成功质粒(P3、P3-C、P3-C-dN、P3-C-dC)使用电击法转化到农杆菌GV3101菌株,2 d后经菌落PCR鉴定成功后挑取单菌落摇菌,集菌后用缓冲液(10 mmol·L-1pH 5.8的MES、10 mmol·L-1MgCl2和200 μmol·L-1乙酰丁香酮)重悬农杆菌沉淀,28 ℃静置2 h注射9或10叶期的本氏烟。注射后持续观察烟草症状表现。

表1 引物列表
P3为完整蛋白,P3-C为P3的712-981个核苷酸,P3-C-dN和P3-C-dC分别为P3-C缺失N段的跨膜结构域和缺失C端的跨膜结构域片段。
P3 indicated the complete protein; P3-C indicated the region of 712-981 of P3; P3-C-dN indicated the transmembrane domain of P3-C with N-terminal deletion; P3-C-dC were the transmembrane domain of P3-C with C-terminal deletion.
1.6 P3-C移码突变
将WYMV P3-C肽段中第一个翻译起始密码子ATG之后的第一个碱基进行缺失突变,使后续的氨基酸发生移码突变。利用移码突变后的P3-C基因序列构建TRV重组载体,经农杆菌浸润后,持续观察本氏烟的症状。
1.7 P3-C跨膜结构域突变
为了研究P3-C两个跨膜结构域(TMD1和TMD2)对P3-C功能的重要性,我们将TMD1和TMD2中的重要氨基酸用脯氨酸替代,从而破坏跨膜结构域的功能。突变被设计为减少TMD的疏水性,将TMD1中的2个亮氨酸以及一个酪氨酸(LLY),TMD2中异亮氨酸,酪氨酸,苯丙氨酸以及亮氨酸(IYFL)分别用连续的脯氨酸替代产生mP3-C突变体。另外,我们同时设计了分别缺失TMD1和TMD2的2个突变体,命名为P3-C-dN和P3-C-dC。利用突变后的基因序列分别构建TRV重组载体,经农杆菌浸润后,持续观察本氏烟的症状。
2 结果与分析
2.1 WYMV P3及P3-C基因克隆与序列分析
为获取P3及P3-C目的片段,从WYMV侵染的小麦叶片中提取总RNA,RT-PCR扩增得到了WYMV P3(TRV-WYMV-P3-F/R)及P3-C(TRV-WYMV-P3-C(712)-F/P3-R)cDNA片段(图1-A),割胶回收PCR产物并将其分别构建到PstⅠ酶切的TRV载体上,PCR检测并挑取阳性克隆送测。测序结果表明,P3基因全长由981个核苷酸组成,共编码327个氨基酸,P3-C核苷酸长度为270,编码90个氨基酸。通过NCBI BLAST同源比对明确了扩增的确实为WYMV P3序列。经DNAMAN蛋白质跨膜结构域分析发现,P3编码的蛋白氨基酸含有多个疏水性区域,且含有3个跨膜结构域,P3-C(712-981)含有两个跨膜结构域(图1-B)。
2.2 WYMV P3-C在本氏烟上具有致病效应
将P3及P3-C成功构建到TRV载体后,与TRV-RNA1农杆菌共浸润本氏烟植株。结果表明,农杆菌浸润5 d后,与对照组相比,TRV-P3-C在浸润烟草2 d时(图2-A、D),接种叶即开始出现萎蔫失水,接种后4 d接种叶片坏死且紧挨接种叶的茎部开始萎蔫坏死(图2-B、E),接种5 d整个茎部进入失水萎蔫坏死状态,植株已无法正常生长发育,直至整株植物死亡(图2-F)。有意思的是,构建的P3全长载体TRV-P3与对照组相比则没有明显表型差异,均未引起本氏烟致病表型(图2-C)。
2.3 P3-C的致病有效因子为多肽
由于P3-C致病性可能由病毒来源的小干扰RNA或病毒编码的多肽引起,为进一步明确P3-C致病性是否由P3-C编码的氨基酸引起,我们将P3-C进行移码突变,并命名为P3-C-FM(图3-A)。通过农杆菌侵染本氏烟5 d后观察症状,结果表明移码突变后的P3-C(即P3-C-FM)和对照症状类似,无法在本氏烟上引起P3-C的萎蔫坏死表型(图3-D),表明P3-C的致病性确实是由其编码的氨基酸引起的。

M,DNA marker;泳道1,WYMV P3;泳道2,WYMV P3-C。M, DNA marker; Lane 1, WYMV P3; Lane 2, WYMV P3-C.图1 RT-PCR扩增结果(A)及P3编码的氨基酸序列分析和跨膜结构域预测(B)Fig.1 RT-PCR results (A) and sequence analysis of P3 protein and prediction of its transmembrane domains (B)

A-B,TRV-GUS分别侵染烟草2和5 d症状图,作为阴性对照;C,TRV-P3症状图;D-F,TRV-P3-C分别侵染烟草2、4和5 d症状图。A-B, Symptoms of N. benthamiana induced by expression of GUS gene(negative control) for two and five days after injection; C, Symptoms of TRV-P3; D-F, Symptoms of N. benthamiana induced by expression of P3-C for two, four and five days after injection.图2 TRV分别表达WYMV P3和P3-C在本氏烟上引起的症状Fig.2 Symptoms of N. benthamiana induced by expression of WYMV P3 and P3-C in a TRV vector
2.4 跨膜结构域对WYMV P3-C的致病性具有重要作用
为研究P3-C两个跨膜结构域(TMD1和TMD2)对P3-C功能的重要性,我们将P3-C中两个跨膜结构域中疏水性氨基酸用脯氨酸替代,重新构建TRV-mP3-C重组载体(图4-A)。同时,我们还将两个跨膜结构域分别单独缺失,构建突变体TRV-P3-C-dN和TRV-P3-C-dC(图4-A)。农杆菌浸润后持续观察本氏烟上引起的症状,结果表明,浸润5 d后无论是TRV-mP3-C还是TRV-P3-C-dN/TRV-P3-C-dC均和对照类似,无明显症状,不具备致病性(图4-B),表明这两个跨膜结构域对WYMV P3-C的致病性均有十分重要的作用。
3 讨论
植物病毒编码的复制酶、运动蛋白、外壳蛋白等均有可能是病毒的致病因子,多种植物病毒中曾报道过复制酶导致的寄主致病性[18]。同时有研究表明,寄主RNA干扰产生的病毒来源的小干扰RNA除剪切病毒自身基因组外,也可能靶向寄主内源性靶标并对其进行转录后水平调控,导致寄主症状的产生[19-20]。由于WYMV在小麦上的研究缺乏反向遗传学工具,同时禾谷多黏菌传毒体系在室内建立较困难,因此目前WYMV的相关研究进展较慢。本研究利用TRV介导的本氏烟基因沉默系统,明确了WYMV的P3碳端在本氏烟上具有致病相关功能域P3-C,且其致病性是由多肽引起的,同时其两个跨膜结构域对致病性具有重要作用,有助于后续对WYMV致病机理的深入研究。本研究发现,P3-C在本氏烟上有致病活性,而完整P3蛋白则不具备,推测是由于P3-C比P3缺少一个跨膜结构域,P3-N端的区域在结构上可能会掩盖P3-C端的致病能力,这一推测还有待进一步实验验证。


A,P3-C移码突变示意图;B,TRV-GUS为阴性对照;C,TRV-P3-C为阳性对照;D,TRV-P3-C移码突变(TRV-P3-C-FM)症状图。A, Schematic diagram of P3-C frame shift mutation; B, TRV-GUS was used as a negative control; C, TRV-P3-C was used as a positive control; D, TRV-P3-C frame shift mutation (TRV-P3-C-FM) symptom.图3 移码突变示意图及烟草症状图Fig.3 Schematic diagram of frame shift mutations and the symptoms of infected N. benthamiana
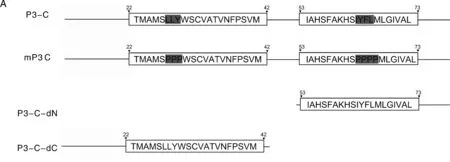

A,P3-C跨膜结构域突变示意图;B,TRV-GUS为阴性对照;C,TRV-P3-C为阳性对照;D、F,P3-C跨膜结构域突变症状图。A, Schematic diagram of P3-C frame shift mutation; B, TRV-GUS was used as a negative control; C, TRV-P3-C was used as a positive control; D-F, P3-C transmembrane domain mutation symptom.图4 跨膜结构域突变示意图及烟草症状图Fig.4 Schematic diagram of transmembrane domain mutations and the symptoms of N. benthamiana
先前研究表明,P3氨基酸序列在马铃薯Y病毒属中具有较高保守性,P3氨基酸序列在WYMV不同分离物中也具有很高保守性(未发表数据),这可能和P3在病毒侵染过程中具有多种重要功能有一定关系。已有研究表明,P3蛋白除了对宿主具有致病性外,其在病毒的复制[10],克服宿主抗性[11-12],细胞间移动[14-15]等方面均有重要功能。与WYMV同一家族中的不同病毒相比,不同病毒编码的P3在寄主内的亚细胞定位有所不同。如烟草叶脉斑点病毒(Tobacco vein mottling virus,TVMV)的P3蛋白与CI蛋白在寄主的细胞质中发生相互互作[21],而烟草蚀纹病毒(Tobacco etch virus,TEV)的P3蛋白则在细胞核内与病毒编码的NIb和NIa蛋白发生互作[22]。这些现象表明,不同病毒的P3蛋白可能在寄主中发挥不同功能,而WYMV病毒P3蛋白在寄主内的亚细胞定位情况及发挥的生物学功能还有待进一步的探索研究。
