一株J亚型禽白血病病毒的分离鉴定及其gp85基因的序列分析
2019-05-21王元红鲁智敏张学琪刘自敏胡子慧杨侃侃刘红梅彭开松李永东
王元红,鲁智敏,张学琪,刘自敏,胡子慧,杨侃侃,刘红梅,潘 玲,彭开松,李永东,王 勇,*
(1.安徽农业大学 动物科技学院,安徽 合肥 230036; 2.宁波市疾病预防控制中心,浙江 宁波 315010)
禽白血病病毒(avian leucosis virus,ALV)为反转录病毒科α反病毒属成员,能够引起禽类特别是鸡的多种肿瘤性疾病[1]。根据病毒囊膜蛋白与病毒的宿主特异性相关的gp85蛋白抗原性不同,ALV可分为A-J 10个亚群。进一步又可分为两大类:一类为A、B、C、D和J亚群等外源性病毒,具有致病性,以A、B和J亚群为主;另一类属内源性病毒,大多数整合在宿主的基因上,主要以前病毒的形式存在,对鸡几乎不致病,但普遍存在于鸡群中,可以加重ALV其他亚群的感染[2-4]。
1991年英国学者首次在肉鸡中发现一种新型禽白血病病毒ALV J,其在鸡群中的致病性和传染性最强[5]。ALV J基因组主要含有gag、pol和env3个基因,其gag和pol基因相对保守,而包括gp85在内的env基因上存在着较大变异,其亚群特异性主要是由gp85基因编码表面囊膜蛋白所决定[6]。我国自1999年分离出第一株ALV J亚型病毒以来,陆续可见从商品肉鸡和蛋鸡中分离出该病毒的报道[7-9]。禽白血病的净化较为困难,其垂直和水平传播引起临床和亚临床感染对我国禽类养殖业造成较大的经济损失。
本研究为确定安徽巢湖某养鸡场的疑似禽白血病的病原,通过RT-PCR、透射电镜及组织病理学的方法进行鉴定,确诊病原为J亚型禽白血病。同时以gp85基因对该分离株进行遗传进化分析。本试验为了解安徽土鸡种群中禽白血病的分子流行病学特点提供了数据参考。
1 材料与方法
1.1 试验材料
rTaqDNA 聚合酶、pMD19-T 载体、SolutionⅠ、DH5α感受态细胞购自TaKaRa公司;DF-1细胞系由本实验室保存。
1.2 主要试剂
琼脂糖凝胶DNA回收试剂盒、病毒基因组DNA/RNA提取试剂盒购自北京Tiangen公司;青霉素-链霉素溶液(100×)购自上海Beyotime公司;DMEM细胞培养液及FBS胎牛血清购自美国ThermoFisher公司;铜网、国产网碳支持膜及磷钨酸染液购自北京Zxbairu技术有限公司;其余试剂均为国产分析纯。
1.3 试验方法
1.3.1 病料采集及处理
2018年3月安徽巢湖某养鸡场疑似暴发禽白血病,对临床症状明显的疑似禽白血病的病禽进行剖检,无菌采集病禽的心脏、肝脏、腺胃和脾脏。取部分病料以PBS漂洗3次后,剪碎,加入5 mL PBS研磨充分并按1 000 U·mL-1加入青霉素-链霉素溶液,8 000 r·min-1离心3 min,取上清,经0.22 μm滤膜过滤后置于-80 ℃冰箱待用。
1.3.2 病毒分离及增殖培养
取1 mL 1.3.1节中的病料上清接种于细胞密度约为80%的DF-1细胞,置于37 ℃含5% CO2细胞培养箱孵育1.5 h后弃去病毒液,PBS轻洗3次,加入含1% FBS的DMEM细胞维持液继续培养7 d。7 d后将细胞反复冻融3次,收毒,置于-80 ℃保存。
1.3.3 透射电镜负染观察
取1.3.2节中的细胞培养液进行超速离心浓缩,吸取20 μL上清滴于封口膜,铜网吸附3~5 min,以10 g·L-1磷钨酸(pH 6.8~7.4)负染1 min,透射电镜下观察并拍照。
1.3.4 RNA的提取与RT-PCR
取1 mL ALV 细胞培养液提取病毒RNA。将RNA反转录成cDNA,保存于-80 ℃待用。
1.3.5 引物设计与合成
根据GenBank上公布的gp85基因序列(No. Z46390),通过Primer Premier 5.0 软件设计1对特异性引物用于gp85基因的扩增。上游引物为5’-GGAGTTCATCTGTTGCGA-3’;下游引物为5’-CGCGGATCCGCGCCTGCTACGGCGGT-3’。预计扩增产物长约928 bp。引物委托南京擎科生物科技有限公司合成。
1.3.6gp85基因的PCR 扩增
利用合成的引物,对gp85基因进行PCR扩增。PCR反应体系:rTaqDNA聚合酶Mix 10 μL,ALV cDNA模板1 μL,上、下游引物各1 μL,补加灭菌ddH2O至20 μL。PCR反应条件:95 ℃预变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃延伸10 min。扩增产物经琼脂糖凝胶DNA回收试剂盒回收后与pMD19-T载体连接,然后转化至DH5α感受态细胞中,涂布氨苄抗性的LB平板上。37 ℃培养过夜后挑取单菌落,通过菌液PCR筛选阳性克隆。再将鉴定正确的阳性重组质粒送往南京擎科生物科技有限公司测序。
1.3.7 组织病理学观察
采集病鸡心、肝、脾及腺胃的组织块,用10%中性福尔马林固定。然后进行常规石蜡切片,进行HE染色,用显微数码成像系统观察病理组织学变化并拍照。
1.3.8gp85基因序列分析
将获得的基因序列进行BLAST检索,用DNASTAR软件将分离毒株的gp85基因序列分别与GenBank中已发表的ALV不同亚群代表株进行核苷酸同源性比较。采用Clustal X 2.1软件进行多序列匹配排列,运用Mega 6.0软件采用邻接法构建系统发育树,并通过1 000次的自举分(Bootstrap)进行置信度检验。
2 结果与分析
2.1 病鸡外观及剖检病理变化
发病鸡表现为极度消瘦、贫血,鸡冠肉髯苍白萎缩,剖检可见肌肉颜色偏浅;肝脏、脾脏和肾脏肿大,质脆易碎,表面与切面均见有大小不等的白色或灰白色结节;心脏颜色苍白,心肌疲软;肺脏颜色苍白;胰腺潮红;腺胃出血、糜烂;卵泡变性、坏死(图1)。
2.2 ALV的透射电镜负染观察
透射电镜负染观察可见完整的病毒粒子,呈球形,大小约100 nm,有核心,电子密度较高,核心外包有一层囊膜(图2)。

A,鸡冠肉髯苍白萎缩;B,肌肉颜色偏浅;C,肝脏、脾脏和肾脏肿大,质脆易碎,表面有大小不等的白色或灰白色结节;D,腺胃出血、糜烂。A, The cockscomb was pale and atrophy; B, Light muscle tissue; C, The liver, spleen and kidney were swollen, brittle and fragile with white nodulesoccurred; D, Glandular hemorrhage and erosion.图1 病鸡的临床剖检病理变化Fig.1 Pathological changes of sick chicken by clinical anatomy
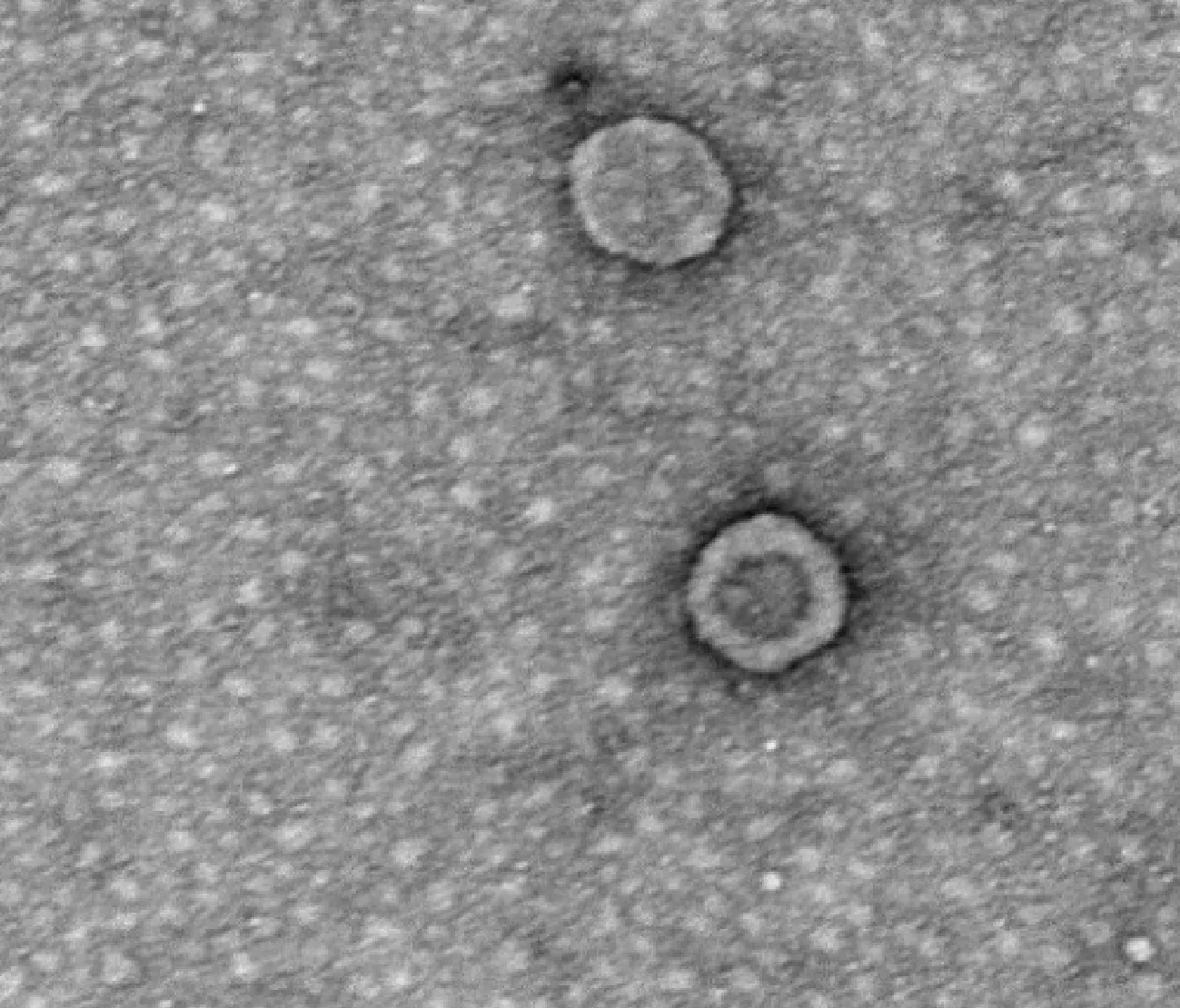
图2 ALV的透射电镜负染观察Fig.2 Negative staining observation of ALV by transmission electron microscope
2.3 gp85基因的RT-PCR扩增结果
经1%琼脂糖凝胶电泳分析,可见约928 bp左右特异性条带,与预期相符(图3)。序列测定结果未发现碱基突变和缺失。
2.4 组织学病理变化
病理切片观察结果显示,心脏组织可见弥漫性淋巴样瘤细胞,心肌纤维间隙有出血;肝组织中肝细胞消失,可见肿瘤结节灶,肿瘤细胞多为形态各异的成淋巴细胞和淋巴样瘤细胞,并多见病理性核分裂相;脾脏组织脾小体消失伴有数量不等局灶性或弥漫性肿瘤细胞增生灶;腺胃肌层及腺胃乳头间隙有弥漫性淋巴样瘤细胞,腺胃乳头出血(图4)。

M,DL2000分子质量标准;1,gp85基因的RT-PCR产物;2,阴性对照。M, DL2000 DNA marker; 1, gp85 gene RT-PCR product; 2,Negative control.图3 gp85基因的RT-PCR扩增结果Fig.3 RT-PCR amplification of gp85 gene
2.5 gp85基因的遗传进化分析
AHCH-2018株的gp85基因长度为928 bp。该序列与GD1401J相似度最高,达99.5%。核苷酸同源性比对结果表明:分离株与广东J亚群GD1401J的同源性最高,达99.5%;与美国J亚群ALV经典代表株HPRS-103同源性为98.1%;与A亚群代表株RAV-1同源性为49.1%;与B亚群代表株RSV-B同源性为46.9%;与C亚群代表株RSV-C同源性为48.7%;与D亚群代表株RSV-D同源性为49.7%;与E亚群代表株ALVE-B11核苷酸同源性为46.5%(图5)。
绘制的系统进化树结果显示,ALV的J亚群与A、B、C、D、E亚群在进化树分为两大分支,分离株与GD1401J处于同一分支;与美国J亚群ALV经典代表株HPRS-103有一定的遗传距离(图6)。

A,心脏组织可见弥漫性淋巴样瘤细胞,心肌纤维间隙有出血(HE×400);B,肝组织中肝细胞消失,可见肿瘤结节灶,并多见病理性核分裂相(HE×400);C,脾脏组织脾小体消失伴有数量不等局灶性或弥漫性肿瘤细胞增生灶(HE×400);D,腺胃肌层及腺胃乳头间隙有弥漫性淋巴样瘤细胞,腺胃乳头出血(HE×400)。A, Foci of tumor cell proliferationoccurred in the heart tissue, the myocardial fibrosis hemorrhage (HE×400); B, The structures of liver were difficult to identify, foci of tumor cell proliferation and pathological mitotic phaseoccurred in liver(HE×400); C, Foci of tumor cell proliferation occurred in spleen, splenic corpuscles demolished and disappeared (HE×400); D, Foci of tumor cell proliferation occurred in glandular gastric muscle and glandular papillary space, gland gastric papillary hemorrhage (HE×400).图4 组织病理学变化Fig.4 Histopathological changes

图5 分离株gp85基因与不同ALV亚群经典株和参考株的核苷酸序列同源性分析Fig.5 Similarity analysis of nucleotide sequences of gp85 gene within different ALV subtypes

▲,本试验分离株。▲, stains isolated in this study.图6 分离株gp85基因与不同ALV亚群代表株核苷酸系统进化树Fig.6 Nucleotide phylogenetic tree of gp85 gene and representative strains of different ALV subpopulations
3 讨论
21世纪初,自中国境内首次于白羽鸡体内分离出J亚群的ALV,该病毒在2008—2009年对商业鸡养殖业造成了较大的损害[10]。随着我国不同品种鸡的饲养呈现规模化、集约化发展,蛋鸡、地方品种鸡感染J亚群ALV的病例报道不断增多[11]。王波等[12]通过检测种蛋中禽白血病病毒得出皖南黄父母代肉种鸡群存在的外源性ALV感染主要为ALV J;2009—2010年对中国部分地区进口鸡群禽白血病流行病学调查显示,在进口蛋鸡品系和中国进口祖代鸡群中存在较高的ALV感染率,且J抗体阳性率普遍高于A/B抗体阳性率[13]。本试验亦是一例典型案例,从安徽地方品种分离鉴定出的一株J亚型ALV提示了亟需加强安徽地区J亚群ALV净化工作。
ALV同一亚群的毒株gp85基因同源性较高,一般应在90%左右,而与其他亚群的同源率只有40%左右[14-16]。因此,针对J亚群禽白血病原型株HPRS-103前病毒基因DNA gp85囊膜糖蛋白基因的一段序列作为引物,可用于检测ALV J[17]。本试验利用RT-PCR技术成功从安徽地方品种鸡的肿瘤中扩增出长928 bp的gp85基因,通过透射电镜观察可见有囊膜的病毒粒子,确诊该鸡场存在禽白血病。结合临床剖检及组织病理学发现该患病鸡只肝脏、脾脏显著肿大,表面均有肿瘤结节,HE染色后均可见大量或成灶性或弥漫性淋巴样瘤细胞增殖并伴有出血现象,表明分离出的AHCH-2018株可以不同程度地侵害鸡只各组织器官。
通过序列比对发现AHCH-2018株gp85核苷酸序列与GenBank已发表的10株ALV J序列的核苷酸同源性为94.1%~99.5%,进一步证实本试验分离到的AHCH-2018株属于J亚群,同时也预示ALV的变异一直处于缓慢的演化中。近年来的研究推断,中国的ALV可能最初来源于国外的进口肉种鸡,而后传播到中国地方品种和进口蛋种鸡品种[18]。J亚型禽白血病在安徽地方品种的出现,说明J亚型禽白血病正在向中国地方品种鸡群中传播蔓延,这提示我们在加强对西方引种祖代鸡群中ALV监测的同时,应提高我国自繁自养的地方品系鸡群ALV的系统净化。本研究结果为了解安徽土鸡种群中禽白血病的分子流行病学特点提供了数据参考。
