宁春4号与河东乌麦杂交F2代抗病性及分子标记鉴定
2019-05-21王掌军张双喜刘凤楼李清峰张晓岗刘生祥
王掌军,刘 妍,张双喜,刘凤楼,李清峰,张晓岗,刘生祥,贾 彪,*
(1.宁夏大学 农学院, 宁夏 银川 750021; 2.宁夏优势特色作物现代分子育种重点实验室, 宁夏 银川 750021; 3.黑龙江禾田丰泽兴农科技开发有限公司,黑龙江 哈尔滨 150028; 4.宁夏农林科学院 农作物研究所,宁夏 银川 750001)
小麦(TriticumaestivumL.)是世界上最重要的粮食作物之一,其面积和产量均居谷类作物之首。由于长期的人工选择和栽培,导致大量小麦优异基因丢失。同时,由于育种家一贯追求矮秆、高产的育种目标,加之近年来水肥条件和群体密度提高且品种单一化种植,当今栽培小麦遗传基础日趋狭窄、脆弱,使得小麦极易受到全球气候变化和病虫害的侵染,不能适应高产、稳产和可持续发展的需要[1-2]。我国小麦主要病害有锈病、白粉病、赤霉病、黑穗病、根腐病、黄矮病、纹枯病等。小麦病害是小麦生产中重要的制约因素之一[3]。宁夏属于小麦条锈病流行区域,叶锈病也有加大的趋势,连续4 a白粉病成为宁夏小麦生产上的第一大病害[4-5]。小麦白粉病是由小麦禾布氏白粉菌(Blumeriagraminisf. sp.tritici)引起的真菌性病害,在病害发生一般年份可使小麦减产5%~34%[6]。自Waterhouse首次报道了小麦Thew中的一对显性抗白粉病基因以来,科学家们在普通小麦及其近缘种属中先后发现了多个抗性基因,国际上已正式命名了分布在60个位点的84个抗白粉病基因[7-15]。这些抗性基因在不同时期不同程度地提高了小麦抗白粉病的能力,尤其携带Pm8、Pm17、Pm20等抗白粉病基因的小麦-黑麦1RS/1BL易位系和携带Pm21基因的小麦-簇毛麦6VS/6BL易位系在世界小麦育种中应用最为广泛[16-19]。小麦锈病分条锈病、秆锈病、叶锈病3种,危害部位以叶片为主,叶鞘、茎秆和穗部也可受害。流行年份受害小麦可减产30%以上,甚至绝收[20-21]。条锈病是由专性寄生条形柄锈菌(Pucciniastriiformisf. sp.tritici)引起的真菌性病害,我国曾发生4次全国性条锈病大流行,1905年条锈病造成的损失最严重,使小麦减产60亿kg[22]。目前,国际上正式命名的小麦条锈病抗性基因有80个[23-24]。由叶锈菌(Pucciniareconditaf. sp.tritici)引起的小麦叶锈病也是小麦的主要病害之一,已经发现的小麦抗叶锈病基因有100多个,正式命名的有68个[25-26]。
由于小麦白粉病菌、锈病菌具有群体大、适应范围广、生理小种变异快等特点,品种抗病性丧失问题严重[27-28]。在常规抗病育种的同时,利用分子标记辅助选择技术,实现了品种间优异基因高效筛选[29-30]、基因聚合[31-33],为抗病育种提供了可供利用的中间材料。宁夏主栽小麦品种宁春4号综合农艺性状和产量表现好,但感白粉病、叶锈病和条锈病;育成于山西运城的河东乌麦高抗白粉病、中抗条锈病和叶锈病。在前期对这2个小麦品种遗传性状与分子标记分析的基础上[34-35],构建了杂交组合群体,对其F2代进行抗病性和分子标记鉴定,以期从后代中发掘宁夏小麦抗病性改良的育种中间材料和分子标记。
1 材料与方法
1.1 材料
宁春4号为宁夏主栽小麦品种,河东乌麦引自山西省运城学院杜磊博士。2016年在宁夏大学教学实验农场组配宁春4号与河东乌麦正反交组合,同年将收获的杂交种子在云南南繁加代,2017年将收获的种子种植于宁夏大学实验农场,单粒点播,每行10粒,行长1.1 m,行宽0.2 m,获得331个单株的F2后代群体,其中正交后代201株(编号001—007、013—206),反交后代130株(编号008—012、207—331)。
1.2 小麦抗病性鉴定
种植宁夏古老地方品种红秃子作为感白粉病、感锈病诱发圃,采用白粉菌混合小种(收集于宁夏当地)、条锈菌和叶锈菌的混合小种(来自西北农林科技大学植物病理研究所)与马铃薯粉混合。在5月初,17:00左右接种于分蘖期小麦,之后覆膜并灌水,第2天早上揭膜。在小麦成株期调查田间白粉病、条锈病和叶锈病抗性。
成株期白粉病田间鉴定参照0~9级标准:0级为免疫(immune,I),0i级为近免疫(nearly immune, NI),1、2级为高抗(highly resistant,HR),3、4级为中抗(moderate resistant,MR),5、6级为中感(moderate susceptible,MS),7、8级为高感(highly susceptible,HS),9级为极感(extremely susceptible, ES)[36]。
锈病抗性鉴定采用0~5级标准:0、1、2、3、4、5级的抗病性和病情指数分别为免疫(I)、0,高抗(HR)、0~20,中抗(MR)、20~40,中感(MS)、40~60,高感(HS)、60~80,极感(ES)、80~100[37]。病情指数(DI)=x1a1+x2a2+……+xnan/nT×100。式中,x为普遍率,a为严重度,n为最大严重度,T为调查样品数。
1.3 小麦抗病性分子标记分析
根据小麦7个部分同源群小卫星区设计SSR标记,利用能够在宁春4号与河东乌麦间稳定扩增的49个SSR标记[35]进行QTL分析,其中对本研究材料抗病性有明确QTL定位结果的6个标记名称和序列见表1。3个分别与白粉病、条锈病和叶锈病相关的标记Xgwm159-5B、WMC364和STS24-16参照文献[38-40],具体信息见表1。所有标记均由生工生物工程(上海)股份有限公司合成。
基因组DNA的提取采用SDS法[41]。PCR反应体系(10 μL):10× reaction buffer 2 μL,MgCl2(25 mmol·L-1)0.8 μL,dNTPs(2.5 mmol·L-1)0.8 μL,上、下游引物(10 μmol·L-1)各0.2 μL,模板DNA 100 ng,TaqDNA聚合酶(5 U·μL-1)0.05 μL,加ddH2O至总体积10 μL。PCR扩增程序:94 ℃ 3 min;94 ℃ 30 s,55~60 ℃ 45 s,72 ℃ 1 min,34个循环;72 ℃ 10 min,4 ℃保存。扩增产物检测:采用8%聚丙烯酰胺凝胶电泳检测,电泳时总电压为180 V,电泳1.5 h左右,经银染后观察并照相,统计扩增条带。

表1 分子标记序列信息
1.4 数据统计
采用Excel 2013对抗病性和分子标记结果进行统计。用MapManager QTXb 20进行QTL定位,取概率值P<0.05的连锁系数(logarithm of odds score, LOD值)作为判断QTL存在的阈值;利用Kosambi函数中单标记回归分析的方法进行QTL分析,检测亲本间有多态性的引物在F2群体中的分布,根据电泳谱带结果,建立SSR标记数据库:与母本相同的带型记为“B”,与父本相同的带型记为“A”,杂合带记为“H”,缺失记为“-”。将331个F2单株的分子标记结果与抗病性数据相结合,运用MapManager QTXb 20软件检测相关QTL位点,QTL命名公式为:小写字母q+大写英文字母目标性状的代称+所在染色体号数。QTL全称通常用斜体表示,如在2A染色体上,与穗长相关的QTL位点命名为“qSL2A”。
2 结果与分析
2.1 宁春4号与河东乌麦抗病性鉴定
对2个亲本进行了苗期白粉病和成株期白粉病、条锈病、叶锈病抗性鉴定,结果见图1:宁春4号苗期感白粉病,成株期感白粉病、条锈病和叶锈病;河东乌麦苗期和成株期均表现抗病。2016年、2017年2个亲本成株期的田间抗病性见表2。河东乌麦的田间白粉病抗性较宁春4号强,宁春4号的2年病级均为5~6级,属于中感;河东乌麦的2年病级分别为1~2、2~3级,分别为高抗、中抗至高抗类型。河东乌麦表现出较强的抗条锈病,宁春4号2年的病级、抗病性均分别为3级、中感,病情指数分别为46.67、43.88;河东乌麦2年病级、抗病性均分别为2级、中抗,病情指数分别为30.00~33.33、21.66~28.33。此外,田间叶锈病抗性表明,宁春4号为3级、中感,病情指数分别为41.48、49.33;河东乌麦为2级、中抗,病情指数分别为23.33~26.66、30.00~35.00。

苗期1~3为宁春4号上白粉病, 4~6为河东乌麦上白粉病。成株期1~3依次为宁春4号上白粉病、条锈病、叶锈病;4~6依次为河东乌麦上白粉病、条锈病、叶锈病。Seedling stage, 1-3 were powdery mildew on Ningchun No.4, 4-6 were powdery mildew on Hedong black wheat. Adult stage, 1-3 were powdery mildew, stripe rust, leaf rust on Ningchun No.4, respectively, 4-6 were powdery mildew, stripe rust, leaf rust on Hedong black wheat.图1 宁春4号与河东乌麦成株期旗叶上的病情Fig.1 Disease on flag leaves of Ningchun No.4 and Hedong black wheat
2.2 宁春4号与河东乌麦杂交F2代抗病性鉴定
对宁春4号与河东乌麦杂交F2代群体331个单株进行成株期白粉病、条锈病和叶锈病抗性鉴定,结果见表3。在F2代群体中分别有33(占9.97%)、3(0.91%)、2(0.60%)个单株表现为高抗白粉病(病级1~2级)、条锈病和叶锈病(1级);分别有35(占10.57%)、51(15.41%)、50(15.11%)个单株表现为中抗白粉病(3~4级)、条锈病和叶锈病(2级)。50个(占15.11%)同时抗白粉病和条锈病,44个(13.29%)同时抗白粉病和叶锈病,32个(9.67%)同时抗条锈病和叶锈病,29个(8.76%)同时抗白粉病、条锈病和叶锈病。
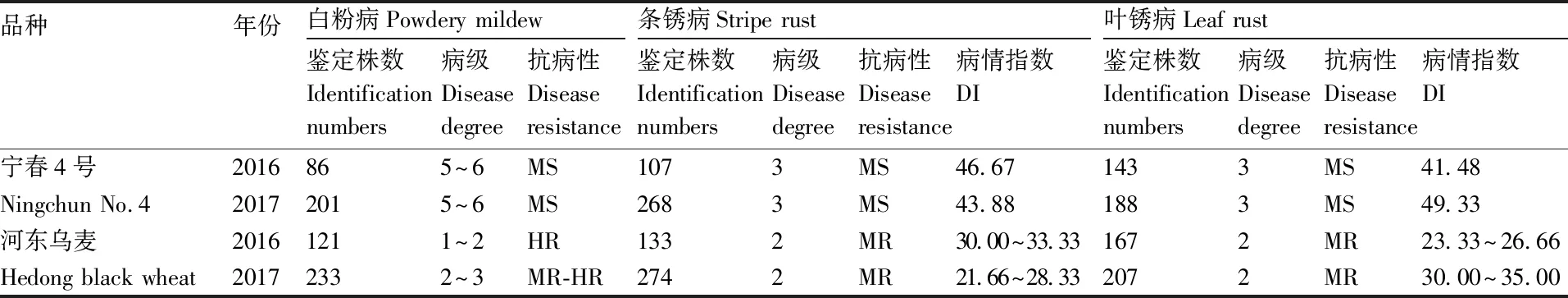
表2 宁春4号与河东乌麦田间抗病性统计结果
2.3 宁春4号与河东乌麦杂交F2代分子标记
2.3.1 抗病性相关分子标记辅助选择
利用白粉病基因Pm16等位基因标记Xgwm159-5B(目标片段197 bp)、条锈病基因Yr2标记WMC364(201~207 bp)和叶锈病基因Yr2标记STS24-16(180~190 bp),检测Pm16、Yr2和Yr2在F2代中的分布。表4表明,有239个单株(占总单株数72.21%)携带基因Pm16,其中有54个单株(占携带该基因单株数的22.59%)表现为中抗至高抗白粉病;202个单株(占总单株数61.03%)携带基因Yr2,有34个单株(占携带该基因单株数的16.83%)表现为中抗至高抗条锈病;246个单株(占总单株数74.32%)携带基因Lr24,有42个单株(占携带该基因单株数的17.07%)表现为中抗至高抗叶锈病。同时,有148个单株(占总单株数44.71%)携带基因Pm16和Yr2,16.22%携带这2个基因的单株表现为抗白粉病和条锈病;185个单株(占总单株数55.89%)携带基因Pm16和Lr24,16.76%携带这2个基因的单株表现为抗白粉病和叶锈病;155个单株(占总单株数46.83%)携带基因Yr2和Lr24,11.61%携带这2个基因的单株表现为抗叶锈病和条锈病。另外,119个单株(占总单株数35.95%)携带基因Pm16、Yr2和Lr24,有13个单株(占携带3个基因单株数的10.92%)表现为抗白粉病、条锈病和叶锈病。
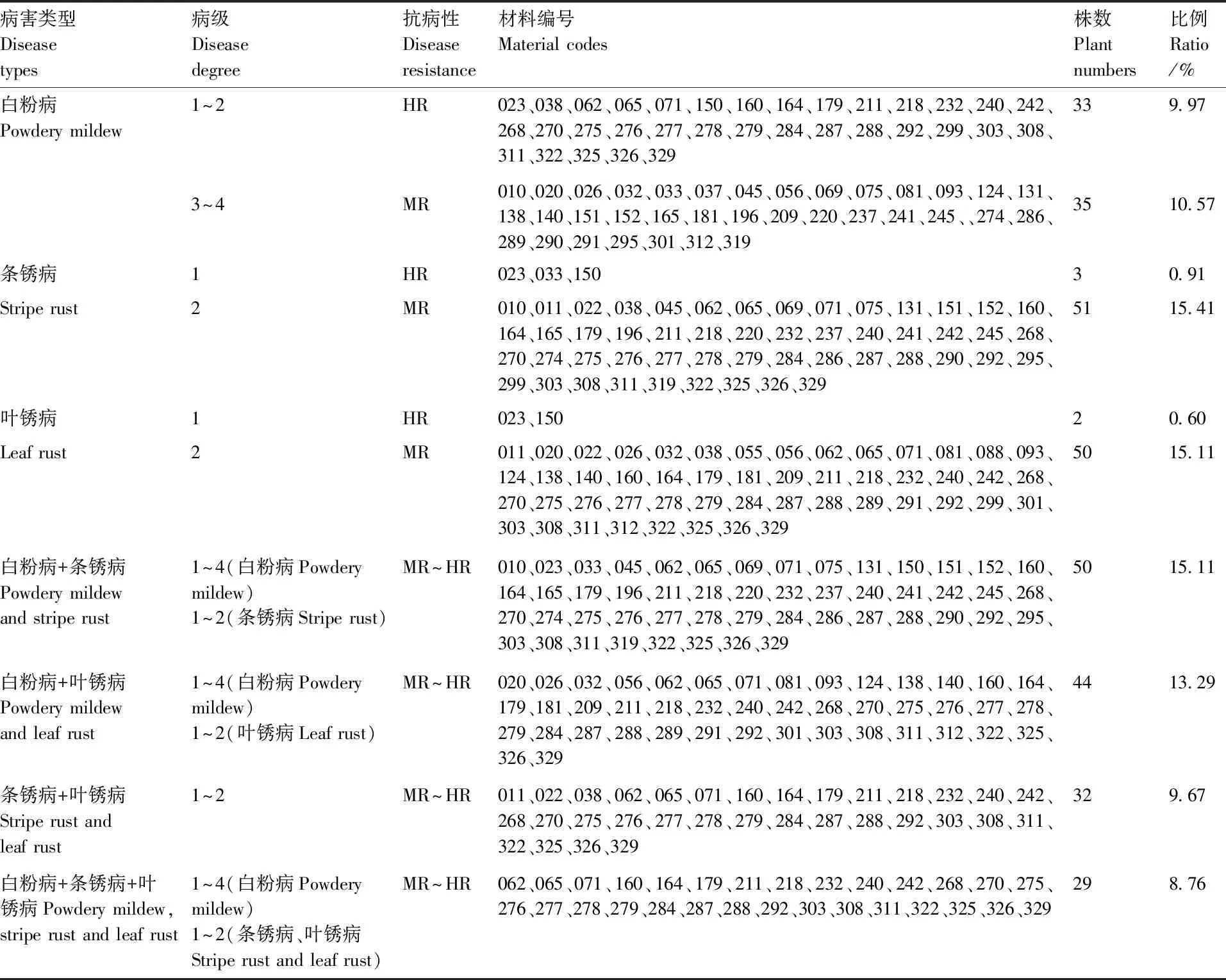
表3 宁春4号与河东乌麦F2群体抗病类型和数量
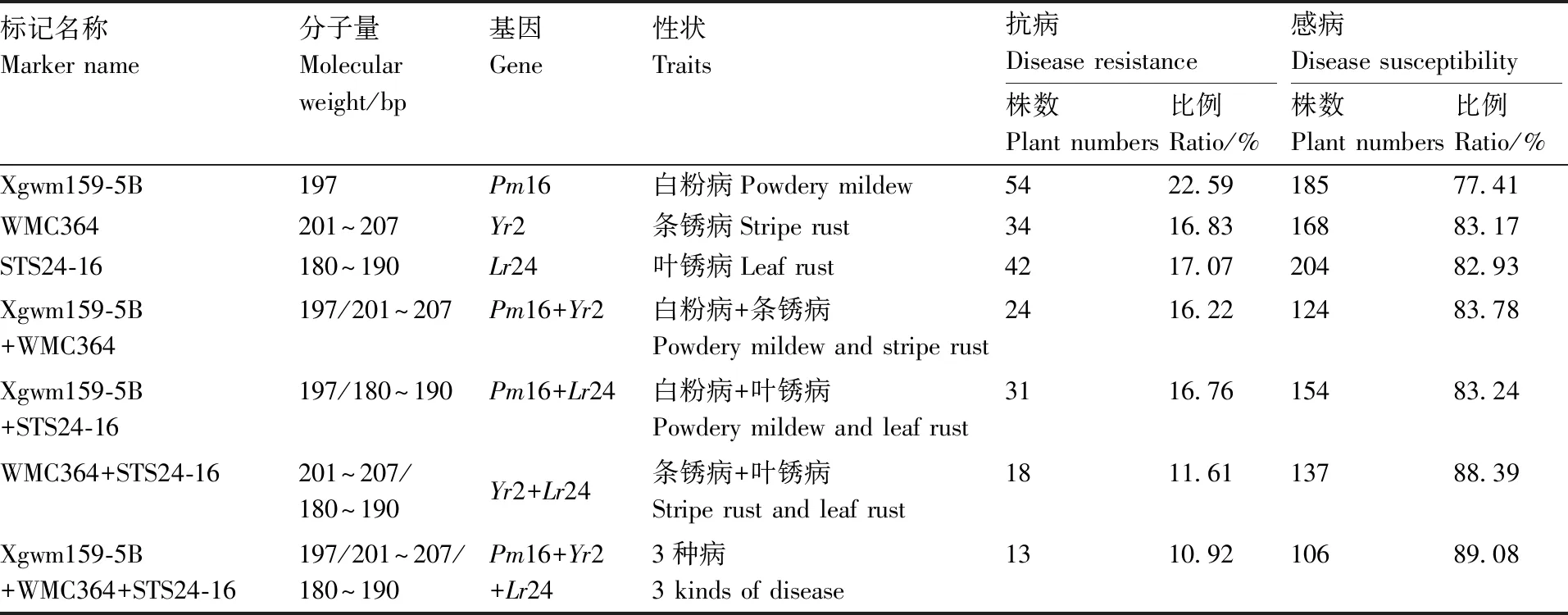
表4 等位基因标记在宁春4号与河东乌麦杂交F2代中的分布及抗病性
2.3.2 抗病性QTL分析
利用能够在宁春4号与河东乌麦间稳定扩增的49个SSR标记对F2群体进行检测,结果见图2。其中,有6个标记对抗病性有明确的QTL定位结果(表5)。利用这6个SSR标记共检测到抗白粉病、条锈病和叶锈病相关的10个QTL,涉及2A、3B、5B、5D等4条染色体,对表型贡献率为2%~4%,加性效应为-0.15~0.08,LOD值最大为10.40。其中,抗白粉病检测到2个QTL位点,分布在5A、3B染色体上,对表型贡献率均为2%,LOD值最大为6.70;抗条锈病检测到5个QTL位点,分布在2A、5A、3B、5D染色体上,对表型贡献率为2%~4%,LOD值最大为10.20;抗叶锈病检测到3个QTL位点,分布在5A、3B、5D染色体上,对表型贡献率为2%~4%,LOD值最大为10.40。同时,5A、3B染色体上均检测到抗白粉病、条锈病和叶锈病QTL,5D染色体上检测到抗条锈病、叶锈病QTL,这3条染色体存在抗病的QTL富集区。
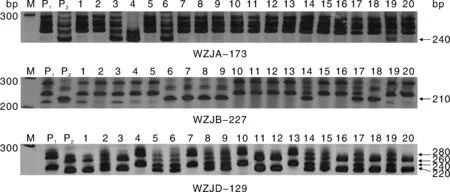
M, DL 2 000;P1,宁春4号;P2,河东乌麦;1~20,F2单株,其中,1~7、13~20为正交,8~12为反交。M, DL 2 000; P1, Ningchun No.4; P2, Hedong black wheat; 1-20, F2 individual plants, 1-7 and 13-20 were orthogonal cross, 8-12 were inverse cross.图2 三个分子标记在宁春4号与河东乌麦F2代部分单株中的扩增结果Fig.2 Amplification of 3 molecular markers on partial individual plants in F2 hybrids of Ningchun No.4 × Hedong black wheat
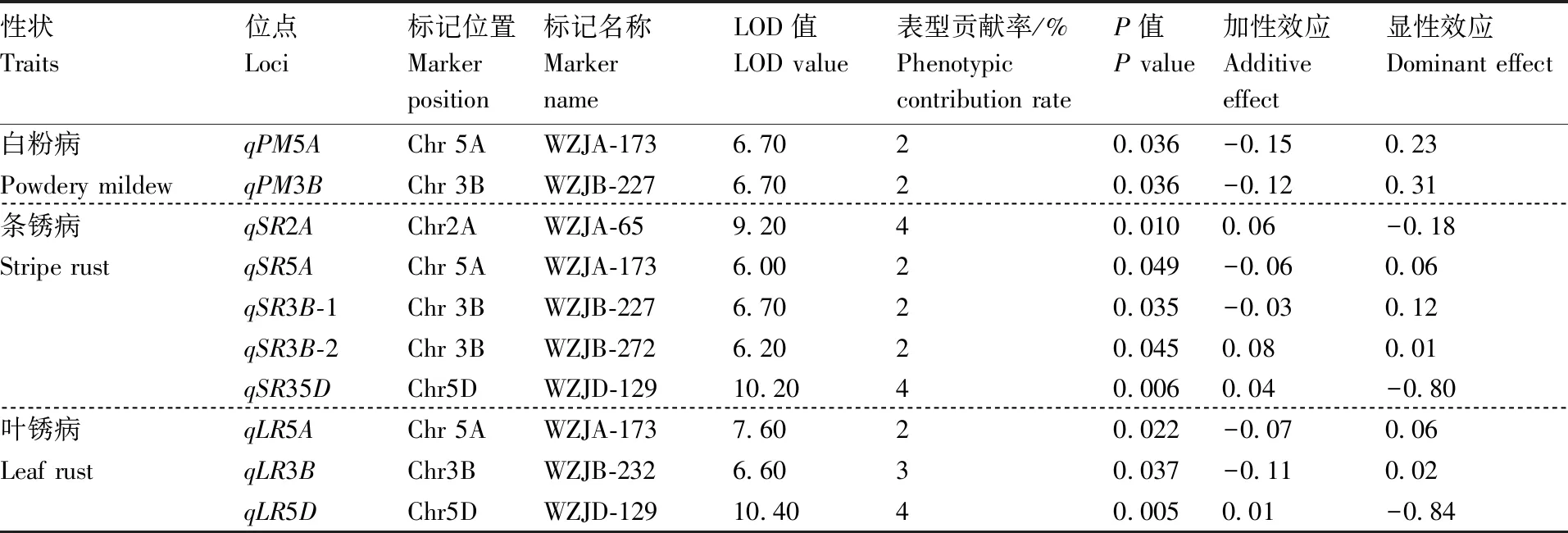
表5 宁春4号与河东乌麦杂交F2代抗病性QTL定位结果
3 结论与讨论
世界小麦主产区长期受到各种病害的威胁,虽然化学防治对小麦病害已取得一定的成效,但不仅浪费人力、物力和财力,而且会造成环境污染。因此,培育和推广抗病品种被公认为是安全、经济、有效的防治方法[42]。抗病基因大部分源于普通小麦,少部分源于近缘种、属。如抗白粉病基因Pm1(a-d)、Pm4(d-j)、Pm9、Pm10、Pm11、Pm14、Pm15、Pm18、Pm22、Pm23、Pm24、Pm28和Pm29等来源于普通小麦,Pm20来源于栽培黑麦[43],Pm12来源于拟斯卑尔脱山羊草[44],Pm21来源于簇毛麦[45-47]等。另外,已明确定位较多地抗小麦锈病基因,如Sr2、Lr27在3BS上[48],Lr37在7DS上[49],Lr20、Sr15、Sr22在7AL上[50]。抗病基因在不同时期不同程度地提高了小麦的抗病能力,所以,抗病品种的培育离不开抗性基因的挖掘[51]。同时,分子标记作为一种小麦抗病基因检测、发掘、聚合的有效技术被广泛应用,如:获得含有Lr10+Lr34、Lr24+Lr37+Lr38或Lr24+Lr38基因聚合的中间材料[32]、Pm21和Pm13聚合的材料[33],获得含有Pm8+Pm21、Pm2+Pm4b、Pm4a+Pm21的抗病材料[44],将YrSM139-1B和YrSM139-2D聚合到普通小麦品种陕麦139中[48]。本研究对宁春4号和河东乌麦进行连续2年成株期田间抗病性鉴定,宁春4号中感白粉病、中感条锈病和叶锈病,河东乌麦中抗至高抗白粉病、中抗条锈病和叶锈病,与前期研究结果一致[34-35]。对F2代331个单株进行抗病性鉴定,有68个单株抗白粉病、54个抗条锈病、52个抗叶锈病,其中,50个表现出同时抗白粉病和条锈病,44个抗白粉病和叶锈病,32个抗条锈病和叶锈病,29个表现出同时抗白粉病、条锈病和叶锈病。抗病性需要在发病充分的条件下,利用大群体进行多年多点鉴定,同时要进行单个生理小种鉴定,才能对资源的抗性和所用生理小种的毒性做出科学、可靠的评价。本研究在相同发病条件下,利用混合小种对F2群体进行单株鉴定,能够评价不同单株的抗病性,该结果具有一定参考依据,抗病单株也具有一定利用价值。
分别利用基因Pm16、Yr2和Lr24的等位基因标记Xgwm159-5B、WMC364和STS24-16,在F2代中检测到239个单株携带基因Pm16,202个单株携带基因Yr2,246个单株携带基因Lr24,148个单株携带基因Pm16和Yr2,185个单株携带基因Pm16和Lr24,155个单株携带基因Yr2和Lr24,119个单株携带上述3个基因,这一结果可为明确不同等位基因在群体中的分布提供理论依据。田间抗病分析发现,有22.59%携带基因Pm16的单株田间表现中抗至高抗白粉病,16.83%携带基因Yr2的单株表现中抗至高抗条锈病,17.07%携带基因Lr24的单株表现为中抗至高抗叶锈病,16.22%携带基因Pm16和Yr2的单株表现为抗白粉病和条锈病,16.76%携带基因Pm16和Lr24的单株表现为抗白粉病和叶锈病,11.61%携带基因Yr2和Lr24的单株表现为抗叶锈病和条锈病,10.92%携带这3个基因的单株同时表现为抗白粉病、条锈病和叶锈病。利用标记鉴定出携带不同抗性基因的单株中高达77.41%~89.08%表现为感病,这可能是由于这些基因的抗性降低或丧失,真正发挥抗病的是其他抗性基因。就这一问题作如下解释:(1)编号为010、065、093、150、152、218、237、240、242、268、275、279、292、311的14份材料表现为抗白粉病,而标记Xgwm159-5B无扩增结果;(2)编号为010、033、038、150、151、164、196、218、237、241、270、274、276、278、279、290、295、319、322、325的20份材料表现为抗条锈病,而标记WMC364无扩增结果;(3)编号为020、022、071、088、240、268、270、275、279、299的10份材料表现为抗叶锈病,而标记STS24-16无扩增结果;(4)编号为010、023、065、150、151、152、164、196、218、237、240、241、242、268、270、274、275、276、278、279、290、292、295、311、319、322、325的27份材料表现为抗白粉病和条锈病,而标记Xgwm159-5B和WMC364无扩增结果;(5)编号为020、065、071、093、218、240、242、268、270、275、279、292、311的13份材料表现为抗白粉病和叶锈病,而标记Xgwm159-5B和STS24-16无扩增结果;(6)编号为022、038、071、164、218、240、268、270、275、276、278、279、322、325的14份材料表现为抗条锈病和叶锈病,而标记WMC364和STS24-16无扩增结果;(7)编号为065、071、164、218、240、242、268、270、275、276、278、279、292、311、322、325的16份材料表现为抗白粉病、条锈病和叶锈病,而标记Xgwm159-5B、WMC364和STS24-16无扩增结果。
以上结果为进一步利用其他抗病基因标记和找新途径发掘抗病基因提供了启示。同时,需要选用能在育种上使用的标记作为分子标记辅助选择的功能型标记。随着分子标记研究工作不断深入,育种家可以利用分子标记发掘抗病QTL,以培育抗性品种,虽然小麦抗病性QTL定位研究很多,但是不同遗传背景下的QTL聚合到同一遗传背景存在诸多困难[52-55]。本研究利用新开发的6个SSR标记检测到10个QTL位点,LOD值最大为10.40,涉及2A、3B、5B、5D等4条染色体,加性效应为-0.15~0.08,对表型贡献率为2%~4%。5A、3B染色体上均检测到抗白粉病、条锈病和叶锈病QTL,5D染色体上检测到抗条锈病和叶锈病QTL,这3条染色体存在QTL富集区,可作为进一步研究的重点。因所用标记数目有限,抗白粉病仅检测到2个QTL位点,抗锈病共检测到8个QTL位点。今后,需开发高效的分子标记,通过构建密度较饱和的物理图谱,使得与抗病性相关的QTL(尤其是主效QTL)得以精细定位,为小麦抗病性QTL发掘、研究、利用奠定基础。
