TSH抑制治疗分化型甲状腺癌对骨密度影响的Meta分析
2019-05-20周菱杨玲蔡亮张蜀茂陈跃
周菱 杨玲 蔡亮 张蜀茂 陈跃
西南医科大学附属医院核医学科,泸州 646000
分化型甲状腺癌(differentiated thyroid carcinoma,DTC)是最常见的内分泌肿瘤,主要包括乳头状甲状腺癌和滤泡状甲状腺癌。近年来,其发病率呈明显上升趋势[1]。目前该病主要的治疗方法为外科手术、术后131I 治疗和TSH 抑制治疗。大部分DTC进展较缓慢,预后较好,约90%的患者在治疗后可存活15年以上[2]。常规TSH 能够维持术后正常的生理需要,但抑制剂量使患者处于亚临床甲状腺功能亢进(简称甲亢)。研究表明,亚临床甲亢会增加骨折和心血管疾病发生的风险[3-4]。目前,多项研究已报道TSH 抑制治疗DTC 对骨密度的影响[5-7],但各研究的样本量较小,对骨密度影响的结果各不相同,所得结论的参考价值有限。我们采用Meta分析系统地评价TSH 抑制治疗DTC 是否对骨密度有负面影响,以期为临床实践提供依据。
1 资料与方法
1.1 检索策略
计算机检索PubMed、Medline、万方数据库、中文科技期刊数据库(VIP)、中国学术期刊全文数据库、中国生物医学文献数据库,检索时间为各数据库建库起至2017年10月。中文检索词:“分化型甲状腺癌”、“促甲状腺激素抑制治疗”、“TSH抑制治疗”、“骨密度”;英文检索词:“differentiated thyroid gland carcinoma”、“DTC”、“TSH-suppressive therapy” 、 “ thyroxine suppressive therapy” 、“levothyroxine therapy”、“bone mineral density”,采用主题词加关键词相结合的方式进行检索,语种设定为中文、英文。
1.2 纳入标准与排除标准
纳入标准:①国内外发表的TSH 抑制治疗DTC 的横向研究、队列研究、前瞻性对照研究及病例对照研究;②抑制组为进行TSH 抑制治疗的DTC 患者,对照组为与抑制组患者年龄、性别、体重、月经情况相匹配的健康人群;③患者年龄>18 岁;④可以提供TSH 抑制治疗的时间;⑤患者的TSH 水平达到抑制目标;⑥能够提供相应研究数据。排除标准:①重复发表的研究;②无法获取摘要或全文的文献;③无法提取数据的研究;④非单一治疗的研究;⑤有与骨代谢相关疾病的病例;⑥有其他骨质疏松风险的病例;⑦患者使用糖皮质激素或其他可能影响骨代谢药物的研究。
1.3 数据提取与统计学分析
由2 位研究者分别进行独立筛选,若存在分歧讨论后仍不能决定时,由第3 位研究者共同讨论后确定。采用RevMan 5.3 统计软件对数据进行统计学分析,计数资料以比值比(OR)表示,计量资料以加权均数差或标准化均数差(standardized mean difference,SMD)表示。判断各研究结果间有无异质性,若无统计学异质性(P>0.10,I2≤50%),采用固定效应模型进行分析;反之,当有统计学异质性时,在排除明显异质性的影响后,采用随机效应模型分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 文献筛选结果
初步筛选出符合纳入标准的文献1475 篇,剔除重复文献后剩余829 篇,阅读题目和摘要后剩余41 篇,其中有12 篇无法提取数据,10 篇无法获取全文,4 篇非单一治疗,1 篇患者血清TSH 未达到抑制目标,最终纳入文献14 篇[5-18],共计588 例DTC 患者(表1)。
2.2 Meta 分析结果
2.2.1 腰椎骨密度
12 项研究报道了腰椎骨密度水平,共442 例DTC 患者[5-16]。各研究间有统计学异质性(P<0.0001,I2=71%),去除Kung 等[7]研究,异质性下降至51%,产生异质性的原因可能是其研究中患者均为绝经后女性。亚组分析显示,绝经后女性、绝经前女性、男性DTC 患者TSH 抑制治疗后腰椎骨密度与对照组比较,差异均无统计学意义[SMD=-0.00,95%CI(-0.26,0.26),P=0.98](图1)。

表1 TSH 抑制治疗分化型甲状腺癌对骨密度影响纳入文献的基本信息Table 1 Basic information of the included literature in the effect of TSH-suppressive therapy on bone mineral density in patients with DTC
2.2.2 股骨颈骨密度
8 项研究报道了股骨颈骨密度水平,共328 例DTC 患者[7,9,11-13,15-17]。各研究间有统计学异质性(P<0.00001,I2=95%)(图2中A),去除王勤甫等[17]的研究,异质性下降至76%(图2中B)。产生异质性的原因可能是其研究中TSH 抑制目标有差异。各研究间仍有统计学异质性,经亚组分析异质性明显降低(I2=31%),采用固定效应模型,其结果显示绝经后女性、绝经前女性、男性的股骨颈骨密度与对照组比较差异均无统计学意义[SMD=-0.00,95%CI(-0.15,0.14),P=0.96](图2中C)。
2.2.3 股骨大转子骨密度
4 项研究报道了股骨大转子骨密度水平,共137 例DTC 患者[5-7,12]。各研究间无统计学异质性(P=0.12,I2=49%),采用固定效应模型分析。Meta 分析结果显示,抑制治疗组患者股骨大转子骨密度水平低于对照组,差异有统计学意义[SMD=-0.30,95%CI(-0.53,-0.06),P=0.01](图3)。
2.2.4 Ward 三角区骨密度
3 项研究报道了Ward 三角区骨密度水平,共97 例DTC 患者[5,7,12]。各研究间无统计学异质性(P=0.52,I2=0%),采用固定效应模型分析。Meta 分析结果显示,抑制治疗组患者Ward 三角区骨密度水平低于对照组,差异有统计学意义[SMD=-0.35,95%CI(-0.63,-0.08),P=0.01](图4)。
2.3 灵敏度分析
剔除样本量<50 的研究,对腰椎、股骨颈骨密度灵敏度进行分析。腰椎为[SMD=-0.02,95%CI(-0.27,0.22),P=0.8]vs.[SMD=-0.12,95%CI(-0.37,0.13),P=0.33];股骨颈为[SMD=-0.48,95%CI(-1.22,0.26),P=0.2]vs.[SMD=-0.61,95%CI(-1.42,0.20),P=0.14]。剔除前后腰椎、股骨颈骨密度的统计学结果均未发生改变,这说明本研究结果总体较稳定。
3 讨论

图1 TSH 抑制治疗后腰椎骨密度与对照组比较的Meta 分析森林图 图中,[10](1)为绝经前的女性患者;[10](2)为男性患者。Fig.1 Forest plot of Meta-analysis of the comparison of the bone mineral density of lumbar between TSH-suppressive therapy group and control group
TSH 抑制治疗是指通过使用左旋甲状腺激素使TSH 处于低水平甚至检测不到[19],一方面可补充患者缺少的甲状腺激素,另一方面低水平的TSH对肿瘤细胞具有抑制作用,从而降低该病的复发率和病死率,其对DTC 的治疗价值已被证实[20-21]。近年来,TSH 抑制治疗的理念已发生了转变,对于TSH 抑制治疗及其抑制程度,各国临床指南尚未达成共识。美国甲状腺协会和欧洲甲状腺协会主要提倡根据DTC 患者肿瘤的复发危险度分级制定治疗目标[22-23]。我国指南主要强调双风险评估,即兼顾患者肿瘤的复发危险度分级和TSH 抑制治疗不良反应的风险[24]。2015年美国甲状腺协会建议将高危患者的TSH 控制在<0.1 mU/L,低危患者根据是否接受残留甲状腺去除治疗和其Tg 水平,建议他们将TSH 控制在略低于正常参考范围的下限(0.1~0.5 mU/L)或维持在正常参考范围下限(0.5~2.0 mU/L)。通过双风险评估后,无论TSH 抑制治疗的风险高低,均建议将高危复发患者的TSH 始终控制在<0.1 mU/L[25]。长期服用超生理需求量的左旋甲状腺激素会使甲状腺功能处于亚临床甲亢状态,其潜在的不良反应已经被关注。骨质疏松症主要表现为骨量减少,骨组织微细结构破坏,从而导致骨骼脆性增加,增加骨折风险。除了年龄、性别、钙和维生素D 以及甲状旁腺功能等因素影响骨密度[26],甲亢也是引起骨质疏松常见的高危因素之一[27],但目前对于使用左旋甲状腺激素引起的亚临床甲亢是否会引起骨量减少以及骨质疏松的发生尚没有明确定论[28-30]。本研究对14 项研究中的588 例DTC 患者进行系统评价,结果显示,TSH抑制治疗对DTC 患者不同部位骨密度的影响存在一定差异:①对所有患者腰椎骨密度无明显影响,这一结论与王玉等[31]研究结果一致;②对股骨大转子和Ward 三角区骨密度干扰较大。其原因可能是腰椎以松质骨为主[32],股骨以皮质骨为主[33]。皮质骨的破骨细胞活性高于松质骨,过量的甲状腺激素

图2 TSH 抑制治疗后股骨颈骨密度与对照组比较的Meta 分析森林图 图中,A:股骨颈骨密度水平总体森林图;B:剔除研究[17]后的森林图;C:亚组分析森林图。研究[10](1-1)为绝经前女性左侧股骨颈数据,[10](1-2)为绝经前女性右侧股骨颈数据,[10](2-1)为男性左侧股骨颈数据,[10](2-2)为男性右侧股骨颈数据。Fig.2 Forest plot of Meta-analysis of the comparison of the bone mineral density of femoral neck between TSH-suppressive therapy group and control group
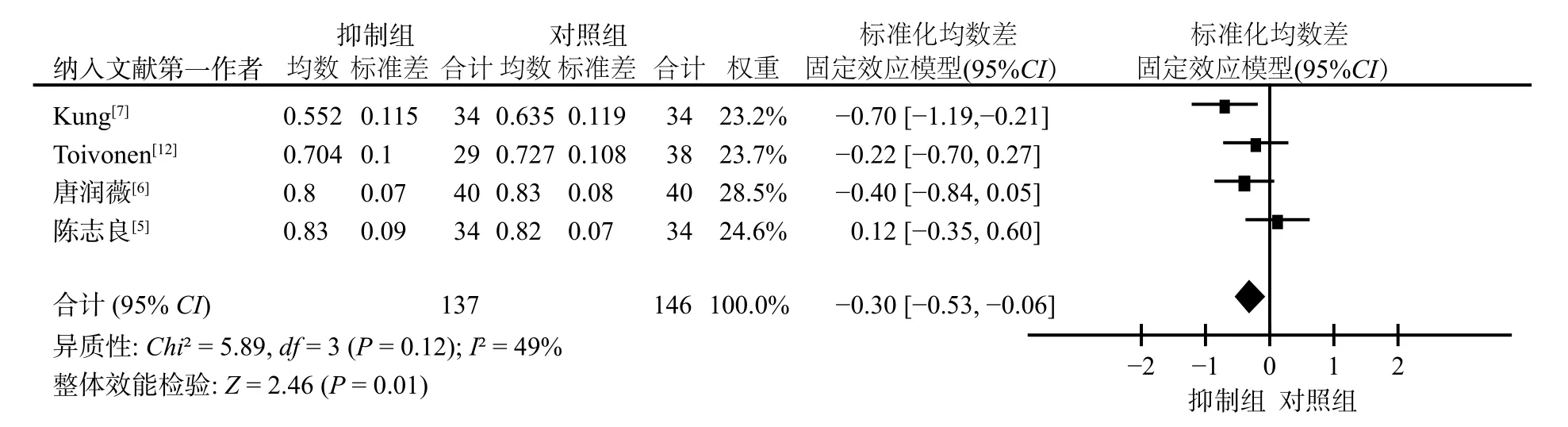
图3 TSH 抑制治疗后股骨大转子骨密度与对照组比较的Meta 分析森林图 Fig.3 Forest plot of Meta-analysis of the comparison of the bone mineral density of femoral trochanter between TSH-suppressive therapy group and control group

图4 TSH 抑制治疗后Ward 三角区骨密度与对照组比较的Meta 分析森林图 Fig.4 Forest plot of Meta-analysis of the comparison of the bone mineral density of Ward triangle between TSH-suppressive therapy group and control group
会增加破骨细胞活性,加之在成骨细胞和破骨细胞上TSH 受体均有表达,TSH 对骨代谢有直接的影响[34-35]。低TSH 可以降低对破骨细胞活性的抑制,最终导致骨量丢失,骨密度下降;再者股骨不同部位对骨密度改变的灵敏度不同,表现出的骨密度变化情况也有所不同,其中Ward 三角区是髋部几个测量点中最敏感的区域,目前已有文献报道Ward 三角区骨密度的改变早于腰椎和股骨颈[36]。
综上,本研究结果显示,TSH 抑制治疗主要降低DTC 患者股骨近端骨密度,提示患者在长期随访中应定期监测骨密度,特别需要注意股骨大转子及Ward 三角区处,以早期干预,预防骨质疏松的发生和发展。本研究的不足之处:①Meta 分析的结果易受纳入实验方法学的影响;②检索语种限定为中文、英文;③纳入研究在给药剂量、用药时间以及TSH 抑制目标方面不统一。这些因素均可能对结果有一定影响,因此本研究所得结果还需高质量的研究和证据做进一步证实。
