131I 诱导甲状腺功能减退大鼠主动脉内皮功能异常相关机制的研究
2019-05-20刘倩庞华刘影程刚
刘倩 庞华 周 静 刘影 程刚
1 核工业四一六医院·成都医学院第二附属医院核医学科 610000;2 重庆医科大学附属第一医院核医学科 400016
甲状腺功能减退症(简称甲减)是放射性131I治疗甲状腺功能亢进症(简称甲亢)时一个最主要的并发症。目前,131I 治疗甲亢已经有60 多年的历史,在欧美国家已成为了治疗成人甲亢的首选治疗方法,我国自1958年开始应用131I 治疗,近几年,131I 在治疗甲亢和甲状腺恶性肿瘤方面的优势逐渐被国内医师和患者所认可,较多医院选择将131I 治疗作为甲亢的首先治疗方式[1]。131I 治疗后容易发生甲减[2],其中131I 治疗甲亢后的甲减占了较大的比重,在青少年和儿童中的发生率甚至高达95%[3-5]。越来越多的证据表明,甲减对于心血管系统有严重影响,大大增加了心血管疾病的发生率。亚临床与明显的甲减都会引起心输出量降低、外周阻力增高和血管内皮功能受损[6],甲减与动脉粥样硬化关系密切[7],对心血管系统有重要影响。一氧化氮(nitric oxide,NO)作为一种能引起平滑肌细胞舒张的化合物,从多个方面参与调节心血管系统的功能。NO 主要由一氧化氮合酶(nitric oxide synthases,NOS)以L-精氨酸(L-arginine)为底物合成。NOS主要由内皮性一氧化氮合酶(eNOS)、诱生性一氧化氮合酶(iNOS)及神经性一氧化氮合酶(nNOS)3 种亚型构成,且均在心血管系统中扮演着重要的角色。因此,随着放射性131I 治疗甲亢的逐渐普及,131I 治疗后甲减发生率的逐渐增加,其对于心血管系统的影响不容忽视,所以对NO 的研究也进入了一个新时代[8]。
本实验用131I 诱导的大鼠甲减模型,研究甲减以及辐射对大鼠主动脉内皮功能异常中NO 的作用及其机制,以期寻找一个较为安全的131I 治疗剂量,为临床上预防131I 治疗甲亢所导致的甲减性心脏病提供新的思路。
1 材料与方法
1.1 试剂与仪器
大鼠TNF-α、IL-6、NO、NOS 酶活性相关酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒均购于南京建成生物工程研究所有限公司;iNOS、eNOS、nNOS 抗体均购于南京建成生物工程研究所有限公司。大鼠抗NOS 酶单克隆抗体和抗辣根过氧化物酶标记的二抗均购于北京中山金桥生物技术有限公司。T3、T4、TSH 试剂盒均购于北京杰辉博高生物技术有限公司。4℃低温高速Legend Micro 17R 离心机(德国IKA 公司)、Synersy HT 酶标仪(美国BioRod 公司)均由重庆医科大学生命科学研究院提供。
1.2 材料
4~6 周龄健康雄性SD 大鼠[(200±10)g]45 只,购于重庆医科大学动物实验中心,饲养等级为IVC 级别,许可证号:SYXK(渝)2018-0003。
1.3 方法
1.3.1131I 诱导甲减大鼠模型的建立
分别将2.775、5.550、11.100、16.650 MBq 的131I+0.5 mL 生理盐水腹腔注射至健康雄性SD 大鼠中,构建大鼠甲减模型,每组9 只,共36 只。剩余9 只雄性SD 大鼠作为正常对照组,只注射0.5 mL生理盐水,同条件下饲养。
1.3.2 免疫分析法检测血清中游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)和TSH 的水平
将不同剂量组和对照组的大鼠分别在给药后第4、8、16 周时主动脉取血后处死,每次每组3 只,每只取血2 管,每管2 mL。离心10 min(离心力17 000×g,4500 转/min)后,取血清。然后根据试剂盒说明,分别检测每只大鼠的血清FT3、FT4和TSH 水平,其中,FT3、FT4水平用放射免疫法测定,TSH 水平用ELISA 试剂盒测定。根据血清激素及体质量结果选取最佳剂量组,进行后续研究。
1.3.3 ELISA 法检测大鼠血清中NO、TNF-α 和IL-6水平
最佳剂量组及正常对照组大鼠分别在给药后第4、8、16 周时主动脉取血处死,每组3 只,每只取血2 管,每管2 mL,离心10 min(离心力17 000×g,4500 转/min)后,提取血清。根据ELISA试剂盒操作说明检测NO、TNF-α、IL-6 水平,TNF-α 和IL-6 水平于酶标仪A450 nm 处读数,NO活性于A550 nm 处读数。
1.3.4 大鼠主动脉NOS 酶活性的检测
最佳剂量组及正常对照组大鼠分别在给药后第4、8、16 周时取血处死后剥离主动脉,于-80℃环境中保存。将剥离出的主动脉用研钵研碎,加入生理盐水,混合成10%组织匀浆,离心10 min 后(离心力17 000×g,2500 转/min),取上清,采用蛋白浓度检测法测定主动脉组织蛋白浓度,根据ELISA试剂盒操作说明检测NOS酶活性,并于酶标仪A530 nm 处读数。
1.3.5 Western-blotting 检测主动脉标本eNOS、nNOS 与iNOS 蛋白水平表达
取上一步骤中剥离的主动脉,提取总蛋白,使总蛋白变性,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE 电泳),转移到聚偏氟乙烯膜。在室温下振荡孵育1 h。随后,该膜在稀释浓度为1∶1000 的nNOS、eNOS、iNOS 一抗作用下4°C孵育过夜。膜清洗后在1∶5000 抗辣根过氧化物酶标记的二抗作用下室温孵育1 h。3,3',5,5'-四甲基联苯胺(TMB)染色,显影。
1.4 统计学分析
使用SPSS 22.0 软件对实验数据进行分析。计量资料均采用±s表示,符合正态分布和方差齐性,组间两两比较采用t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 不同剂量组大鼠血清的FT3、FT4、TSH 水平
由表1可知,正常对照组与2.775 MBq 剂量组间甲状腺功能差异无统计学意义(FT3:t=1.547~1.615,均P>0.05;FT4:t=2.014~2.103,均P>0.05;TSH:t=1.254~1.528,均P>0.05)。在其他组,与正常对照组比较随着剂量的增加,血清FT3、FT4水平逐渐下降,差异均有统计学意义(FT3:t=5.324~14.210,均P<0.05;FT4:t=5.017~13.587,均P<0.05);另外,随着剂量的增加血清TSH 浓度在各时间点逐渐升高,且差异均具有统计学意义(t=5.214~20.369,P<0.05)。同时,结合各剂量组的不同时间点大鼠的体质量数据(表2)可知,除2.775 MBq 剂量组外,与正常对照组相比,其余3 组大鼠的体质量变化均有统计学意义(t=1.987~13.542,均P<0.05),说明甲减模型构建成功,且5.550 MBq 组作为放射性131I 治疗的剂量是较为合适的,故选取5.550 MBq 组大鼠进行接下来的研究。
表1 不同剂量131I 诱导的SD 大鼠模型在不同时间的甲状腺功能检测结果(每组n=3, ±s)Table 1 Thyroid function of treated rats at different doses of 131I (each group n=3,±s)

表1 不同剂量131I 诱导的SD 大鼠模型在不同时间的甲状腺功能检测结果(每组n=3, ±s)Table 1 Thyroid function of treated rats at different doses of 131I (each group n=3,±s)
注:表中,*:与正常对照组比较,差异均有统计学意义(t=5.017~20.369,均P<0.05)。FT3:游离三碘甲腺原氨酸;FT4:游离甲状腺素;TSH:促甲状腺激素。
组别 FT3(ng/mL) FT4(pmol/L) TSH(mIU/L)正常对照组 4周 1.17±0.11 13.36±0.28 7.65±0.32 8周 1.22±0.11 13.36±0.50 8.03±0.83 16周 1.17±0.12 13.47±0.54 8.31±0.23 2.775 MBq组 4周 1.02±0.30 12.55±1.01 9.02±0.58 8周 1.25±0.82 12.41±0.98 8.43±1.56 16周 1.10±0.14 12.52±0.83 8.56±0.23 5.550 MBq组 4周 0.79±0.03* 9.87±2.21* 16.01±2.02* 8周 0.64±0.15* 6.99±1.05* 19.02±2.25* 16周 0.58±0.15* 6.05±0.44* 20.61±0.79*11.100 MBq组 4周 0.53±0.70* 7.77±0.93* 19.08±4.01* 8周 0.31±0.09* 6.25±1.31* 21.87±0.56* 16周 0.30±0.01* 5.29±0.42* 22.52±2.58*16.650 MBq组 4周 0.42±0.04* 5.54±1.22* 21.51±2.20* 8周 0.30±0.02* 4.87±0.10* 23.46±1.22* 16周 0.26±0.05* 5.25±0.16* 23.82±4.25*
2.2 ELISA 法检测5.550 MBq 剂量组甲减大鼠血清中NO、TNF-α、IL-6 水平的结果
图1和图2显示甲减大鼠在使用5.550 MBq131I 治疗时血清中的TNF-α 和IL-6 的表达水平。TNF-α 水平在第4、8、16 周时分别为1441.23、1601.85、1521.51 pg/mL,与正常对照组相比,差异均有统计学意义(t=21.021、17.578、14.498,均P<0.05),其中在第8、16 周时的TNF-α 水平高于第4 周。血清中IL-6 水平在第4、8、16 周时分别为209.23、291.87、302.97 pg/mL,与正常对照组比较,IL-6 水平在第4 周时差异无统计学意义(t=2.825,P>0.05),在第8、16 周时,差异均有统计学意义(t=8.841、14.224,均P<0.05)。图3显示,与正常对照组相比,5.550 MBq 剂量组血清NO 水平在第4 周时水平高于正常对照组,差异有统计学意义(t=31.014,P<0.05),而在第8 周(t=4.214,P>0.05)和第16 周(t=7.014,P<0.05)时均有所下降。
表2 不同剂量组各个时间点131I 诱导的SD 大鼠体质量(每组n=3, ±s)Table 2 Body weight of treated rats at different doses of 131I at different time (each group n=3,±s)

表2 不同剂量组各个时间点131I 诱导的SD 大鼠体质量(每组n=3, ±s)Table 2 Body weight of treated rats at different doses of 131I at different time (each group n=3,±s)
注:表中,*:与正常对照组比较,差异均有统计学意义(t=1.987~13.542,均P<0.05)。
组别 大鼠体质量(g)4周 8周 16周正常对照组 211.33±10.21 325.23±15.07 304.76±19.01 2.775 MBq组 218.67±11.03 331.33±16.20 404.00±17.28 5.550 MBq组 304.76±19.01* 415.25±22.01* 513.31±9.89*11.100 MBq组 189.67±11.58* 207.67±16.91* 209.04±6.55*16.650 MBq组 192.54±12.48* 217.67±16.07* 211.96±10.04*

图1 5.550 MBq 剂量组甲减SD 大鼠与正常对照组SD 大鼠在不同时间的TNF-α 水平 图中,TNF-α:肿瘤坏死因子-α;*:与正常对照组比较,差异均有统计学意义(t4w=21.021、t8w=17.578、t16w=14.498,均P<0.05)。Fig.1 The content of TNF-α in serumat at different time in hypothyroid rats treated with 5.550 MBq 131I versus normal group
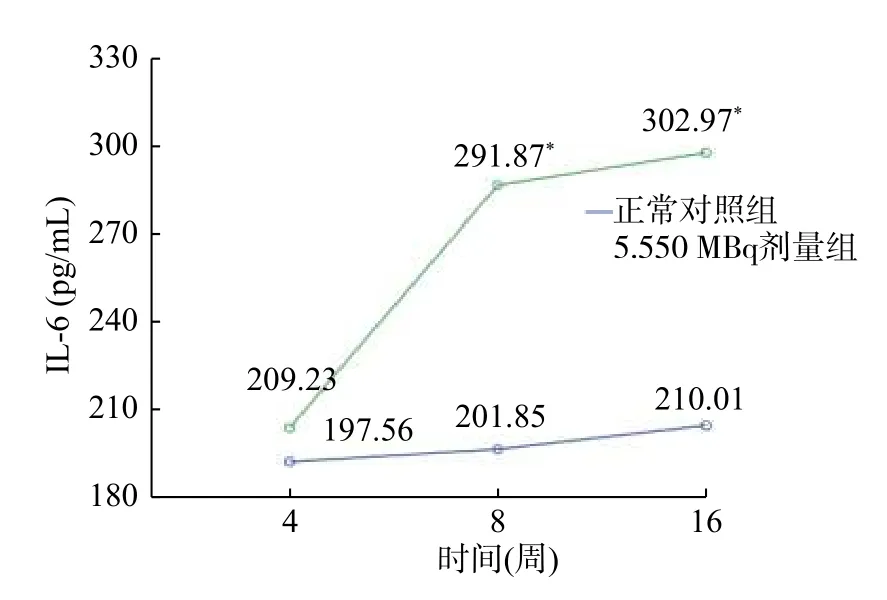
图2 5.550 MBq 剂量组甲减SD 大鼠与正常对照组SD 大鼠不同时间点的IL-6 水平 图中,IL-6:白细胞介素6;*:与正常对照组比较,差异均有统计学意义(t8w=8.841、t16w=14.224,均P<0.05)。Fig.2 The content of IL-6 in serumat at different time in hypothyroid rats treated with 5.550 MBq 131I versus normal group
2.3 不同时间点5.550 MBq 剂量组甲减大鼠主动脉NOS 酶活性结果

图3 5.550 MBq 剂量组甲减SD 大鼠与正常对照组SD 大鼠在不同时间的NO 水平 图中,NO:一氧化氮;*:与正常对照组比较,差异均有统计学意义(t4w=31.014,t16w=7.014,均P<0.05)。Fig.3 The levels of NO in serum at different time in hypothyroid rats treated with 5.550 MBq 131I versus normal group.
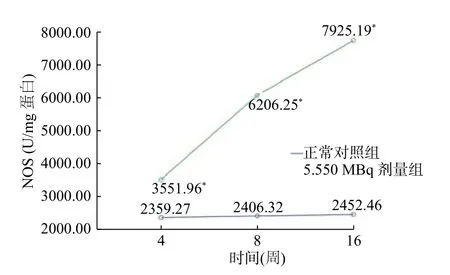
图4 5.550 MBq 剂量组甲减大鼠与正常组SD 大鼠在不同时间的NOS 活性 图中,NOS:一氧化氮合酶;*:与正常对照组比较,差异有统计学意义(t4w=5.089、t8w=9.672、t16w=13.394,均P<0.05)。Fig.4 Total-NOS activity in aorta in hypothyroid rats treated with 5.550 MBq 131I versus normal group
由图4可知,5.550 MBq 剂量组甲减大鼠的主动脉内皮总NOS 活性随时间的延迟持续升高,与正常组相比,差异均有统计学意义(t4w=5.089、t8w=9.672、t16w=13.394,均P<0.05)。
2.4 Western-blotting 检测5.550 MBq 剂量组甲减大鼠主动脉标本eNOS、nNOS 与iNOS 蛋白水平表达的结果
5.550 MBq剂量组甲减大鼠的Western-blotting分析结果见图5。eNOS 在不同时间点的表达量为25 985、16 306、6248,与正常对照组相比,eNOS蛋白水平明显降低,但是在第4 周的差异无统计学意义(t4w=3.546,P>0.05;t8w=8.841,t16w=14.224,均P<0.05)。nNOS 表达量为24 562、36 114、58 211,nNOS 蛋白水平在第4 周时下降,但在第8、16 周时逐渐增加,差异有统计学意义(t=5.751、7.251,均P<0.05)。在各个时间点,iNOS 表达量为55 973、50 575、62 364,蛋白表达水平均较正常对照组明显增加,差异均有统计学意义(t4w=21.017、t8w=16.412、t16w=24.981,均P<0.05)。
3 讨论

图5 Western blotting 检测5.550 MBq 剂量组甲减大鼠与正常对照组SD 大鼠在不同时间的NOS 蛋白表达对比图 图中,eNOS:内皮型一氧化氮合酶;iNOS:诱导型一氧化氮合酶;nNOS:神经型一氧化氮合酶;*:与正常对照组比较,差异均有统计学意义(eNOS:8w=8.841、t16w=14.224,均P<0.05;nNOS:t8w=5.751、t16w=7.251,均P<0.05;iNOS:t4w=21.017、t8w=16.412、t16w=24.981,均P<0.05)。Fig.5 Western-blotting detection of eNOS,nNOS and iNOS protein levels in aorta in hypothyroid rats treated with 5.550 MBq 131I versus normal group
Furchgott 和Zawadzki[9]最早发现当血管内皮受到刺激时,会释放一种血管活性物质,当时命名为内皮源性舒张因子(endothelium-derived relaxing factor,EDRF)。数年后,Ignarro 等[10]的研究证实EDRF 就是NO。之后在对NO 的研究中证实,其是最重要的一种血管舒张因子,生物半衰期只有4~8 s,能够调节血管张力,参与抗氧化、抗炎症、抗凝血,增强纤溶活性,具有抑制白细胞黏附和迁移,抑制平滑肌细胞迁移和增殖,以及抑制血小板聚集和黏附等功能。NO 合酶亚型主要有以下3 种:eNOS 主要存在于内皮细胞中;nNOS 在神经系统中广泛存在;iNOS 则存在于免疫细胞中,如单核细胞和巨噬细胞。eNOS和nNOS 被称为组织性一氧化氮合酶(constitutive NOS,cNOS),能产生少量NO,可作为细胞信号分子。iNOS 在异常情况下表达,比如心衰、炎症时由细胞内抗原、某些肿瘤细胞或微生物产物诱导产生大量NO。NO 生物活性下降主要来自于两方面的原因:一方面是NOS 的活性下降,合成NO 减少,二是各种氧化应激导致NO 降解加速[11]。现在的观点认为:nNOS 除了存在于神经系统中,还存在于平滑肌和骨骼肌中;eNOS 存在于平滑肌和血小板中;iNOS 存在于平滑肌以及肝脏中,其在生理条件下也有适量表达[8]。这3 种NOS 能够在心肌细胞中表达,且均在心血管系统中扮演着重要的角色,张陆燕[12]认为TSH 增高可能会刺激血管内皮细胞eNOS 低水平表达,这可能会促进动脉粥样硬化的发生和发展。陈刚等[13]研究发现冠心病患者中有35.29%合并亚临床甲减。故本实验探求131I 治疗甲亢所导致的甲减以及辐射对于大鼠主动脉内皮功能异常中的相关机制,从而探索临床上131I 治疗甲亢的一个较为安全的剂量。
在以往的研究中,大多采用内科抗甲状腺药物喂养大鼠,抑制甲状腺激素合成的关键酶,建立慢性甲减模型[14-16],少数则应用外科切除大鼠甲状腺建立急性甲减模型[17]。而131I 诱导的甲减模型与临床上放射性131I 治疗甲亢后甲减类似,也属于慢性甲减,故本实验采用此方法构建甲减模型。有文献报道,131I 剂量从2.775~16.650 MBq不等,而比较有效的剂量是2.775~10.249 MBq[18]。本研究中,从对不同时间点各剂量组大鼠的称重结果可以看出,2.775 MBq 剂量组大鼠与正常对照组大鼠体质量增长不明显,5.550 MBq 剂量组体质量增加明显,然而11.100、16.650 MBq 两组大鼠体质量反而呈现下降趋势,我们考虑可能是由于131I 剂量过大而导致TSH 急剧增高,从而使大鼠甲状腺激素分泌不足呈现出呆小症的表现,因此,我们认为5.550 MBq 可能是一个最佳的治疗剂量。5.550 MBq剂量组的大鼠血清中,IL-6 和TNF-α 水平在各时间点均高于正常值。TNF-α 水平在不同时间点与正常对照组比较差异均有统计学意义,其中在第8、16 周时差异较为明显。除第4 周外,其余时间点的甲减大鼠血清中NO 水平均较低,在第8、16 周时明显下降。主动脉NOS 活性检测中,甲减组eNOS 蛋白水平与正常对照组相比明显降低;nNOS 蛋白水平在第4 周时下降,然后在第8、16 周时逐渐增加;在各个时间点,iNOS 蛋白表达水平与正常对照组相比明显增加。故本研究所得最佳剂量为5.550 MBq,与相关文献报道相符。而大剂量的131I 可能会刺激合成甲状腺激素减少,在这个过程中会导致甲减而影响血管内皮NOS基因及蛋白表达,从而对心血管系统产生影响。
有研究结果表明,甲减患者的NO 会呈现低水平表达[19-20],他们认为亚临床甲减可导致患者血管内皮损伤并加重炎症反应,从而增加患心血管疾病的风险。然而在本研究中,第4 周时NO 的水平显著增高,考虑其原因可能是131I 所致的放射性损伤,因为在注射后1 个月内,131I 在体内的效果较强,随后才逐渐弱化。本研究中最佳剂量组即5.550 MBq 组表现出了较低的血清NO 水平和较高的主动脉NOS 活性,与文献报道相符[21],但是也有研究结果与本研究结果相反[22],如有学者提出辐射可以提高甲减患者的NO 水平[23-25]。然而,目前只有少数文献报道采用Western blot 对主动脉eNOS、nNOS 和iNOS 进行研究。本研究发现甲减大鼠主动脉内皮型出现NOS 的水平降低,这与已有研究结果一致[26];不过,Sarati 等[21]研究发现,主动脉iNOS、eNOS 和nNOS 表达水平均不同于本研究,而且McAllister 等[15]观察到了与本研究相反的nNOS 蛋白表达情况。导致这种差异的原因可能是在动物和实验方法的选择上不同,致使所得到的NO 水平及NOS 活性也不尽相同。由于目前有关甲减所导致的NO 水平和NOS 活性变化等相关问题仍存在争议,因此,进一步了解131I 治疗后甲减影响心血管系统的机制是十分必要的,而且目前相关研究文献很少,故本研究通过对甲减大鼠主动脉内皮中NO 水平及NOS活性进行研究后发现最佳剂量为5.550 MBq,大剂量的131I 可能会刺激合成甲状腺激素减少,从而导致甲减最终影响其血管内皮NOS基因及蛋白表达,进而对心血管系统产生影响。
