Notch信号通路小分子抑制剂DAPT的11C标记及在正常兔体内的初步动态显像研究
2019-05-20张姝靳晓娜党永红霍力李方
张姝 靳晓娜 党永红 霍力 李方
中国医学科学院北京协和医学院北京协和医院核医学科,北京市核医学分子靶向诊治重点实验室 100730
Notch 信号通路是一种普遍存在于从果蝇到哺乳动物等众多生命体中具有高度保守性的关键信号通路,其功能是参与细胞发育、增殖、分化、凋亡、黏附及器官发育。Notch 信号通路是 由Notch 受 体、Notch 配 体 和CSL(CBF-1、suppressor of hairless、Lag 的 合 称)-DNA 结 合 蛋白3 部分组成。Notch 受体和配体均在细胞膜上表达。Notch 受体胞外区是配体结合并激活Notch 受体的部位,Notch 受体胞内区(Notch intracellular domain,NICD)为其活性成分,未成熟的Notch 受体与邻近细胞配体结合后被激活,经过3 次裂解产生活性成分NICD。而关键的裂解发生在S3 位点,即由γ 分泌酶介导的切割作用而产生NICD。当NICD 进入核内后,激活下游靶基因的转录。近年来,许多研究结果发现Notch 信号通路失调与包括胰腺癌在内的多种肿瘤的发生、发展过程密切相关,在这些肿瘤中发现Notch 通路持续活化[1-5]。(3,5-二氟苯乙酰基)-L-丙氨酰基-S-苯基甘氨酸叔丁酯(N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester,DAPT)是一种γ 分泌酶抑制剂,能够通过阻断Notch 信号通路,抑制肿瘤细胞的生长、转移和侵袭[6-7]。本研究以DAPT 为前体进行体外细胞学实验,合成11C-N-甲基-DAPT(简称11C-DAPT),初步研究其在正常新西兰兔体内的动态分布,为进一步开展此类肿瘤特异性显像剂的转化研究及指导同类肿瘤分子靶向药物的治疗奠定基础、提供依据。
1 材料与方法
1.1 试剂与仪器
人胰腺癌细胞株MiaPaCa-2 由德国海德堡大学Freiss.H 教授惠赠。DMEM 培养液、胎牛血清、胰蛋白酶、PBS 均购自美国Hyclone 公司;DAPT购自美国Selleck 公司;二甲基亚砜购自美国Sigma/Aldrich 公司。NucleoCounter NC-100 型全自动细胞计数仪购自丹麦chemometec 公司;Sep-Pak QMA SPE 分离柱购自美国Waters 公司。使用美国GE 公司的MINItrace Ⅱ回旋加速器、TRACERlab FXC Pro 合成模块和Elite PET/CT。
1.2 实验动物
普通级雄性新西兰兔1 只,3月龄,体质量3 kg,许可证编号:SYXK(京,2015-0025)。
1.3 方法
1.3.1 细胞计数Kit-8(简称CCK-8)法检测DAPT和CH3-DAPT 对胰腺癌细胞增殖的影响
人胰腺癌细胞株MiaPaCa-2 培养于DMEM 培养液(加10%胎牛血清),在37℃、5% CO2培养箱中传代3 代以上进行实验。经传代后的人胰腺癌细胞株MiaPaCa-2 用0.25%胰酶进行消化,用DMEM 培养液制成单个细胞悬液,用全自动细胞计数仪计数,调整细胞浓度至3×104个/mL,接种于96 孔培养板,每孔体积100 μL。在37℃ 5%CO2培养箱中培养24 h,待细胞贴壁后,吸出培养液,分别加入不同浓度梯度的DAPT(30、45、60、70、80、90、 120 μmol/L)和CH3-DAPT(10、20、40、80、120、160、200 μmol/L)溶液,二者均溶于DMEM 培养液。同时设置对照组和空白组,对照组加入相同体积的DMEM 培养液,空白组无细胞只加培养液。DAPT 和CH3-DAPT(实验组)均设5 个复孔。37℃ 5% CO2培养箱中培养72 h。CCK-8 法测定每组各孔的光密度(optical density,OD)值。

使用SPSS19.0 软件对数据进行logit 回归分析,并计算半抑制浓度(half maximal inhibitory concentration,IC50)
1.3.2 自动化合成11C-DAPT
回旋加速器生产11C-CO2,在全自动合成仪上经H2还原得到11C-CH4,11C-CH4与I2反应生成11C-CH3I 后转入反应瓶;2 mg 前体DAPT 溶于0.4 mL二甲基亚砜,预先置于反应瓶中,加入7 μL 5 mol/L NaOH ,充分振荡混匀。11C-CH3I 与DAPT 混合,标记反应80℃,反应时间3 min,洗脱液终止反应,降温冷却至35°C。产物使用高效液相色谱(high performance liquid chromatography,HPLC)仪进行分离纯化(C18柱,洗脱液300 mL 30%乙醇,流速2.5 mL/min,紫外线254 nm),收集产物,生理盐水稀释,无菌滤膜过滤待用。11C-DAPT 的合成路线见图1。
1.3.3 正常兔11C-DAPT PET/CT 显像
新西兰兔1 只,耳缘静脉注射125.8 MBq(3.4 mCi)11C-DAPT 后用PET/CT 进行动态扫描,0、7、14、21、28 min 各 采 集1 次,共5 次。CT 扫描参数:电压120 kV,电流150 mA,层厚5 mm;PET 扫描参数:1 min/床位,共4 个床位。扫描结束后,对原始图像采用OSEM 图像重建技术进行重建。获得CT、PET 及二者融合图像。在主要脏器勾画ROI,测量放射性浓度(kBq/mL)及其随时间的变化。
2 结果
2.1 不同浓度DAPT 和CH3-DAPT 对胰腺癌细胞
MIAPaCa-2 增殖的影响
CCK-8 法检测结果显示,DAPT 和CH3-DAPT对胰腺癌细胞株MIAPaCa-2 增殖的抑制作用呈剂量依赖关系。DAPT 和CH3-DAPT 作用于胰腺癌细胞株MiaPaCa-2 后72 h,细胞增殖的IC50分别为64.2 μmol/L 和180.0 μmol/L。
2.2 11C-DAPT 的鉴定结果
11C-DAPT 整个合成过程大约30 min,放射化学产率25%~35%(未校正,3 次重复试验),放射化学纯度>95%。HPLC 检测11C-DAPT 与12C-DAPT标准品保留时间一致,大约在5.3 min 时(图2、3)。
2.3 11C-DAPT 在正常兔体内的分布
兔注射11C-DAPT 后,体内吸收迅速,以肾脏分布较多,肝脏、肠道、肺、脑等脏器摄取较低。7 min 时肝脏、肾脏摄取达到高峰,28 min 后降低>50%(表1)。注射后即刻扫描,肠道、脑及肺的放射性摄取达到高峰,随时间延长逐渐降低。0~21 min,随时间延长,膀胱的放射性摄取逐渐增高。兔喉部前方可见放射性摄取增高组织,且随时间延长摄取逐渐降低,但受PET/CT 分辨率的影响,无法明确具体器官来源。图4和图5显示注射11C-DAPT 后正常兔的PET/CT 图像。
3 讨论
近年来有研究结果发现,多种恶性肿瘤的发生、发展与持续活化Notch 信号通路相关[8]。另外,Notch 信号通路能够促进癌症干细胞的形成和上皮间质转化,并与肿瘤耐药性密切相关,通过药物性阻断该通道能够抑制肿瘤的生长、克服化疗药物耐药性[9-11]。Notch 信号通路药物性阻断剂包括单克隆抗体、γ 分泌酶抑制剂、小分子干扰RNA和天然化合物。其中γ 分泌酶抑制剂靶向药为目前最被广泛及深入研究的Notch 信号通路药物性阻断剂,包括RO4929097、MK-0752 和DAPT等[11-12]。

图1 11C-(3,5-二氟苯乙酰基)-L-丙氨酰基-S-苯基甘氨酸叔丁酯(DAPT)的合成路线图 Fig.1 Radiosynthetic route of 11C-N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester(DAPT)
胰腺癌为消化系统较常见的恶性肿瘤,5年生存率低于5%[13]。胰腺癌对放化疗不敏感,目前手术是治疗胰腺癌最有效手段,大约60%的胰腺癌患者在确诊时已发生远处转移,25%为局部晚期患者,且不能进行根治切除术[14]。因此,寻找和建立早发现、早诊断的方法,开发靶向治疗药物,成为提高胰腺癌诊疗效果的主攻方向之一。临床前研究结果证实,DAPT 能够抑制胰腺癌细胞的生长、促进凋亡,与化疗药物联合使用可以提高化疗效果[6-7,15]。本研究观察了不同浓度的DAPT 对人胰腺癌细胞系MiaPaca-2 增殖的影响,结果发现DAPT 对该细胞株增殖的抑制作用呈剂量依赖性关系,与杜潇等[6]研究结果一致;同时使用CH3-DAPT 作 用 于MiaPaca-2 细胞,结果表明其对该细胞株的增殖亦有抑制作用。虽然CH3-DAPT 的抑制作用弱于DAPT,但说明CH3-DAPT 未改变DAPT 的生物学特性,仍可作用于胰腺癌细胞,发挥抑制增殖作用,为11C-DAPT 作为分子探针进行胰腺癌的显像提供了理论依据。
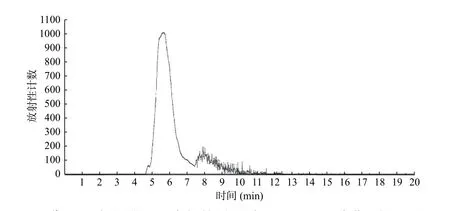
图2 12C-DAPT 标准品的HPLC 保留时间图 图中,DAPT:(3,5-二氟苯乙酰基)-L-丙氨酰基-S-苯基甘氨酸叔丁酯;HPLC:高效液相色谱。 Fig.2 Retention time of reference substance 12C-N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester(DAPT) in analytic HPLC

图3 11C-DAPT HPLC 纯化后的保留时间图 图中,DAPT:(3,5-二氟苯乙酰基)-L-丙氨酰基-S-苯基甘氨酸叔丁酯;HPLC:高效液相色谱。 Fig.3 Retention time of 11C-N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine tbutyl ester(DAPT) purified by preparative HPLC
表1 11C-DAPT 在正常新西兰兔体内的生物学分布( ±s,n=1)Table 1 Biodistribution of 11C-N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester(DAPT) in normal New Zealand rabbit

表1 11C-DAPT 在正常新西兰兔体内的生物学分布( ±s,n=1)Table 1 Biodistribution of 11C-N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester(DAPT) in normal New Zealand rabbit
注:表中,DAPT:(3,5-二氟苯乙酰基)-L-丙氨酰基-S-苯基甘氨酸叔丁酯;ROI:感兴趣区。
组织 ROI 的放射性浓度 (kBq/mL)0 min 7 min 14 min 21 min 28 min脑 38.3±1.53 26.6±0.58 23.3±0.58 16.0±1.00 14.0±0.00肺 40.6±2.52 28.3±2.08 20.0±2.64 12.6±1.52 12.3±0.58肝脏 57.0±1.73 66.7±0.58 50.3±0.58 45.3±1.57 30.0±1.00肠道 43.3±3.51 35.0±3.00 27.3±1.53 21.3±1.53 16.7±0.58肾脏 83.7±3.06 123.6±5.69 75.3±2.31 65.0±2.65 51.6±3.06膀胱 2.3±0.58 3.3±1.15 29.7±0.58 60.0±0.00 49.7±0.58
11C 标记的分子探针通常是将11C-CH3标记到有机化合物中,是PET 放射性药物合成的重要手段之一。本研究使用11C 标记DAPT,不会引起原生物分子化学性质的变化,而且方法灵活、过程简单。查阅国内外相关文献,未见关于Notch 信号通路抑制剂分子探针的报道,考虑到DAPT 具有3 个甲基化取代位点,更容易被标记,所以选择以DAPT 作为前体,整个合成过程由合成器自动完成,经过多次实验、分析,发现将淋洗液乙醇浓度调整为30%时,合成效率为25%~30%,放射化学纯度大于95%。整个合成过程简单、快速,放射化学纯度高。本研究的分布实验结果显示,注射11C-DAPT后药物快速分布于各脏器,在肾脏摄取最多,肝脏摄取较少,肠道、脑和肺摄取低。在7 min 时肝脏和肾脏放射性浓聚达到高峰,28 min 时降低>50%。而膀胱内放射性摄取随时间的增加逐渐增多,这说明11C-DAPT 主要通过肾脏排泄,在体内清除快。胰腺和脾脏因体积较小,且与邻近肠道组织难以区分,勾画ROI 较困难,未测量放射性浓度。但是从图像观察,除了肾脏,腹腔内其他脏器放射性摄取较低,具有较低的本底,为进行胰腺病变的研究奠定了基础。另外,本研究还发现喉部前方软组织内可见较高的放射性摄取,随时间延长逐渐降低,通过PET/CT 大体的定位,考虑为颌下腺的可能性大,并且文献报道Notch 信号通路调节唾液腺的发育以及再生,Notch1~4 受体在唾液腺细胞表面均有表达[16-17]。在后续的实验中,将用小鼠做离体测量,通过测量各器官(包括胰腺、脾脏、颌下腺等)的放射性计数,进一步明确11C-DAPT 的生物学分布。
综上,本研究体外细胞实验结果证明,DAPT 甲基化未改变DAPT的生物学特性,仍能够作用于胰腺癌细胞,抑制其增殖,在此基础上本研究成功制备了基于Notch 信号通路抑制剂的分子探针11C-DAPT,合成过程简便、快速,放射化学纯度高,生物学分布提示11C-DAPT 在肝脏、肠道的摄取低,为11C-DAPT 进行胰腺癌的显像奠定了基础。我们下一步将建立胰腺癌皮下移植瘤动物模型,观察胰腺癌对11C-DAPT 的摄取情况,进一步探索11C-DAPT 作为胰腺癌新型靶向分子探针的可能性。
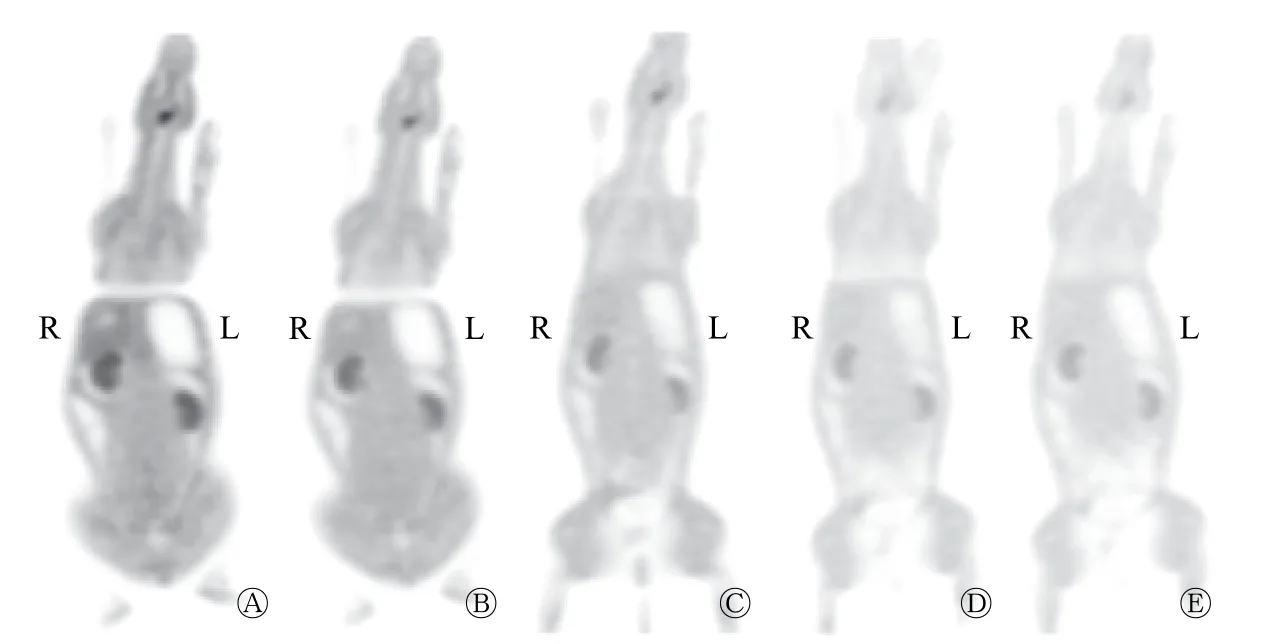
图4 新西兰兔注射11C-DAPT 后不同时间的PET 冠状位图像 图中,A:0 min;B:7 min;C:14 min;D:21 min;E:28 min。DAPT:(3,5-二氟苯乙酰基)-L-丙氨酰基-S-苯基甘氨酸叔丁酯。 Fig.4 Coronal PET images of New Zealand rabbit at different time point after injection of 11C-N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester(DAPT)
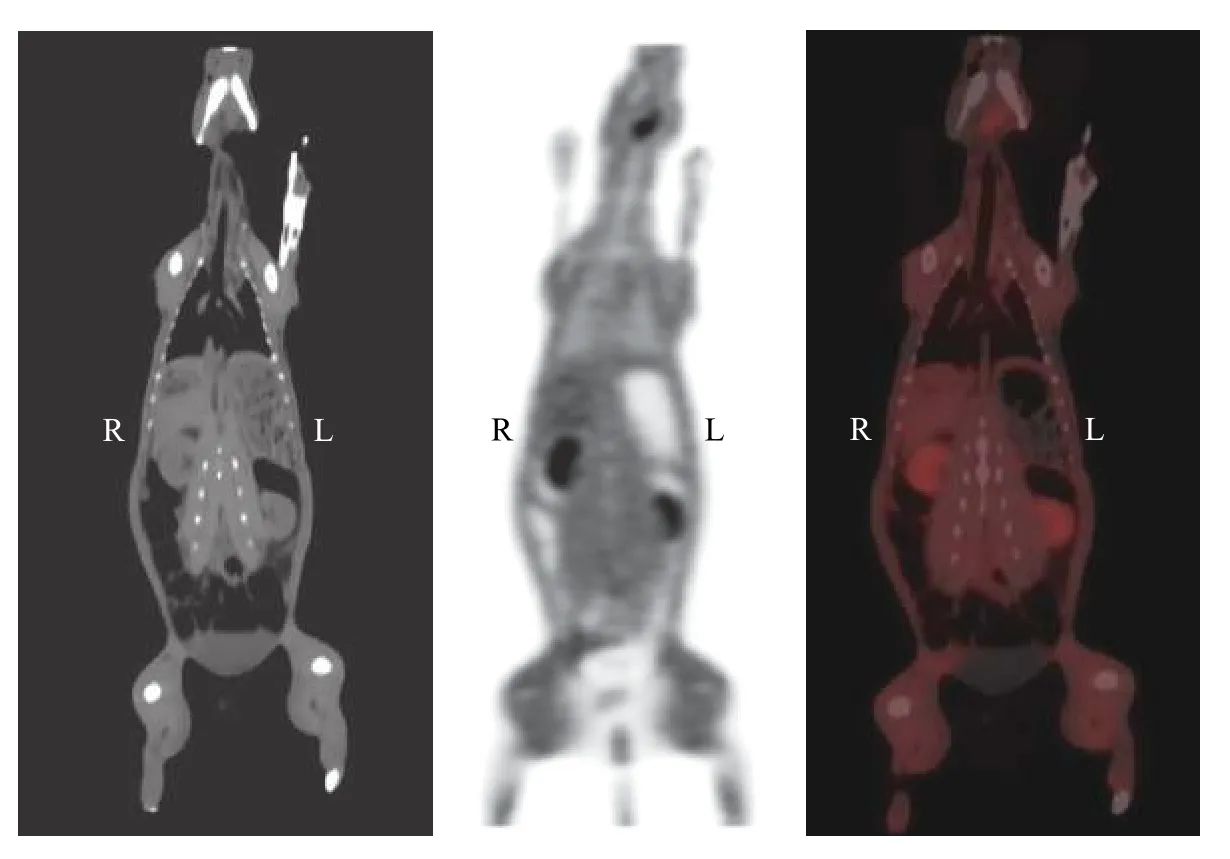
图5 新西兰兔注射11C-DAPT 14 min 后的PET/CT 冠状位图像 图中,DAPT:(3,5-二氟苯乙酰基)-L-丙氨酰基-S-苯基甘氨酸叔丁酯。 Fig.5 Coronal PET,CT and fusion images of New Zealand rabbit at 14 min after injection of 11C-N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester
