核医学技术在帕金森症诊断中的应用(一)
2019-05-20李周雷罗淦华易畅张祥松
李周雷 罗淦华 易畅 张祥松
原发性帕金森病(Parkinson’s disease,PD)的确诊需要通过黑质中路易小体堆积的病理学结果来判定。临床病理学研究也表明:神经科医生对PD 临床症状的评定与黑质中路易小体的堆积存在之间存在90%的一致性[1]。 但是,在活体中对大脑病理学取样是不现实的。 另外,PD 的显著特征是黑质体致密部位内多巴胺神经元退化而引起的基底核上游信息的传递的障碍。 目前诊断PD 主要依据患者的临床症状、体征以及对左旋多巴制剂治疗反应等指标进行综合评价, 但PD 出现症状时黑质多巴胺能神经元脱失往往已达50%~80%[2]。
在早期PD 中, 可能尚未表现出完整的特征性临床症状和体征(静止震颤、运动迟缓、步态拖曳和僵硬),需要特别注意鉴别诊断,包括良性必需的或肌张力障碍性震颤和与外源性药物,如:多巴胺受体抑制剂,相关的帕金森综合征[3],这些病症与黑质改变或纹状体多巴胺缺乏无关。 其中,高达15%的被诊断为早期PD 的病例中,其成像显示多巴胺功能正常[4,5]。 因此,无创影像学方法可检测黑质结构或纹状体多巴胺功能的改变,可以提高对多巴胺缺乏的帕金森病综合征诊断的特异性,有助于疾病初始阶段治疗管理决策的合理化。
其中,在早期阶段的PD 诊断或者病情发展监测中,以结构改变为基础的MRI 和CT 是不理想的[6]。PD 跟2 型囊泡单胺转运蛋白(VMAT2)与多巴胺转运蛋白(DAT)的无效结合直接相关。 这种无效结合在疾病发作前13~17 年便可出现, 单光子发射断层扫描 (single photon emission computed tomography, SPECT)可对此进行有效显像[7-10]。
在早前的研究中,研究者使用可卡因类似物受体的单光子发射断层扫描类研究PD 中多巴胺能神经元的完整性[9,11]。 随着技术的进步以及新示踪剂的产生,正电子发射断层扫描(PET)也可用于PD 的诊断,氟标二羟基苯丙氨酸(F-DOPA)被认为是PD 诊断中最有潜力的示踪剂之一[6,12]。 由于黑质的特异性代谢,大脑中F-DOPA 的生理性摄取的独特位点是在基底神经节、尾状核和壳核[10],FDOPA 也为早期PD 及肌张力障碍性震颤的鉴别诊断提供了有效支持[6,12]。 图1 所示的流程总结了结构和功能成像在诊断和管理不同帕金森病综合征中的应用。
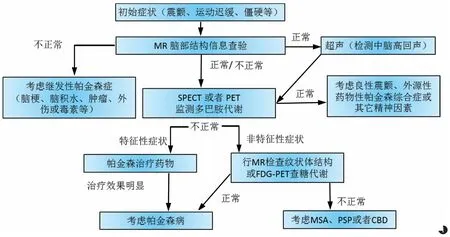
图1 帕金森病影像学诊断流程
多巴胺功能成像
PD 病人的多巴胺功能可以通过3 种主要方式进行检查[13]。 (1)可以使用PET 和SPECT 示踪剂评估突触前的多巴胺转运蛋白(DAT)的活性,其中大多数是以托烷为基础的,例如123I-b-CIT、123I-FP-CIT、11C-CFT;(2)18F-DOPA PET 可提供多巴脱羧酶活性和多巴胺转换的信息 (图2,3);(3) 也可以用11C-或18F-二氢丁苯那嗪PET 检查多巴胺的囊泡单胺转运蛋白的活性。 早期PD 患者显示壳核内多巴胺活性降低,且在患侧对侧的壳核内活性缺失更为严重[14,15],而尾状核和腹侧纹状体内巴胺活性相对正常;当PD 患者壳核多巴胺活性降低40%~50%时才会有PD的临床征兆[16,17];而壳核18F-多巴摄取和DAT 结合的水平与PD 患者的运动迟缓和僵硬度成反比, 且与震颤严重程度无关, 表明PD 震颤不是黑质-纹状体退化的直接结果[18-20];临床上可使用123I-FP-CIT SPECT 进行纹状体DAT 成像来鉴别诊断PD 和特发性震颤患者,敏感度和特异度超过90%[21]。
葡萄糖代谢成像
18F-FDG PET 可用于评估颅内葡萄糖代谢的水平,豆状核中糖代谢的水平可用来辅助PD 的诊断[22];分析显示豆状核内存在异常的代谢增高,而额叶和颞叶的代谢则明显降低[23];葡萄代谢的这一表征与PD 的临床分级密切相关性[23],而且,左旋多巴治疗或深部脑刺激治疗成功改善了PD 患者颅内葡萄糖的代谢[24,25],因此18F-FDG 可做为PD 诊断的潜在性生物标志物[23-25]。图4 为早期PD 者头部葡萄糖代谢对照(18F-FDG PET)。
Eckert 等对8 例疑似早期帕金森病但18F-DOPA PET检查结果正常的患者行18F-FDG PET 检查, 所有患者中无一人具有PD 相关的葡萄糖代谢特征, 并且3 年后这8 例患者也都没有表现任何临床进展[26],这一研究表明正常的多巴胺及FDG 成像可用来排除退行性PD 的诊断。
其他核医学影像技术在PD诊断中的应用

图2 a)~c)对照组健康受试者18F-DOPA 显像图(引自易畅,DOI:10.3760/cma.j.issn.2095-2848.2017)。可见双侧基底节成像清晰,双侧壳核、尾状核大小、形态及放射性分布均匀、对称 图3 a)~c)早期PD 患者(女,43 岁)18F-DOPA 显像。患者左侧肢体患病,起病1 年,可见双侧壳核18F-DOPA 摄取减少,以起病对侧(右侧)减少为主,双侧尾状核18F-DOPA 摄取未见明显减少
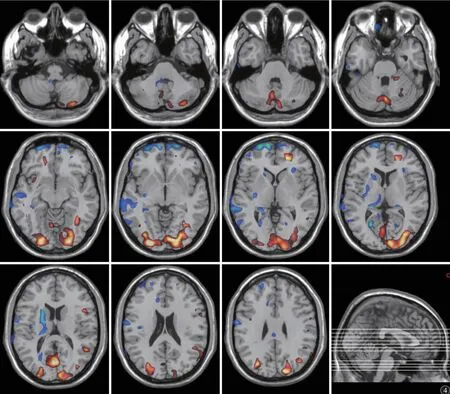
图4 早期PD 患者头部葡萄糖代谢。男,55 岁,将其与15 例年龄匹配的健康对照者进行双样本t 检验,检验水平P<0.01,其中蓝色表示与正常人相比代谢相对减低区域,黄色-红色表示与正常人相比代谢相对增高区域
最近, 一些β-射线放射性药物也已用于研究运动障碍患者的诊断。 例如研究人员发现11C 标记的5-羟色胺能受体的显像剂(11C-DASB)并评估其功能,或标记多巴胺释放为目的的显像剂(11C-raclopride)都可用来诊断PD 患者中左旋多巴缺失引起的运动障碍及左旋多巴治疗中频繁发生运动不良症状[27]。
另外,有研究表明,在诊断PD 时18F-FMT 比18F-DOPA具有更好的摄取-本底比率[28,29]。 将18F-FET 与18F-DOPA的头部摄影进行比较时, 结果表明FET 在纹状体外区域(如杏仁核、苍白球、脑干、海马和丘脑)摄取较18F-DOPA高, 而两种示踪剂的皮质摄取相似; 研究者认为18F-FET PET 在检查同种异体皮质环结构内的病理变化方面更有优势,有助于加深对PD 认识[29]。
结论
18F-DOPA 在PD 的诊断中潜力巨大,由18F-DOPA PET提供的分子影像学提供更好地鉴定PD 和更好地监测疾病进展和/或对治疗的反应。 然而,对症药物治疗的具体作用机制和神经药物对示踪剂摄取的影响仍需研究,特别是左旋多巴诱导运动障碍的治疗等方面[27,30,31]。 另外,未来的研究需要验证MRI 和PET 联合使用是否可以提供更好的诊断疾病、评估治疗以及鉴别诊断的方法[32,33]。