阿尔兹海默病和轻度认知障碍的脑结构差异:一种自动量化脑容量测量工具的使用
2019-05-20陈甜吴非
陈甜 吴非
痴呆症是一种广泛的脑部疾病, 它通过引起记忆、思维、行为、取向等方面的退化,进而影响大脑,从而导致人的日常功能下降,而阿尔兹海默病(Alzheimer's disease,AD) 是痴呆症中最常见的一种。 轻度认知功能障碍(mild cognitive dysfunction,MCI) 是介于正常衰老和痴呆之间的一种中间状态,指有轻度的记忆或认知损伤,但尚未达到痴呆程度的一种状态,日常生活和社会功能不受影响,MCI 受试者中, 其中每年约10%~15%会进展为AD[2]。 目前诊断主要是基于临床以及心理神经量表评估,但是当患者被诊断为AD 时,脑组织已经历了广泛和不可逆转的神经元和突触的损失,目前,这种疾病还没有特定的治疗方法,随着病人的病情恶化,最终将导致死亡[3]。 近年来,计算机辅助诊断系统已被应用于检测AD 的早期萎缩性改变。 本研究中,一种名为AccuBrain[4,5]的自动脑区量化工具在脑分析中展示了其潜力。 它能够自动分割20 多个大脑区域,并在没有任何交互的情况下测量它们的体积。 在本研究中, 笔者使用AccuBrain 来完成分割和量化任务。
资料与方法
1.临床资料
使用对照研究的方式对患者和健康对照组展开研究,本组AD、MCI 患者及年龄、性别匹配的健康老年人均来源于2017 年10 月~2018 年7 月我院神经内科和痴呆病房。 AD 组中男15 例, 女6例,平均年龄71 岁(64~84 岁),受教育年限大于8年, 其简易智力状态检查量表 (mini-mental state examination,MMSE) 评估患者情况,MMSE 总分范围是0~30 分, 得分低于12 表示严重痴呆,13~20表示中度痴呆,20~24 表示轻度痴呆,24~30 表示正常对照。 MCI 组中男9 例,女15 例,平均年龄66 岁(61~88 岁),受教育年限大于8 年,其蒙特利尔认知评估量表 (Montreal cognitive assessment scale, MoCA)筛查MCI 患者,包括了注意与集中、执行功能、记忆、语言、视结构技能、抽象思维、计算和定向力等8 个认知领域的11 个检查项目,测试完后由测评员根据评分情况来筛查患者是否具有MCI。 总分为30 分,评分小于26 分说明患者有认知功能损害; 如果受试者受教育年限小于12年, 在测试结果上加1 分, 校正受教育程度的偏倚,得分越高认知功能越好。 健康对照组中男10例,女14 例,平均年龄67 岁(53~79 岁),受教育年限大于8 年,MMSE 评分≥24 分,MoCA 评分≥26 分。 所有病例均由神经内科及精神科两位主治医生采用综合病史以及相关系统性检查对医学或神经系统疾病及大脑结构和功能进行排除可能的影响因素。
2.MRI检查方法
所有患者均行3.0 T 超导型磁共振扫描仪(Siemens Magnetom Verio ), 获得头部矢状位3D-磁化准备快速梯度回波T1WI 图像, 它包含了176个1 mm 厚的连续矢状切片覆盖全脑,成像参数TR 2530 ms,TE 2.22 ms, 视野224 ms×224 ms, 矩阵为224×224,层厚1 mm。
3.统计学方法
采用Shapiro-Wilk 检验两组各区域体的正态性。对于符合正态性分布的区域,采用两独立样本t 检验来检验实验组和对照组各区域的绝对体积和相对体积的差异, 否则采用非参数Mann-Whitney U 检验。 采用IBM SPSS Statistics 20 进行统计,P<0.05 为差异有统计学意义。
AccuBrain 是一种新型自动定量测量大脑结构的工具, 可以在全自动模式下执行大脑结构的组织分割和定量测量。该程序在个人电脑上执行,配置英特尔Xeon CPU E5-2683 v3@2.00 GHz(2 核)和RAM 112G, NVIDIA GPU GeForce GTX 1080。在分析过程中,采用基于多参数的分割方法,对单个脑MRI 进行自动分割。 AccuBrain 工作线路如图1所示。 图谱池由300 多个脑部MRI 组成,之前是用不同的扫描仪从不同的受试者那里获得的,外观变化很大。 地图集图像包含了先前编码的放射学家指定的解剖信息,包括40 个大脑结构(如海马、侧脑室、杏仁核等)和3 个主要脑组织(如白质、灰质及脑脊液)。 在处理过程中,AccuBrain 根据与主题图像的相似性从图谱池中选择了一些地图集。然后将地图集和主题图像与非刚性图像配准进行匹配。注册完成后,将图谱池的预定义标签转换为主题空间,融合生成主题图像的分割标签,如海马分割(图2)。 AccuBrain 的特点是采用基于直方图的归一化步骤,对不同机器获得的MRI 的强度水平进行归一化。此外,为了划分每个主题,它从数百个脑核磁共振成像仪组成的大型地图集中选择了几十个与目标图像最相似的地图集。 为了保证时间效率,提出了一种基于GPU 的非刚性配准算法。 本研究中每个T1WI 数据集的执行时间约为25 min。
由AccuBrain 处理获得的T1WI 的MRI 数据(DICOM 格式),AccuBrain 通过基于脑图谱的完全自动的脑皮质以及皮质下结构的分割(图3),并最终计算并输出所分割的脑结构的绝对体积。 根据分割结果,计算并报告了绝对体积(ml)和相对体积(绝对体积除以颅内容积,intracranial volume,ICV),从而生成一份包含患者信息、 脑容量测量和解剖学信息摘要的PDF 格式的报告。 本研究中评估ICV、脑实质、海马、杏仁核、脑室系统、侧脑室、第三脑室、侧脑室下角、腹侧间脑、丘脑、尾状核、壳核、苍白球、伏隔核、中脑、桥脑、延脑、小脑上脚、小脑、左/右海马、左/右杏仁核、左/右侧脑室、左/右侧脑室下角、左/右腹侧间脑、左/右丘脑、左/右尾状核、左/右壳核、左/右苍白球、左/右伏隔核、左/右额叶、左/右枕叶、左/右颞叶、左/右顶叶、左/右扣带回、左/右岛叶,以及这些区域的相对体积。
结果
MCI 和AD 患者的绝对体积的显著性差异脑区统计结果见表1,MCI 和对照组相比, 海马、左/右海马、左/右扣带回、左/右岛叶、左/右颞叶体积减小,脑室、侧脑室、第三脑室、侧脑室下角、左/右侧脑室、左/右侧脑室下角体积增大,且差异均有统计学意义。AD 组和对照组相比,海马、杏仁核、壳核、左/右海马、左/右杏仁核、左/右壳核、左/右伏隔核、左/右额叶、左/右颞叶、左/右扣带回、左/右岛叶体积减小,脑室、侧脑室、第三脑室、侧脑室下角、左/右侧脑室、左/右侧脑室下角体积增大,且差异均有统计学意义。
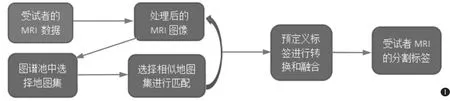
图1 AccuBrain 工作线路(经[5]授权许可)
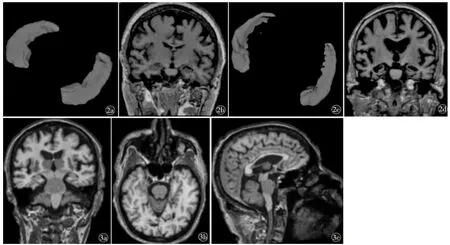
图2 AccuBrain 海马分割结果(a,c),原始MRI T1WI 薄层切片(b,d),(经 [5] 授权许可) 图3 脑结构标注后的分割示意图
MCI 和AD 患者的相对体积的显著性差异脑区统计结果见表2, 在考虑到颅内总容积影响的情况下,MCI 患者的相对体积与对照组相比,结果显示,海马、腹侧间脑、丘脑、左/右海马、左杏仁核、左/右腹侧间脑、左/右丘脑、左/右额叶、左/右颞叶、左扣带回、左/右岛叶所占比率减小,脑室、侧脑室、第三脑室、侧脑室下角、L/R 侧脑室、L/R 侧脑室下角所占比率则增大;且差异具有统计学意义。AD 患者的相对体积与对照组相比, 则显示海马、杏仁核、腹侧间脑、丘脑、壳核、伏隔核、左/右海马、左/右杏仁核、左/右腹侧间脑、左/右丘脑、左/右壳核、左/右伏隔核、左/右额叶、左/右颞叶、左扣带回、左/右岛叶所占比率减小,脑室、侧脑室、第三脑室、侧脑室下角、左/右侧脑室、左/右侧脑室下角所占比率相对增大,且差异均有统计学意义。
讨论
引发AD 的发病机制目前尚不明确, 但较为认同的病理变化是神经细胞之间和内部异常蛋白的逐步沉积, 主要与胆碱能神经元缺失、β-淀粉样蛋白沉积、tau 蛋白过度磷酸化形成神经纤维缠结相关[6]。 这种疾病通常开始且最严重的是在内侧颞叶,尤其是內嗅皮层和海马,之后会扩展到基底颞叶和后扣带回等边缘脑皮质区。 在以往的相关研究中, 主要是采用基于体素的形态学测量方法(voxel-based morphometry,VBM)对脑MRI 进行体积测量分析,这是英国学者Ashbumer 和Friston在2000 年首次提出的[7]。基于体素的MRI 分析易受研究人员个体变化的影响, 也不提供大脑区域某些细微变化的详细空间特征, 所以这种方法有很大的局限性。 笔者使用了AccuBrain 软件[5],根据前人[5]的研究显示验证,与目前研究使用较广泛的研究工具FreeSurfer 对海马区的分割进行对比,AccuBrain 对AD 患者进行海马区的分割具有更高的准确性和可靠性。 AccuBrain 是一个脑量化工具, 可在完全自动化的模式下进行脑结构和组织的分割和量化, 具有自动化和可重复性的优点。AccuBrain 精准脑影像定量系统可在数分钟内准确可靠的得到脑组织的三维体积以及正常同龄人群的百分数,具有100%的可重复性,精确度可达93%以上。
表1 MCI组、AD组与对照组的绝对体积有显著差异的脑区(±s)

表1 MCI组、AD组与对照组的绝对体积有显著差异的脑区(±s)
脑区海马区杏仁核脑室侧脑室第三脑室侧脑室下角壳核海马(左)海马(右)杏仁核(左)杏仁核(右)侧脑室(左)侧脑室(右)侧脑室下角(左)侧脑室下角(右)壳核(左)壳核(右)伏隔核(左)伏隔核(右)额叶(左)额叶(右)颞叶(左)颞叶(右)扣带回(左)扣带回(右)岛叶(左)岛叶(右)MCI 组6.70±0.96 3.57±0.74 152.12±30.11 34.39±19.52 3.52±1.12 0.29±0.18 9.52±1.04 3.28±0.43 3.41±0.56 1.62±0.27 1.96±0.51 18.18±10.70 16.21±8.92 0.17±0.11 0.12±0.08 4.62±0.63 4.66±0.48 0.38±0.08 0.41±0.08 78.81±10.10 82.16±10.12 50.42±7.78 49.49±8.09 11.50±2.05 13.08±2.17 5.57±1.08 6.02±1.05对照组6.76±0.65 3.59±0.45 127.45±17.71 19.91±12.03 2.84±0.83 0.20±0.15 9.09±0.95 3.35±0.32 3.42±0.35 1.66±0.20 1.93±0.27 10.76±6.82 9.14±5.36 0.11±0.09 0.09±0.06 4.86±0.52 4.47±0.44 0.39±0.06 0.42±0.06 79.22±8.62 83.59±9.94 52.30±5.92 52.36±5.70 11.53±1.45 13.15±1.53 5.91±0.71 6.20±0.65 P 值P 值0.023*0.536 0.001*0.004*0.021*0.016*0.145 0.017*0.020*0.544 0.711 0.007*0.002*0.019*0.027*0.169 0.156 0.393 0.721 0.880 0.624 0.006*0.033*0.005*0.014*0.000*0.001*AD 组6.63±1.18 3.16±0.61 186.27±38.63 59.43±26.82 4.61±1.19 0.42±0.23 9.03±1.00 3.25±0.58 3.38±0.63 1.45±0.30 1.70±0.33 30.15±12.75 29.28±15.14 0.23±0.14 0.19±0.10 4.31±0.54 4.44±0.47 0.34±0.05 0.37±0.06 73.26±9.37 77.16±12.10 43.25±7.49 44.72±9.57 10.23±1.09 11.60±1.99 5.11±0.78 5.39±1.24对照组6.73±0.69 3.57±0.46 125.65±16.86 17.67±5.93 2.71±0.60 0.18±0.10 8.41±1.16 3.33±0.34 3.40±0.37 1.65±0.20 1.92±0.29 9.43±3.39 8.24±2.87 0.10±0.06 0.08±0.05 4.59±0.60 4.10±0.66 0.38±0.06 0.42±0.06 78.14±8.49 82.29±10.41 50.96±6.74 52.10±6.60 11.18±1.34 12.64±1.17 5.77±0.58 6.14±0.76 0.010*0.016*0.003*0.005*0.002*0.001*0.034*0.006*0.018*0.014*0.028*0.001*0.013*0.001*0.003*0.036*0.040*0.022*0.010*0.047*0.041*0.001*0.006*0.015*0.018*0.000*0.001*

表2 MCI组、AD组与对照组的相对体积有显著差异的脑区
在MRI 上评估脑萎缩有多种方法, 但是对于脑萎缩仅靠人眼去评估在常规的临床环境中是不够的, 而且图像评估是主观的。 当需要定量测量时,如在临床试验中估计组织损失的比率时,定量措施对于评估疾病必不可少。 为了评估单个大脑结构的这种变化,通常是使用兴趣区(region of interest, ROI)分析技术,主要是由一个有经验的操作员在计算机屏幕上的一系列连续脑结构中勾勒出有问题的结构[8]。 ROI 分析是迄今为止脑萎缩测量的黄金标准[9],但存在着观察者/操作员的依赖性、 脑结构和解剖区域边界选择的偏差等主要缺陷, 而AccuBrain 可自动分析整个大脑结构,避免先验选择区并消除观察者的可变性。
众所周知, 健康的大脑在结构和功能上是不对称的, 右侧海马比左侧海马大约大5%[10]。Thompson[11,12]等研究支持左半球多于右半球参与AD。 Karas 等[13]使用VBM 发现,除了早期海马萎缩外, 还在AD 患者中展示了包括小脑、 丘脑内侧、 尾状核头部和扣带回在内的全脑灰质体积的减少。根据Braak 等[1]研究显示在MCI 及AD 的早期阶段,首先是內嗅皮层发生严重变化,而海马、扣带回、颞极及岛叶发生轻微变化,随着疾病的进展,海马等区域损伤显著,同时损伤扩展到新皮层关联区域,但此时影响较轻,例如杏仁核、壳核基部、伏隔核、丘脑等边缘脑区,最后病变会累及锥体外系系统的参与。 也有研究表示[14-16],扣带回中的灰质丢失可能先于内侧颞叶及海马的改变。Karas[17]的研究认为MCI 组灰质萎缩的主要部位为双侧海马、双侧颞叶上部、双侧丘脑、左侧岛叶、左侧扣带回等区域。 虽然各家的研究结果不尽相同, 但大家较一致的认同为:AD 患者灰质萎缩的主要区域是内侧颞叶(如海马、杏仁核等)、额叶、扣带回、岛叶等,而MCI 表现出与AD 相似的萎缩区域。 最新的研究调查[18]显示,患者在MCI 期间的工作记忆和执行功能下降, 此期也被称为AD临床前阶段,MCI 是认知重构和神经可塑性发生的关键时期, 认知变化是在AD 发病早期和轻度认知障碍(MCI)中是明显的。 65 岁以上的成年人中有10%~20%被诊断为MCI[19],大约10%的MCI成年人进展为AD[20]。与正常年龄匹配的成年人相比,患有MCI 的人进展为AD 的速度要更快[21]。在神经病理学上,MCI 成人表现出淀粉样斑块和神经纤维缠结在大脑中负责情景记忆的高级神经区域,特别在内侧颞叶的嗅皮层、皮下和海马旁回[22],但是与AD 患者的大脑[23]相比程度较轻。 而研究表明,与工作记忆处理相关的有前额皮质、顶叶区域、扣带回和海马体等脑区域,而与执行功能相关脑区域有左侧额叶、 左侧岛叶、 左侧尾状核和壳核、左侧丘脑、扣带回等,这些发现都进一步支持了本研究的结果。
神经退行性变过程中的萎缩速度可能不同,取决于大脑的不同解剖区域和疾病所处的阶段,MCI、AD 的严重程度和进展可通过不同解剖区域的萎缩表现在疾病的不同阶段, 总脑容量可能会低估了脑区萎缩的严重程度,也有研究曾通过简单的绝对体积/ICV 的比值来进行归一化[24,25],但是目前仍无明确研究表明脑结构萎缩区域的绝对容积与总容积之间的存在明显的相关性。 在本研究中,绝对体积具有显著性差异的脑区域,相对体积不一定具有显著性差异, 考虑到颅内总容积的情况下, 绝对体积/ICV 的比值是可以无统计学意义, 但是在定量测量和估计组织损失率方面此比值又是必不可少的。
综上所述, 本研究使用AccuBrain 结合MRI图像来分析全脑结构是可行的, 可以定量检测发现AD 及MCI 患者的灰质萎缩区域, 且表现方式更直观,可辅助临床的早期诊断。但本研究仍有很多不太一致的地方,需要大量的病例来辅证。