人循环免疫细胞比值与卵巢癌患者临床病理特征及预后的关系
2019-05-20商善良张霄杨建华
商善良 张霄 杨建华
卵巢癌是常见的妇科恶性肿瘤,其病死率居女性生殖系统肿瘤的首位。随着手术、放化疗技术的不断改进,卵巢癌的疗效取得了较大进展,但仍缺乏预测生存预后的相关指标[1]。因此,寻找卵巢癌预后指标以便及时发现预后不良高危患者,一直是近年来研究的热点与难点。众所周知,机体炎性反应和免疫状态的变化与肿瘤的发生、发展密切相关,并影响肿瘤患者的预后[2]。近年研究发现,循环免疫细胞比值中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR) 及 PLT/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)等指标能反映由炎性细胞和炎性因子组成的肿瘤微环境状态,已成为揭示肿瘤状态的标志物[3-4]。但NLR联合PLR分析在国人卵巢癌中的研究较少报道,本研究以循环免疫细胞为研究基础,分析卵巢癌患者手术前循环免疫细胞比值水平与临床病理特征及预后的关系,探讨循环免疫细胞比值在卵巢癌发生、发展及预后预测中的价值。
1 对象和方法
1.1 对象 纳入标准:(1)接受相应的标准化卵巢癌治疗策略者;(2)未接受其他任何抗肿瘤、输血、放化疗等治疗者。排除标准:(1)患有血液系统、骨髓系统、淋巴系统等疾病者;(2)合并其他肿瘤者;(3)围术期发生感染者。根据上述标准,选取2010年1月至2013年1月本院妇科收治的行手术切除并经病理证实的卵巢癌患者116 例,年龄 40~71(59.37±16.78)岁。本研究经医院伦理委员会批准和患者知情同意。
1.2 观测指标 收集患者年龄、肿瘤大小、肿瘤位置、病理分级、组织类型、国际妇科产科联盟(FIGO)分期等临床资料。检测患者外周血中性粒细胞计数、淋巴细胞计数和PLT,并依据结果计算NLR和PLR。
1.3 随访方法随访由专门的随访小组通过电话、信函及门诊的方式完成,了解患者复发转移时间和死亡时间。研究的主要终点事件为无病生存时间(recurrencefree survival,RFS)和总生存时间(overall survival,OS)。RFS定义为从手术之日起至第1次出现局部或区域复发转移、随访终止或死亡时间;OS定义为手术之日至出现任何原因引起的随访终止或死亡时间。
1.4 统计学处理 采用SPSS 19.0统计软件。采用ROC曲线计算患者OS的循环免疫细胞比值最佳截点值,并以此分为高、低NLR及PLR组。采用Pearson相关分析NLR和PLR的相关性。卵巢癌患者临床病理特征与NLR、PLR的关系比较采用χ2检验或 Fisher确切概率法。生存分析采用Kaplan-Meier法,并进行logrank检验。运用Cox回归模型进行单因素及多因素预后分析。P<0.05为差异有统计学意义。
2 结果
2.1 NLR和PLR的最佳截点值及分组 NLR和PLR预测卵巢癌患者OS的AUC分别为0.745和0.701,见图1-2。根据AUC面积及相应约登指数计算,NLR和PLR预测卵巢癌OS的最佳截点值为3.25和184,将卵巢癌患者分为高NLR组(NLR≥3.25)和低NLR组(NLR<3.25),高 PLR 组(PLR≥184)和低 PLR 组(PLR<184)。Pearson相关分析显示NLR和PLR呈正相关(r=0.69,P<0.05)。

图1 NLR预测卵巢癌OS的ROC曲线

图2 PLR预测卵巢癌OS的ROC曲线
2.2 NLR、PLR与卵巢癌患者临床病理特征的关系NLR与卵巢癌患者的病理分级、FIGO分期、肿瘤病灶减灭是否理想、淋巴细胞计数、中性粒细胞计数和PLT均有关(均P<0.05),而与年龄、肿瘤位置、肿瘤大小、组织类型和术前血清CA125均无关(均P>0.05)。PLR与卵巢癌患者的FIGO分期、肿瘤病灶减灭是否理想、淋巴细胞计数和PLT均有关(均P<0.05),而与年龄、肿瘤位置、肿瘤大小、病理分级、组织类型、术前血清CA125和中 性粒细胞计数均无关(均P>0.05),见表1。

表1 NLR、PLR与卵巢癌患者临床病理特征的关系
2.3 NLR、PLR与卵巢癌患者的预后关系 116例卵巢癌患者失访5例(包括3例非肿瘤相关死亡病例)。高NLR 组患者 RFS(HR=2.231,95%CI:1.511~3.825,P<0.05)和 OS(HR=2.112,95%CI:1.431~4.016,P<0.05)均明显低于低NLR组;高PLR组患者RFS(HR=1.621,95%CI:1.225~3.224,P<0.05)和 OS(HR=2.021,95%CI:1.251~3.722,P<0.05)均明显低于低 PLR 组,见图 3-6。
2.4 影响卵巢癌患者RFS和OS的因素 单因素Cox回归分析显示,病理分级、FIGO分期、肿瘤病灶减灭是否理想、NLR和PLR与卵巢癌患者术后RFS和OS均相关(均P<0.05),而患者年龄、肿瘤位置、肿瘤大小、组织类型、术前血清CA125、淋巴细胞计数、中性粒细胞计数和PLT与卵巢癌患者术后RFS及OS均无关(均P>0.05)。将上述预后相关因素进行多因素Cox回归分析,结果显示FIGO分期晚、肿瘤病灶减灭不理想、高NLR和高PLR均为卵巢癌患者术后RFS预后不良的独立因素(均P<0.05),病理分级差、FIGO分期晚、肿瘤病灶减灭不理想、高NLR和高PLR均为卵巢癌患者术后OS预后不良的独立因素(均P<0.05),见表2。
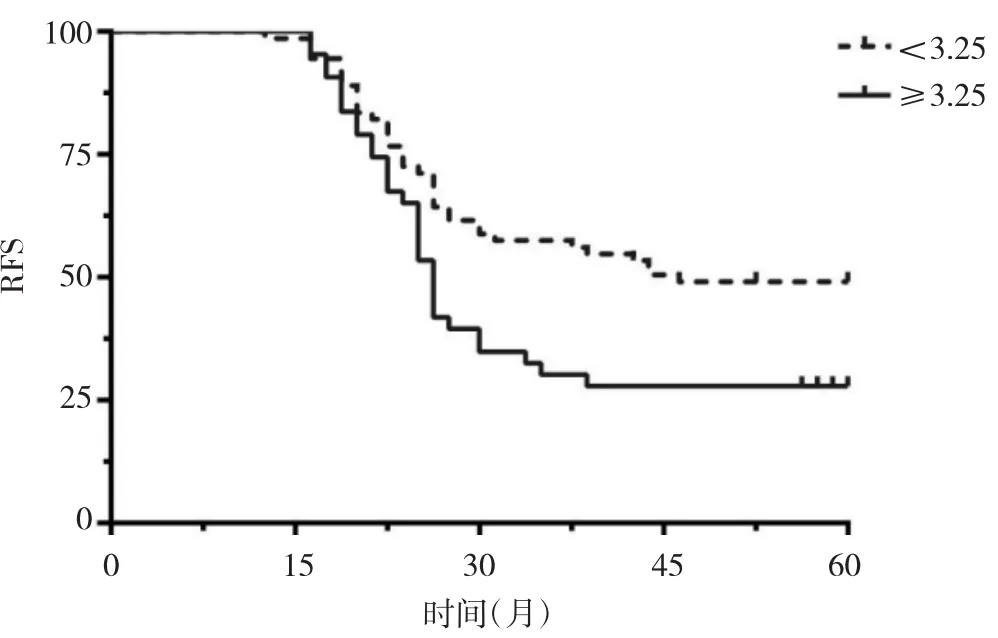
图3 高NLR组和低NLR组患者RFS比较

图4 高NLR组和低NLR组患者OS比较

图6 高PLR组和低PLR组患者OS比较
3 讨论
肿瘤的慢性感染免疫机制一直是研究的热点和难点。早在1983年Virchow就发现慢性炎性反应引起的炎症免疫细胞浸润改变肿瘤微环境是肿瘤发生的根本原因[5]。随着肿瘤分子生物学的发展,对肿瘤组织微环境中的炎性反应有了更进一步的认识。现已发现多种以炎性反应为基础的生物因子可为临床预后提供预测生存信息。Satgé[6]的研究显示免疫细胞指数模型可作用于恶性肿瘤生物标志和判断其治疗及预后的靶点。因此,分析肿瘤炎症反应导致的循环免疫细胞水平变化是预测其预后生存机制的重要途径之一,具有广阔的临床应用前景。
本研究通过ROC曲线,兼顾灵敏度和特异度,联合NLR、PLR,以3.25及184作为最佳截点,发现NLR和PLR预测肿瘤OS的AUC具有较高的实用价值。一般认为,NLR、PLR可以综合反映肿瘤患者体内炎症和免疫状态,比值升高提示人体炎性反应强、肿瘤杀伤力低下。目前,上述规律的发生机制尚未证实。但NLR、PLR升高是淋巴细胞相对减少或中性粒细胞及血小板相对增多的结果。中性粒细胞是主要的炎性细胞,不仅能产生血管内皮细胞生长因子(vascular endothelial growth factor,VEGF),促进肿瘤血管生成和远处转移[7];而且可通过释放氧自由基等炎性介质,激活NF-κB,促进肿瘤微环境的形成[8]。此外,中性粒细胞中的中性粒弹性蛋白酶可降解弹性蛋白,也能水解其他基质蛋白,从而促进肿瘤细胞浸润[9]。另一方面,淋巴细胞减少,机体抗肿瘤免疫效应减低,免疫系统不能识别和应答肿瘤抗原的突变,出现肿瘤抗原诱导的免疫耐受,导致抗原提呈细胞无法识别抗原,以致肿瘤细胞逃逸,从而形成适合肿瘤细胞增殖和转移的环境[10]。Santoiemma等[11]研究已表明,肿瘤组织中大量淋巴细胞浸润是提示预后较好的一个指标。同时,血小板也是肿瘤相关的全身炎症反应指标,尤其是晚期肿瘤患者常伴血小板增多。血小板分泌血小板因子4、转化生长因子β、VEGF等生长因子,刺激肿瘤分化,促进肿瘤的增殖。恶性肿瘤引起全身炎症反应,持续的炎症状态又建立了恶性肿瘤进展的微环境,形成一种恶性循环[12]。因此,高NLR、PLR反映了患者较重的全身炎性反应和较差的抗肿瘤免疫功能。
NLR、PLR是近年来发现的影响恶性肿瘤预后的独立危险因素。本研究结果还表明,高NLR、PLR组卵巢癌患者的RFS、OS明显低于低NLR、PLR组患者,与相关研究结论一致[13-14]。Eo等[15]研究229例卵巢癌发现高NLR、PLR患者预后不良。Zhou等[16]认为Ⅲ期卵巢癌预后差与其高NLR及PLT数量密切相关。本研究还通过多因素预后分析显示,FIGO分期晚、肿瘤病灶减灭不理想、高NLR和高PLR均为卵巢癌患者术后RFS预后不良的独立因素。同时,病理分级差、FIGO分期晚、肿瘤病灶减灭不理想、高NLR和高PLR均为卵巢癌患者术后OS预后不良的独立因素。因此,NLR、PLR升高可能预示着肿瘤细胞浸润较深,对于手术医生提前预估手术情况和病灶切除范围、判断能否达到根治水准有很大帮助。同时,还阐明FIGO分期晚、肿瘤病灶减灭不理想亦为卵巢癌患者术后RFS和OS预后不良的独立因素,与以往指南认识相符合。

表2 影响卵巢癌患者RFS和OS的Cox模型回归分析
由于本研究对象为同期且在同一医院诊治的患者,因此最大限度地避免了混杂因素的干扰。同时也存在样本量少、选择面窄等缺点。虽然阐明了NLR、PLR对肿瘤预后具有预测价值,但单一指标的灵敏度和特异度不高,需多指标联合分析以提高预测的准确性。Marchetti等[17]研究发现,NLR联合血浆纤维蛋白等因素建立的模型对卵巢癌预后的评估有重要参考价值。Sanguinete等[18]报道,基于NLR、PLR联合血清IL-6、IL-8等因素建立的模型,可用于指导卵巢癌患者预后不良的风险分层。
综上所述,NLR、PLR对卵巢癌患者预后的评估有重要指导价值,但其机制等仍有待进一步研究。同时,NLR、PLR作为一种易检测、重复性好且价格低廉的肿瘤相关性炎症指标有望成为肿瘤患者预后的常规检测指标。
