PCDH17基因甲基化检测对胃癌早期诊断的价值研究
2019-05-20朱春霞周善学胡桂梅叶国良
朱春霞 周善学 胡桂梅 叶国良
胃癌在亚洲尤其是中国非常普遍,是全球癌症相关死亡的主要原因之一[1]。尽管胃癌诊疗技术的提高显著延长了早期胃癌患者的生存率,但大多数胃癌患者诊断时已是中晚期,导致胃癌总体生存率不理想[2]。组织病理是诊断胃癌的金标准,但因其属有创检查而受到一定的
限制,不适用于大规模筛查。因此,迫切需要寻找有效分子标志物应用于胃癌早期无创筛查及辅助诊断。胃癌发生过程涉及众多遗传学和表观遗传学改变的累积,导致癌基因功能获得和抑癌基因功能缺失。随着研究的深入,越来越多的证据表明表观遗传学特别是DNA甲基化在胃癌发生、发展中发挥了重要作用[3-5]。DNA甲基化在不改变DNA序列的情况下产生稳定的可遗传的基因表达改变,从而使体内抑癌基因功能缺失[6]。DNA甲基化状态改变发生于胃癌早期,可在外周血中检测其水平变化,用于早期无创筛查胃癌病变有一定优势。原钙黏附蛋白 17(protocadherin 17,PCDH17)位于 13q21.2,为钙黏附蛋白超家族成员之一[7]。PCDH17在正常生理过程中发挥抑癌作用,但在多种肿瘤细胞中均因高甲基化致抑癌功能缺失[8-9],而PCDH17基因甲基化与胃癌的关系鲜有报道。因此,本研究将探讨胃癌中PCDH17基因甲基化水平,分析其与胃癌临床病理特征的关系,评估其对胃癌的诊断价值。
1 对象和方法
1.1 对象 选取2011年5月至2017年6月在本院普外科及消化内科住院治疗的胃癌患者120例(普外科78例,消化内科42例),男84例,女36例;年龄44~89岁,中位年龄67岁;病理分化:高分化18例,中低分化102例;肿瘤大小>5cm 57例,≤5cm 63例;病理分型:腺癌101例,印戒细胞癌19例;癌胚抗原表达阳性17例,阴性103例;糖类抗原19-9表达阳性19例,阴性101例;脉管侵犯阳性68例,阴性52例;淋巴管侵犯阳性54例,阴性66例;神经侵犯阳性55例,阴性65例;肿瘤浸润深度:T1~2期 21 例,T3~4期 99 例;淋巴结转移63例,无转移57例;远处转移7例,无远处转移113例;采用国际抗癌联盟/美国癌症联合委员会TNM分期标准(第8版)进行临床Stage分期,其中Ⅰ~Ⅱ期56例,Ⅲ~Ⅳ期64例。所有患者纳入标准:(1)均为初次就诊,术前均未接受放化疗;(2)既往均无肿瘤病史;(3)均由经验丰富的病理医师进行组织病理检查确诊为胃癌。排除标准:结合患者住院期间临床资料,同时存在其他肿瘤(其他部位原位癌或非胃癌转移癌)的患者。选取同期本院健康体检者120例作为对照。本研究获得医院伦理委员会批准和患者知情同意。
1.2 细胞培养 正常胃黏膜上皮细胞株GES-1,胃癌细胞株MGC-803、AGS和SGC-7901来自武汉大学典型培养物保藏中心。上述细胞用含10%FBS的RPMI 1640培养基置于37℃、5%CO2培养箱中培养。待细胞处于对数生长时用于下一步实验分析。
1.3 样本收集、DNA提取和亚硫酸氢盐修饰 将手术切除或内镜下剥离的肿瘤组织及切缘正常组织立即存入液氮中,并及时保存于-80℃冰箱。120例胃癌患者的血浆标本来源于上述患者术前采集,120例正常血浆标本取自健康人群对照。抽取静脉血后立即离心,3 000g离心10min,分离并得到血浆,-80℃冻存。应用QIAamp DNA Mini Kit(德国Qiagen公司)提取胃癌、对应癌旁正常组织标本及正常胃黏膜上皮细胞株GES-1、胃癌细胞株 MGC-803、AGS和 SGC-7901基因组 DNA。应用QIAamp DNA Blood Mini Kit(德国Qiagen公司)提取胃癌患者及健康体检者的血浆样本基因组DNA。应用紫外分光光度计测定DNA质量。应用ZYMO EZ DNA Methylation-Gold Kit(美国ZYMO研究公司)对提取的全基因组DNA进行亚硫酸氢盐修饰。所有操作均严格按照产品说明书。
1.4 PCDH17基因甲基化水平测定 采用荧光定量甲基化特异性PCR法(quantitative methylation specific PCR,qMSP)。将经过亚硫酸氢盐修饰过的样本DNA作为模板,以β-actin作为内参基因,标准化目标DNA的量,应用SYBR Green荧光染料,检测样本中甲基化水平。实验使用实时荧光定量PCR仪(LightCycler480,美国Roche公司)。qMSP过程所需引物:PCDH17正义:5′-GTTTGCCTTGC-TCTGGATGGTGG-3′,反义:5′-GTCCAGACCCAGATCTTCAGCGA-3′;β-actin 正义:5′-CCTAGAAGCATTTGCGGTGG-3′, 反 义 :5′-GAGCTACG-AGCTGCCTGACG-3′。样本PCDH17和β-actin均重复3次。qMSP反应体系为20μl,包括模板DNA 2μl,SYBR Green Master Mix 荧光染料 10μl,无 DNA 酶水6μl及上下游引物各1μl。qMSP反应条件为:95℃预变性 10min,95℃变性 20s,60℃退火 40s,72℃延伸 30s,循环50次。样本PCDH17基因甲基化水平应用甲基化指数(percent of methylated reference,PMR)表示,其计算公式是:PMR=2-[(Ct样本-Ct内参)]×100。
1.5 统计学处理 采用SPSS 18.0统计软件。符合正态分布的计量资料以表示,正常胃黏膜上皮细胞和3株胃癌细胞PCDH17基因甲基化水平比较采用两独立样本t检验。不符合正态分布的计量资料以M(P25,P75)表示,胃癌组织与对应癌旁正常组织PCDH17基因甲基化水平比较采用两配对样本的非参数检验;不同临床病理特征的胃癌组织中PCDH17基因甲基化水平和胃癌患者与健康体检者血浆样本中PCDH17基因甲基化水平比较采用两独立样本的非参数检验。采用ROC曲线分析PCDH17基因甲基化水平在胃癌诊断中的价值。P<0.05为差异有统计学意义。
2 结果
2.1 正常胃黏膜上皮细胞和3株胃癌细胞PCDH17基因甲基化水平比较 正常胃黏膜上皮细胞GES-1 PCDH17基因甲基化水平为0.39±0.05,胃癌细胞MGC-803、AGS和SGC-7901 PCDH17基因甲基化水平分别为67.83±6.87、33.93±4.92 和 43.21±2.69,3 株胃癌细胞 PCDH17基因甲基化水平均明显高于正常胃黏膜上皮细胞,差异均有统计学意义(均P<0.01)。
2.2 胃癌组织与对应癌旁正常组织PCDH17基因甲基化水平比较 胃癌组织中PCDH17基因甲基化水平为28.91(4.96,54.59),明显高于对应癌旁正常组织的5.16(1.02,17.81),差异有统计学意义(P<0.01)。
2.3 胃癌组织中PCDH17基因甲基化水平与临床病理特征的关系 胃癌组织中PCDH17基因甲基化水平与糖类抗原19-9表达情况、淋巴管侵犯、神经侵犯、淋巴结转移和Stage分期均有关(均P<0.05),而与患者性别、年龄、病理分化、肿瘤大小、病理分型、癌胚抗原表达情况、脉管侵犯、肿瘤浸润深度和远处转移均无关(均P>0.05),见表 1。
2.4 胃癌患者与健康体检者血浆样本中PCDH17基因甲基化水平比较 胃癌患者血浆样本中PCDH17基因甲基化水平为32.56(5.59,53.86),明显高于健康体检者的 4.06(2.21,12.84),差异有统计学意义(P<0.01)。
2.5 PCDH17基因甲基化水平对胃癌的诊断价值 在胃癌组织中,PCDH17基因甲基化水平用于诊断胃癌的 AUC为 0.73,灵敏度为 0.58,特异度为 0.80,见图1a。在血浆样本中,PCDH17基因甲基化水平用于诊断胃癌的AUC为0.77,灵敏度为0.63,特异度为0.83,见图1b。
3 讨论
胃癌作为世界第五大恶性肿瘤之一,死亡率居高不下,严重威胁人类的健康[10]。目前,胃癌患者总体5年生存率偏低,晚期胃癌患者预后较差。而早期发现诊断胃癌是提高胃癌生存率的关键因素[11-13]。因此,寻找到早期诊断筛查的有效分子标志物对提高胃癌早期诊断率及生存率具有重要意义,并能获得巨大的社会和经济效益。
原钙黏附蛋白(protocadherin,PCDHs)是钙黏附蛋白超家族的新的亚家族,分为成簇的原钙黏蛋白和非成簇的原钙黏蛋白两类[14],主要参与细胞内信号传导和细胞间的相互作用[15-16]。DNA异常甲基化是最常见的表观遗传学修饰之一,异常基因甲基化在肿瘤发生早期即可检测到,可作为早期诊断和监测肿瘤的有效分子标志物[17],亦可作为有效的预后风险评估指标[18-19]。Ying等[20]报道PCDHs在许多肿瘤中均发生高甲基化,如鼻咽癌、食管癌、乳腺癌、肝癌等。此外,PCDH8和PCDH20也分别在乳腺癌和非小细胞癌中发生高甲基化[21-22]。这提示PCDHs基因家族可能在肿瘤发生、发展过程中扮演抑癌基因的角色[23-24]。PCDH17是PCDHs家族的主要成员之一,主要介导细胞间黏附,具有抑制肿瘤生长的功能[25-26]。PCDH17作为一个新型抑癌基因,在许多肿瘤中因发生高甲基化而致功能缺失。Haruki等[25]报道PCDH17在食管癌中高甲基化且与食管癌的分化程度密切相关。在肾细胞癌中,PCDH17的甲基化水平同样与其病理评分、临床分期、淋巴结转移和不良预后显著相关[27]。在膀胱癌中同样能够检测到高甲基化PCDH17,并与患者不良预后相关[9]。PCDH17基因甲基化水平不仅可作为多种肿瘤预后评判指标,也可作为肿瘤筛查诊断指标[7]。而本研究将探讨PCDH17基因与胃癌的关系,评估其甲基化水平对胃癌的诊断效能。

表1 胃癌组织中PCDH17基因甲基化水平与临床病理特征的关系
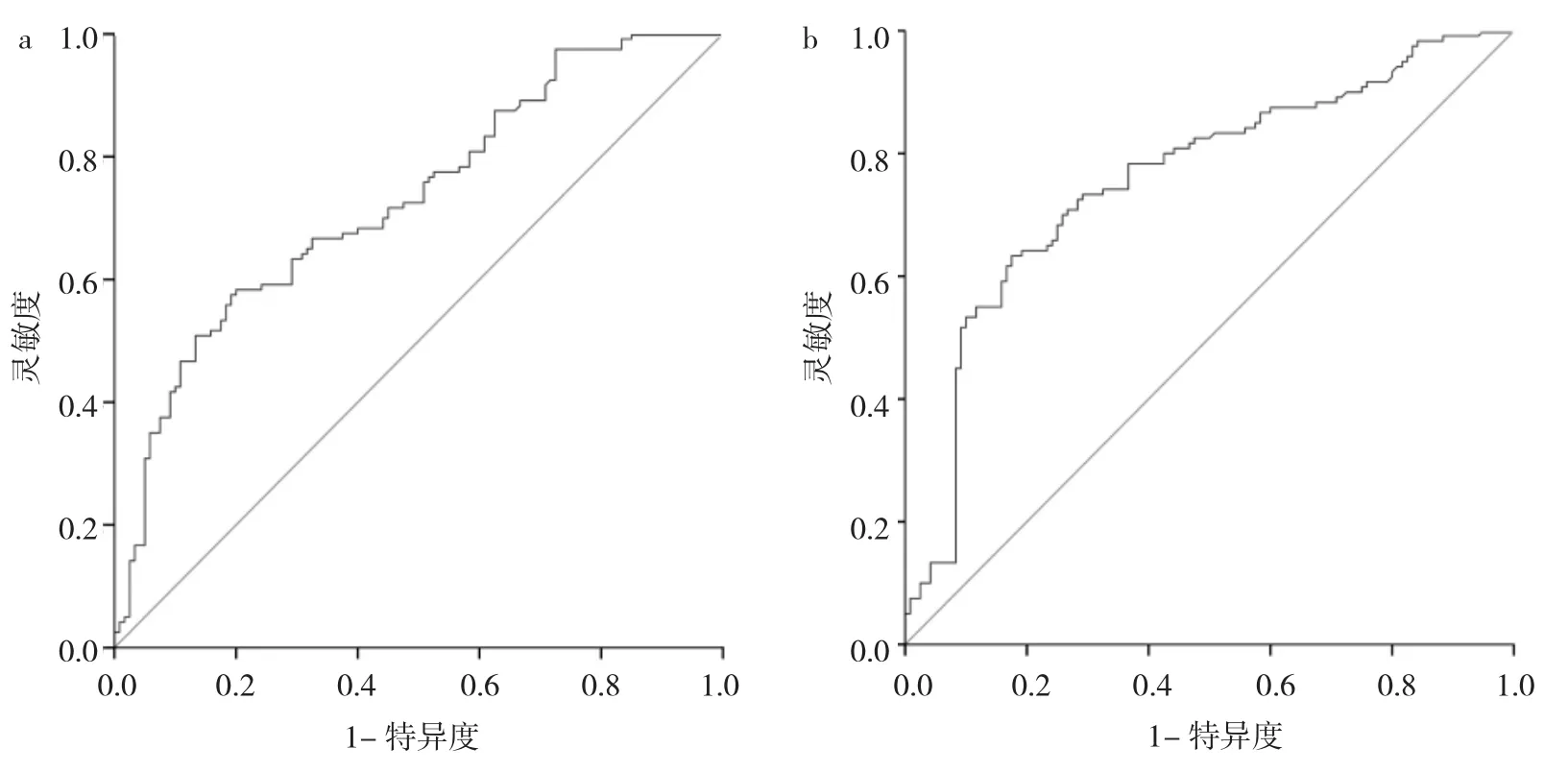
图1 PCDH17基因甲基化水平用于诊断胃癌的ROC曲线(a:胃癌组织;b:血浆样本)
本研究中,笔者首先从细胞及组织样本两个层面明确胃癌中PCDH17基因甲基化水平明显升高。通过结合患者临床资料分析发现,PCDH17基因甲基化水平在淋巴管侵犯、神经侵犯、淋巴结转移和Stage分期Ⅲ~Ⅳ期患者中均明显升高,表明PCDH17基因甲基化可能在胃癌疾病进展和转移过程中发挥重要作用。癌组织基因的相关变化可在体液或分泌物(痰液、大便、血液等)中检测到,并且在这些体液中的变化可以一定程度上反映组织中同一基因的变化情况[28-29]。因此,为评价PCDH17基因甲基化的早期无创筛查价值,笔者分别比较PCDH17基因甲基化在胃癌组织和血浆样本中的诊断价值。结果发现在胃癌组织中,PCDH17基因甲基化水平用于诊断胃癌的AUC为0.73,灵敏度为0.58,特异度为0.80;在血浆样本中,PCDH17基因甲基化水平用于诊断胃癌的AUC为0.77,灵敏度为0.63,特异度为0.83。结合上述结果,笔者认为PCDH17基因甲基化水平检测具有无创、简便、灵敏性较高的优势,是辅助诊断胃癌较为理想的生物标志物。本研究尚存在一些局限性,尚未在胃癌癌前病变人群血浆样本中检测PCDH17基因甲基化水平,还需要进一步扩大PCDH17基因甲基化检测的临床应用范围。
综上所述,本研究证实了胃癌中PCDH17基因甲基化水平明显增高,且在淋巴管侵犯、神经侵犯、淋巴结转移和Stage分期Ⅲ~Ⅳ期患者中明显升高。PCDH17基因甲基化水平可作为胃癌的早期无创筛查的生物标志物。
