大花胡麻草CgHMGR基因的克隆与表达分析
2019-05-18
(1.玉溪师范学院 化学生物与环境学院,云南 玉溪 653100;2.玉溪飞熊农业开发有限公司,云南 玉溪 653100)
大花胡麻草CentrantheragrandifloraBenth.为玄参科胡麻草属植物,主要分布于云南、贵州、广西等地[1~3].大花胡麻草的药用部位为根,具有活血调经、散瘀止痛、凝血、抗菌、抗癌的作用,主要用于治疗闭经、痛经、崩漏、跌打损伤、风湿骨痛、外伤出血、心脑血管疾病等[1,3~7].目前,关于大花胡麻草的研究较少,且主要集中于化学成分的分离鉴定和初步药理作用方面.大花胡麻草主要药效成分为环烯醚萜类化合物、苯乙醇苷类化合物和杜鹃红素[3].要通过合成生物学手段生产药用成分,必须先弄清药用成分的生物合成途径.
在植物中,环烯醚萜类化合物的生物合成途径是通过质体2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径和胞质中甲羟戊酸(MVA)途径,生成异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)合成的[8].3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR,EC:1.1.1.34)能够催化3-羟基-3-甲基戊二酰辅酶A生成MVA,是萜类合成MVA途径中的第一个限速酶,也是细胞质萜类化合物的代谢中的重要调控点[9].目前,HMGR基因已经在拟南芥(Arabidopsisthaliana)[10]、长春花(Catharanthusroseus)[11]、丹参(Salviamiltiorrhiza)[12]、珠子参(Panaxjaponicus)[13]、滇重楼(Parispolyphylla)[14]、银杏(Ginkgobiloba)[9,15]等多种植物中被克隆出来.研究表明,在植物细胞中过表达HMGR基因能够提高萜类物质的含量.在青蒿中过表达长春花CrHMGR基因使青蒿素含量提高22.5%-38.9%[16,17].在雷公藤悬浮细胞中过表达TwHMGR基因分别使二萜雷公藤甲素及三萜雷公藤红素含量提高63.93%和90.04%[18].在珠子参中过表达PjHMGR基因,导致皂苷含量增加2.5倍[13].因此,挖掘大花胡麻草中CgHMGR基因,并通过在大花胡麻草中过表达CgHMGR基因来提高其根部萜类含量具有巨大的潜在价值.
本研究拟根据大花胡麻草转录组数据库(BioProject:PRJNA558809)中CgHMGR1、CgHMGR2和CgHMGR3基因序列,分别设计基因特异性引物,通过RT-PCR的方法对CgHMGR1、CgHMGR2和CgHMGR3基因进行克隆、序列分析、原核表达载体构建和原核表达,为CgHMGR基因功能的研究奠定基础.
1 材料和方法
1.1 材料
大花胡麻草植株采自于玉溪飞熊农业开发有限公司玉山城基地,采样日期为2018年11月3日,由玉溪飞熊农业开发有限公司技术人员鉴定为CentrantheragrandifloraBenth.取3株健康、形态大小和生长势基本相同的一年生栽培大花胡麻草,分别剪取根、茎、叶和花,锡箔纸包被后,进行标记,然后投入液氮中保存.
1.2 方 法
叶片总RNA提取及逆转录按照文献[19]的方法,分别进行大花胡麻草根、茎、叶和花的总RNA提取、检测和逆转录.

表1 本研究所用到的引物

续表1

CgHMGR基因的生物信息学分析参照张晓东等的方法进行生物信息学分析[20].使用德泰生物科技(南京)有限公司在线软件(http://www.detaibio.com/tools/codon-adaptation-index-calculator.html)进行密码子适应指数(Codon Adaption Index,CAI)分析.
CgHMGR基因的原核表达载体构建挑选CgHMGR2基因进行原核表达载体构建.使用限制性内切酶HindIII和XhoI分别对19T-CgHMGR2质粒和pColdTMProS2质粒(Takara,日本)进行双酶切,胶回收后,进行电泳检测,然后按照基因:载体=3∶1的摩尔比进行过夜连接.次日,转化大肠杆菌感受态细胞JM109后,涂布于LB + Amp平板.37℃培养过夜,挑取白色菌斑,接种于LB + Amp的液体培养基中,过夜培养.第三日,使用碱裂解法进行质粒提取.接着,进行酶切检测,20 μl反应体系为:HindIII 1 μl、XhoI 1 μl、10 × buffer 2 μl、质粒 2 μl、ddH2O 14 μl,同时设置不加酶的阴性对照.过夜反应后,使用1%琼脂糖凝胶检测.检测正确后,取1 ml菌液送生工生物工程(上海)股份有限公司进行DNA测序,确保基因序列正确并且在原核表达载体上没有发生移码现象.
CgHMGR2基因的qPCR分析参照文献[19]的方法,进行CgHMGR1、CgHMGR2和CgHMGR3基因的qPCR分析.以转录组中CgUbiquitin基因(下文简称CgUbi,GenBank登录号MK256646)作为内参设计引物qCgUbi-F和qCgUbi-R(表1),PCR产物长度为152 bp.根据CgHMGR基因序列分别设计基因特异性引物(表1).使用嵌合荧光检测试剂盒TB GreenTMPremixExTaqTMII (Tli RNaseH Plus)(Takara,大连)进行qPCR,PCR条件为:95℃ 15 s,60℃ 15 s,72℃ 10 s.每个反应重复3次.反应在LightCycler® 480 II荧光定量PCR仪(Roche,瑞士)上进行扩增,扩增曲线、溶解曲线、标准曲线由定量PCR仪软件自动生成.使用内参基因CgUbi表达校准后,软件采用比较Ct值的“2-ΔΔCt”的方法自动计算出根、茎、叶中CgHMGR1、CgHMGR2和CgHMGR3基因相对表达量.
2 结果与分析
2.1 CgHMGR基因的克隆
以大花胡麻草叶cDNA为模板,分别使用基因特异性引物对CgHMGR1、CgHMGR2和CgHMGR3基因进行PCR扩增,结果均扩增出约2 000 bp的条带(图1).然后分别进行TA克隆和DNA测序.
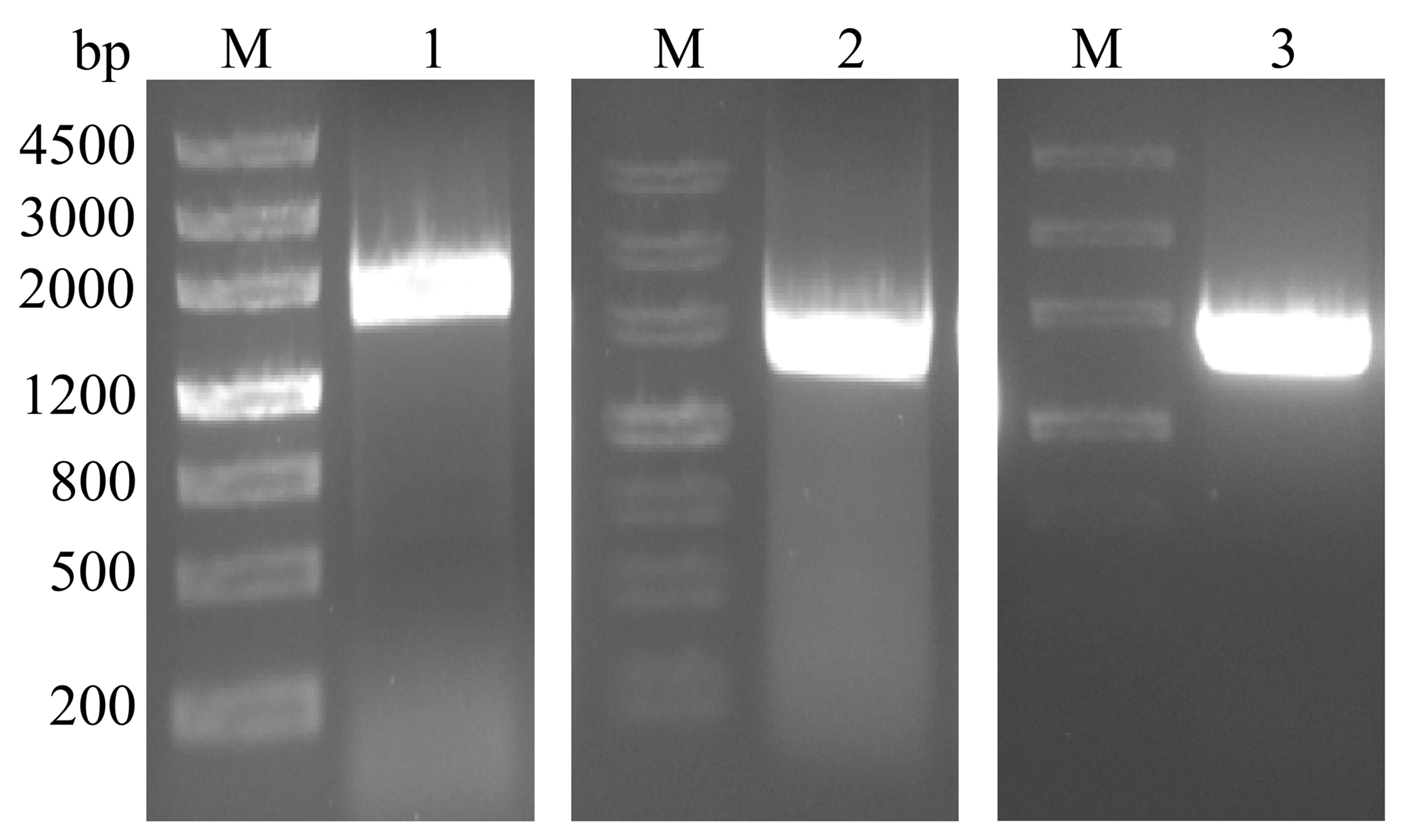
M:DNA分子量标准.1~3:CgHMGR3、CgHMGR2和CgHMGR1基因的PCR结果.图1 CgHMGR基因PCR扩增结果
2.2 CgHMGR基因的生物信息学分析
利用Genetyx和DNAMAN软件对CgHMGR基因cDNA序列进行分析,结果显示CgHMGR1、CgHMGR2和CgHMGR3基因开放阅读框全长分别为1 674、1 680和1 710 bp,分别编码557、559和570个氨基酸(表2).使用NCBI网站提供的BankIt软件将该序列上传至GenBank数据库,获得登录号MH794261、MH794263和MH794256.
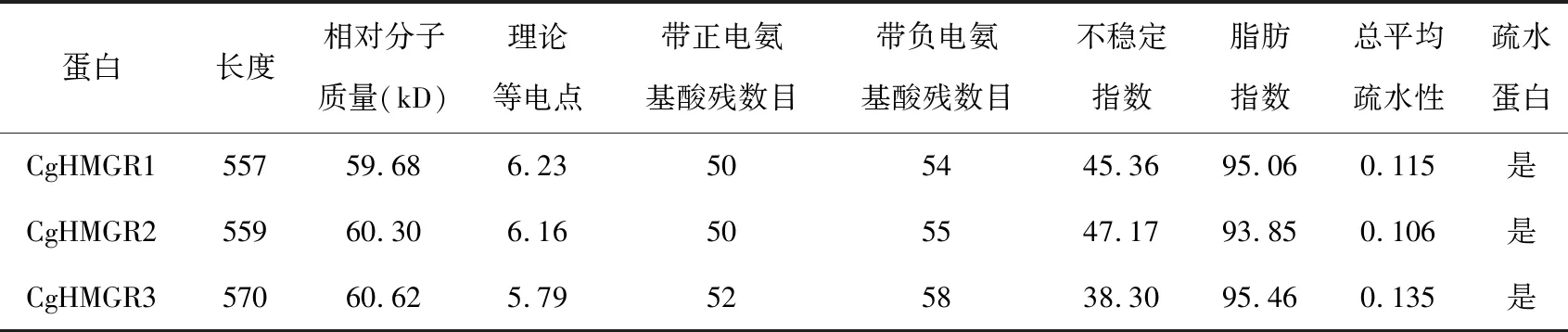
表2 CgHMGR蛋白的理化性质
使用Genetyx软件将CgHMGR1、CgHMGR2和CgHMGR3基因的核苷酸序列翻译成蛋白质,然后使用NCBI数据库中的BLASTp程序对CgHMGR1、CgHMGR2和CgHMGR3蛋白的氨基酸序列进行相似性分析,结果表明CgHMGR1、CgHMGR2和CgHMGR3蛋白都具有I类HMG-CoA还原酶保守结构域、催化位点、NADP(H)结合位点(图2)、底物结合口袋、抑制剂结合位点、四聚体界面,都属于HMG-CoA还原酶超家族成员,且 CgHMGR1、CgHMGR2和CgHMGR3蛋白与独角金SaHMGR1相似性最高,分别达到91.64%、90.39%和88.79%.利用Mega X将CgHMGR1、CgHMGR2和CgHMGR3蛋白氨基酸序列与文献已报道的部分序列、BLASTp结果中的相似性较高的部分序列进行系统发育分析,结果显示大花胡麻草CgHMGR1和CgHMGR2蛋白与独角金SaHMGR1和SaHMGR2蛋白处于同一进化枝,CgHMGR3与树棉GaHMGR、陆地棉GhHMGR、苹果MdHMGR、月季RcHMGR蛋白处于同一进化枝(图3),表明它们亲缘关系较近.
图2 中,黑色-相似性等于100%;粉红色-75%≤相似性<100%;浅蓝色-50%≤相似性<75%;保守氨基酸基序使用下划线标出;催化重要的氨基酸使用红色框标出.

图2 CgHMGR蛋白与其它植物HMGR蛋白的多序列比对结果
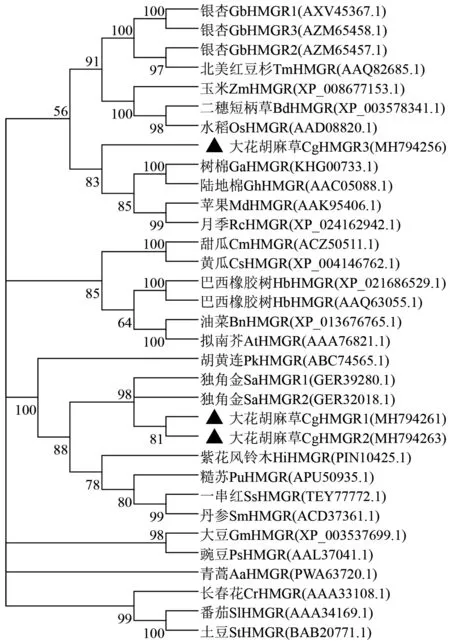
图3 CgHMGR蛋白与其它植物中HMGR蛋白的系统发育分析
使用ExPASy ProtParam软件对CgHMGR蛋白进行理化性质分析,结果表明CgHMGR1、CgHMGR2和CgHMGR3蛋白单体相对分子质量约为60.00 kD,CgHMGR1、CgHMGR2蛋白理论等电点相近,而CgHMGR3的理论等电点较低,与其带带负电氨基酸残基(Asp + Glu)较多有关(见表1).CgHMGR1、CgHMGR2蛋白不稳定指数较高,为不稳定蛋白,而CgHMGR3的不稳定指数较低,为稳定蛋白;CgHMGR1、CgHMGR2和CgHMGR3的脂肪指数和总平均疏水性相似,均为疏水蛋白(表1).CgHMGR1、CgHMGR2和CgHMGR3蛋白均含有20种基本氨基酸,其中CgHMGR1、CgHMGR2蛋白中含量最高的三种氨基酸分别为丝氨酸(10.60%、10.60%)、亮氨酸(10.40%、10.00%)和丙氨酸(8.40%、8.40%),而CgHMGR3蛋白含量最高的三种氨基酸分别为亮氨酸(10.00%)、苯丙氨酸(9.80%)和丝氨酸(9.80%),CgHMGR1、CgHMGR2和CgHMGR3蛋白含量最低的氨基酸均为色氨酸(0.4%、0.5%、0.4%).
利用SSpro软件对CgHMGR蛋白进行二级结构分析,结果表明CgHMGR1、CgHMGR2和CgHMGR3蛋白二级结构中α-螺旋(H)分别占39.68%、40.43%和42.11%,β折叠(E)分别占17.41%、17.35%和18.07%,无规则卷曲(C)分别占39.68%、42.22%和39.82%(表3).
利用Swiss-Model Workspace使用自动模式预测CgHMGR蛋白的三级结构,结果如图4.CgHMGR1、CgHMGR2和CgHMGR3蛋白模型均以3-羟基-3-甲基戊二酰辅酶A还原酶[1dq9.1.C]为模板,分别在第140~541、142~543和155~556氨基酸处建模,三维模型覆盖率分别为75.00%、75.00%和63.00%,序列一致性为55.16%、55.16%和55.90%.
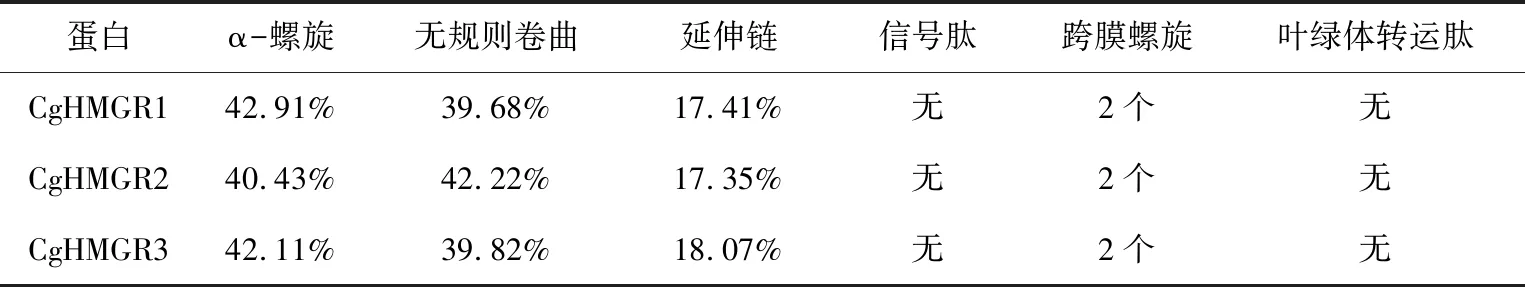
表3 CgHMGR蛋白的其它性质
InterPro软件可在结构域水平上对功能未知的蛋白进行注释,使用InterPro在线工具对CgHMGR蛋白进行分析和归类,结果表明CgHMGR1、CgHMGR2和CgHMGR3蛋白均包含HMGR结构域(IPR002202),属于I类HMGR家族成员.分别对CgHMGR蛋白进行GO注释,结果表明CgHMGR1、CgHMGR2和CgHMGR3蛋白均参与氧化还原过程(GO:0055114)、辅酶A代谢过程(GO:0015936)和类异戊二烯生物合成过程(GO:0008299);它们的分子功能均为辅酶结合(GO:0050662)、羟甲基戊二酰辅酶A还原酶(NADPH)活性(GO:0004420)、作用于以NAD或NADP为受体、以CH-OH官能团为供体的氧化还原酶活性(GO:0016616)和蛋白结合(GO:0005515).
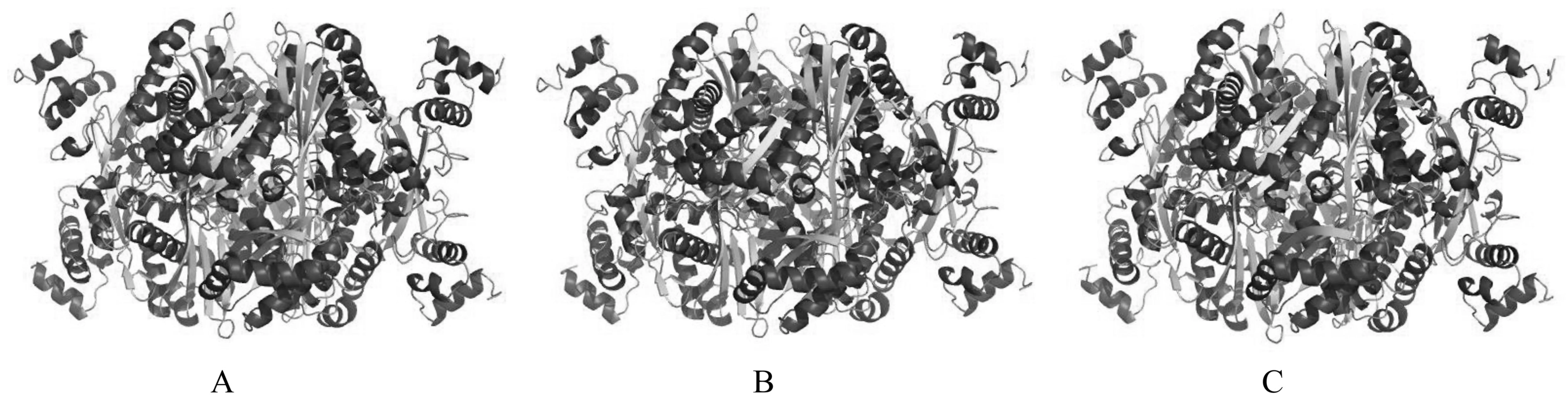
红色-α-螺旋,黄色-β-折叠,绿色-环;A:CgHMGR1,B:CgHMGR2,C:CgHMGR3图4 CgHMGR蛋白同源二聚体的三维结构预测
利用SignalP 5.1服务器对CgHMGR1、CgHMGR2和CgHMGR3蛋白进行分析,均未发现信号肽,表明该蛋白为非分泌型蛋白.利用TMHMM软件预测CgHMGR蛋白的跨膜螺旋区,结果表明CgHMGR1、CgHMGR2和CgHMGR3蛋白在N端均含有2个跨膜螺旋区域(图5),为膜蛋白.使用ProtComp 9.0和Plant-mPLo软件对CgHMGR1、CgHMGR2和CgHMGR3蛋白进行亚细胞定位预测,结果表明该蛋白定位于内质网.使用WoLF PSORT软件对CgHMGR1、CgHMGR2和CgHMGR3蛋白进行亚细胞定位分析,结果为对CgHMGR1可能定位于叶绿体、细胞质或线粒体,而CgHMGR2最可能定位于内质网或质膜,CgHMGR3蛋白可能定位于质膜或内质网.使用ChloroP 1.1 Server对CgHMGR1、CgHMGR2和CgHMGR3蛋白的叶绿体转运肽进行预测,结果表明它们不含叶绿体转运肽(表4).

表4 CgHMGR蛋白的亚细胞定位预测

图5 CgHMGR蛋白可能跨膜螺旋的检测
密码子适应指数(CAI)是指编码区同义密码子与最佳密码子使用频率的相符程度,取值在0~1之间.CAI可以用来评估外源基因在宿主内的表达水平,CAI越高,则外源基因在宿主内的表达水平越高.对CgHMGR1、CgHMGR2和CgHMGR3基因进行稀有密码子分析,结果表明CgHMGR1、CgHMGR1和CgHMGR3基因在大肠杆菌中的CAI分别为0.59、0.58和0.60,在酿酒酵母中的CAI分别为0.57、0.58和0.57.因此,可选用大肠杆菌表达菌或酿酒酵母进行原核表达.
2.3 CgHMGR2基因原核表达载体的构建
分别对质粒19T-CgHMGR2和原核表达载体载体ProS2进行HindIII和XhoI双酶切,然后进行胶回收,再将基因和载体进行连接,经转化、涂板、挑菌、摇菌后,然后对菌液中的质粒进行提取,并使用HindIII和XhoI双酶切检测,结果如图6,能够切出目的基因CgHMGR2和载体ProS2,且大小正确.DNA测序结果表明CgHMGR2基因无突变、无移码现象.
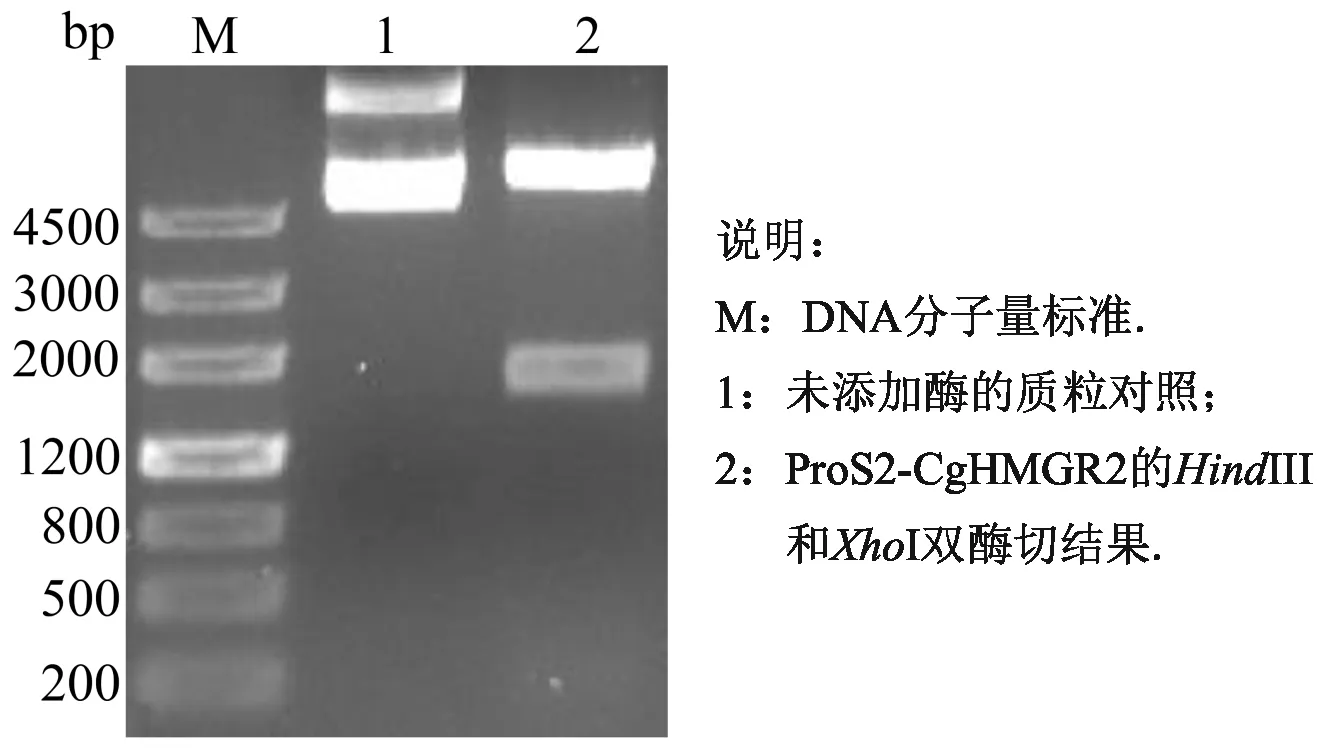
图6 原核表达载体ProS2-CgHMGR2的双酶切检测结果
2.4 CgHMGR2基因的qPCR分析
取一年生大花胡麻草的根、茎、叶和花,通过qRT-PCR分析CgHMGR1、CgHMGR2和CgHMGR3基因在不同组织中的表达情况.结果表明,CgHMGR1基因在花中的表达量最高,其次是茎,再次是根,在叶中表达量最低;CgHMGR2基因在茎中表达量最高,其次是根,再次是花,在叶中的表达量最低;CgHMGR3基因在茎中表达量最高,其次是花,再次是叶和根(图7).从不同器官来看,在花和茎中CgHMGR1基因起主要作用,在叶中CgHMGR3起主要作用,而在根中三个基因均起作用(图7).
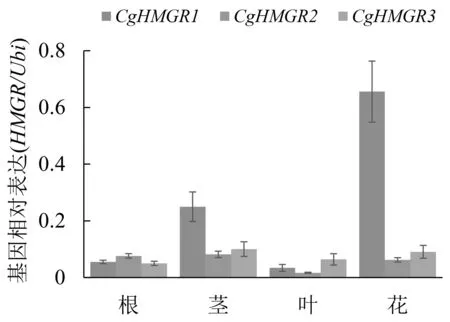
图7 CgHMGR基因在根、茎、叶和花中的相对表达
其中,图7使用Excel2016软件进行统计学分析,误差线表示标准偏差,数据来自3次独立重复实验.
3 讨 论
环烯醚萜类是大花胡麻草的主要药效成分之一,而HMGR基因能够调控萜类的生物合成,因此HMGR基因备受学者们的关注.LI W.等通过对14个陆生植物基因组中56个HMGR基因的研究结果表明,6种藻类基因组中不含HMGR基因;HMGR基因和HMGR蛋白的结构在所有植物中高度保守;植物HMGR基因起源于一个祖先HMGR基因,最终在植物中分化为4个不同的组,包括单子叶植物中的2组和双子叶植物中的2组;物种特异性的HMGR基因重复主要是由片段重复引起的,并且HMGR基因的功能分化非常有限[21].因此,HMGR基因在植物界高度保守.基于前人的研究结果,本课题组使用序列比对的方法,从大花胡麻草根、茎和叶转录组中挖掘出9个CgHMGR基因,本研究对其中的CgHMGR1、CgHMGR2和CgHMGR3基因进行克隆、序列分析和原核表达载体构建.序列比对分析结果表明,CgHMGR1、CgHMGR2和CgHMGR3蛋白都具有I类HMG-CoA还原酶保守结构域、催化位点、NADP(H)结合位点、底物结合口袋、抑制剂结合位点、四聚体界面,都属于HMG-CoA还原酶超家族成员,且 CgHMGR1、CgHMGR2和CgHMGR3蛋白与独角金SaHMGR1相似性均超过88%.系统发育分析结果表明大花胡麻草CgHMGR1和CgHMGR2蛋白与独角金SaHMGR1和SaHMGR2蛋白处于同一进化枝,CgHMGR3与树棉GaHMGR和陆地棉GhHMGR等处于同一进化枝.GO注释结果表明CgHMGR1、CgHMGR2和CgHMGR3蛋白均参与氧化还原过程、辅酶A代谢过程和类异戊二烯生物合成过程.因此,本研究所克隆的序列为CgHMGR基因.
弄清HMGR基因的表达模式是解析其功能的重要前提.通常植物HMGR基因都存在多个成员,且不同成员在不同组织中存在差异表达,因此能够调控不同组织MVA途径.在小粒咖啡 (Coffeaarabica)中,CaHMGR1仅在花芽、叶和发育初期的果实中表达,而CaHMGR2在果实发育阶段所有组织中均表达[22].在长春花中,CrHMGR1基因在茎尖表达量最高,其次是叶,在茎和根中几乎不表达;CrHMGR2和CrHMGR3基因在除茎尖外的所有组织中的表达量均较低[23].在花期滇龙胆(Gentianarigescens)中,GrHMGR主要在根中表达,在叶和花中的表达量很低[24].在北柴胡(Bupleurumchinense)中,BcHMGR基因在根中的表达量最高,在茎、叶和果中的表达量均较低[25].在滇重楼中,PpHMGR基因在根中表达量最高,在芽和茎中也有少量表达,在叶中不表达[14].在油樟中,CcHMGR1在根中表达量最高,其次是叶和枝;而CcHMGR2主要在根和叶中表达,在枝中的表达量较低[26].在本研究中,CgHMGR1基因在花中的表达量最高,其次是茎,表达量最低的是叶;CgHMGR2和CgHMGR3基因在根、茎、叶和花中的总体表达量较低,其表达量为茎 > 根 > 叶.这些结果表明,CgHMGR1基因可能在环烯醚萜类合成中起主要作用,或者是MEP途径而不是MVA途径在环烯醚萜生物合成中起重要作用,而这需要通过进一步的实验来验证.
