吴茱萸碱对人胃癌BGC-823细胞增殖的影响及分子机制研究
2019-05-18张涵妮祝文浩王慧茹郭云良葛科立王亚男
张涵妮,祝文浩,王慧茹,郭云良,葛科立*,王亚男*
(1.青岛大学 医学部 中西医结合中心,山东 青岛 266000;2. 中国科学技术大学附属第一医院输血科,安徽 合肥 230000)
胃癌(Gastric Cancer)是临床常见消化系统恶性肿瘤之一,其全球发病率居恶性肿瘤第5位,而死亡率居恶性肿瘤第3位[1]。在中国,2015年胃癌的发病率为15.8%,死亡率为17.6%,在所有癌症中排名第2位[2]。目前,胃癌的现代治疗以手术结合放、化疗及靶向治疗为主,存在治疗不彻底、毒副作用显著、复发甚至转移等问题[3],寻找更为安全有效的疗法是亟待解决的难题。
中医药在胃癌防治方面具有减毒增敏、稳定瘤体、提高中远生存期等优势[4]。吴茱萸是中医治疗脾胃病的常用中药,具有散寒止痛、降逆止呕、助阳止泻的功效,其主要成分为吴茱萸碱(Evodiamine,EVO),具有抗肿瘤、抗炎、免疫调节等药理活性[5]。研究表明,吴茱萸碱对胃癌SGC7901细胞、肝癌Huh7细胞等具有增殖抑制和促进细胞凋亡作用[6-7],但其具体的抗肿瘤分子机制仍不明确。本实验以人胃癌BGC-823细胞作为研究对象,探讨吴茱萸碱对BGC-823细胞增殖的影响及相关分子机制,现报道如下。
1 材料与仪器
1.1 人胃癌细胞及吴茱萸碱
人胃癌BGC-823细胞株购自国家细胞资源中心,由本实验室冷冻保存。吴茱萸碱(EVO)购自北京生物制品研究所,批号:0802-9702,溶解于含0.1% DMSO的PBS溶液配制成质量浓度为50 μM,-20 ℃避光贮存,使用时用培养基稀释。
1.2 实验试剂与器材
DME/F-12培养基(HyClone);胎牛血清(FBS)(BI);PBS(HyClone);0.25%胰蛋白酶(Gbico);二甲基亚砜(DMSO)(Solarbio);CCK-8试剂盒(日本同仁化学);PI试剂盒(beyotime);AnnexinV/APC+7AAD细胞凋亡试剂盒(Biolegend);一抗:Cdc25c Rabbit、Caspase-3 Rabbit、Caspase-8 Mouse、Caspase-9 Rabbit 、PARP-1 Rabbit、GAPDH(CST)和p53(Proteintech);二抗:山羊抗兔、山羊抗小鼠(中杉金桥);Multiskan FC型酶标仪,Heracell 150i CO2培养箱(美国Thermo公司);高速低温离心机(美国Beckman公司);Primovert倒置相差显微镜(德国Zeiss公司);FACS CantoTM流式细胞仪(美国BD公司);电泳/转膜仪、凝胶成像系统(美国Bio-rad 公司)。
2 方法
2.1 细胞培养
BGC-823细胞用含有10%胎牛血清的DME/F-12培养基,于37 ℃,5% CO2条件下的培养箱培养。
2.2 CCK-8法检测BGC-823细胞增殖
取对数生长期的BGC-823细胞,经0.25%胰酶-EDTA消化,制成单细胞悬液,以每孔2×103个接种于96孔板。空白组为含10%胎牛血清的DME/F-12培养基,但没有细胞。对照组加DME/F-12培养基,不加药。实验组的吴茱萸碱(EVO)终浓度分别为1 μM、2.5 μM、5 μM、7.5 μM、10 μM,每组5个复孔,分为24 h、48 h、72 h 3个时间观测点。依照CCK-8试剂盒步骤检测各观测点每组细胞的抑制率,细胞增殖抑制率=(细胞对照组A450-实验组A450/细胞对照组A450-空白组A450)×100%。
2.3 细胞形态学观察
取对数生长期细胞,胰蛋白酶消化后,调整细胞浓度为3×105个/mL,以每孔2 mL细胞悬液接种于6孔板,分对照组和EVO干预组,每组3复孔。待细胞贴壁后,弃旧培养液,实验组加入10 μM EVO培养液2 mL,置于培养箱中,于24 h后镜下观察细胞形态学变化。
2.4 流式细胞术检测EVO对BGC-823细胞周期、细胞凋亡的影响
将10 μM EVO干预组和对照组的细胞经胰酶消化,离心、弃上清,加入70%预冷乙醇于4 ℃下培养过夜。细胞周期:PBS洗涤,离心,加入RNase(10 μg/mL),孵育15 min,加入10 μg/mL碘化丙啶(PI),避光30 min。流式细胞仪检测细胞周期,并绘制相应细胞周期曲线-直方图。细胞凋亡:PBS洗涤,以(2.5~10)×106个/mL细胞浓度重悬于Annexin V Binding Buffer,每组取100 μL细胞悬液加入5 μL Annexin V及5 μL 7AAD,室温避光孵育15min,每管加入400 μL Annexin V Binding Buffer,上机检测细胞凋亡,BD软件分析凋亡结果,绘制统计图表。
2.5 Western-blot检测细胞凋亡与细胞周期相关蛋白表达
提取各组样品蛋白10 mg,用10%SDS-PAGE凝胶电泳分离蛋白,湿转膜。将PVDF膜浸入5%BSA封闭液,室温封闭1 h,然后放入一抗(使用上述各蛋白抗体,1∶1 000)4 ℃摇床孵育过夜,TBST洗膜3次,每次10 min,用TBST配制羊抗兔二抗稀释液(1∶2 000)室温摇床孵育1 h,TBST洗膜10 min×3次。最后加100 mL显影液混匀,UVP凝胶成像分析系统(Biospectrum 810 Imaging System, USA)曝光显影。
2.6 统计学方法
3 结果
3.1 EVO对胃癌BGC-823细胞的增殖抑制作用
CCK-8法检测结果显示,与对照组相比,不同浓度(1、2.5、5、7.5、10 μM)的EVO作用于BGC-823细胞24、48、72 h后,能明显抑制胃癌细胞的增殖,随着EVO浓度的增加,细胞增殖活性呈显著下降趋势(P<0.01),呈时间和剂量依赖效应,且以10 μM EVO对细胞增殖的抑制作用最为明显(P<0.001),见图1。经Graph-Pad Prism 7.0软件拟合计算24 h的IC50为9.73 μM,因此后续实验采用10 μM为工作浓度。以上实验结果表明,EVO呈时间-剂量依赖性抑制BGC-823细胞的增殖活力。
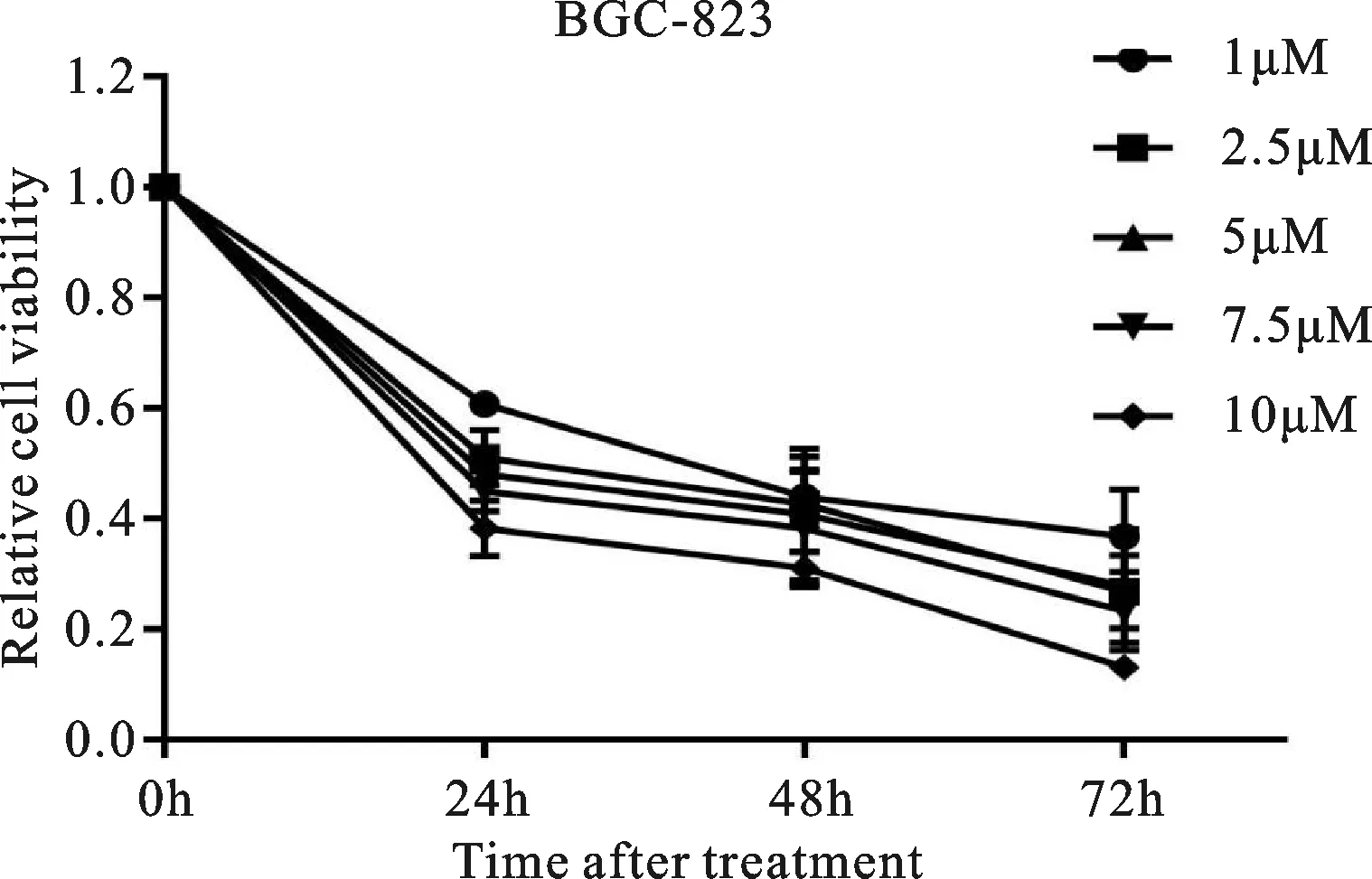
图1 不同浓度及不同作用时间EVO对胃癌BGC-823细胞增殖的作用
3.2 EVO处理后细胞形态学变化
镜下观察发现:与对照组细胞生长状态相比,EVO组可见悬浮细胞增多,细胞贴壁性差,并且细胞胞体缩小、变圆、皱缩,彼此分开未形成集落,细胞内出现少量颗粒样物质,培养液中有较多的细胞碎片,细胞活力显著降低。见图2。
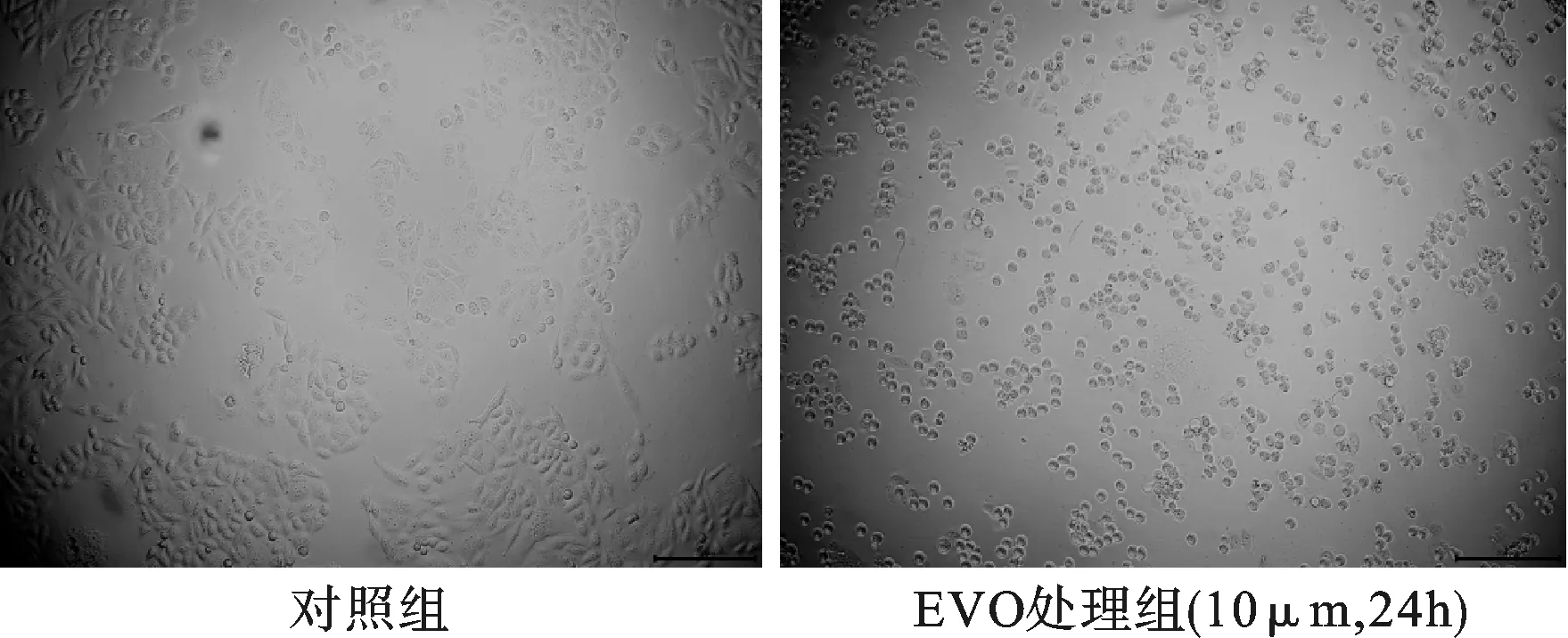
图2 10 μM EVO作用24 h后BGC-823细胞形态的变化(比例尺:100 μm)
3.3 EVO对胃癌BGC-823细胞周期的影响
采用PI单染流式细胞术检测EVO作用于胃癌细胞24 h后对细胞周期的影响。结果表明,与对照组相比,EVO组G0/G1期细胞比率由42.70%下降至8.36%,而G2/M期细胞比率则由22.50%增长至54.90%(P<0.001),见图3、表1。由此可见,EVO能诱导细胞周期阻滞于G2/M期。
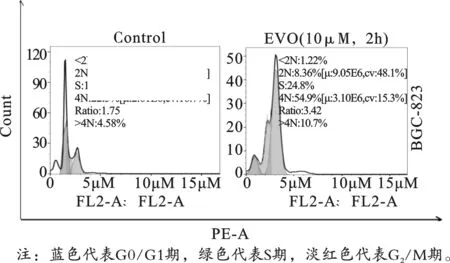
图3 10 μM EVO作用24 h后对BGC-823细胞周期的影响
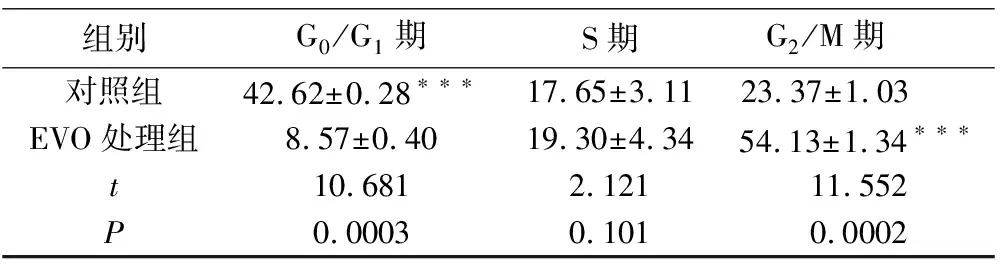
组别G0/G1期S期G2/M期 对照组42.62±0.28∗∗∗17.65±3.1123.37±1.03 EVO处理组8.57±0.4019.30±4.3454.13±1.34∗∗∗t10.6812.12111.552P0.00030.1010.0002
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001。
3.4 EVO对胃癌BGC-823细胞凋亡的影响
采用Annexin V/APC+7AAD双染流式细胞术检测胃癌BGC-823细胞经10 μM EVO 处理24 h后对细胞凋亡的影响。结果表明,与对照组细胞凋亡率相比, EVO组细胞凋亡率显著增长,细胞总凋亡率为(16.50±0.62)%,且以早期凋亡为主(P<0.001),见图4、表2。表明EVO可诱导BGC-823细胞凋亡。
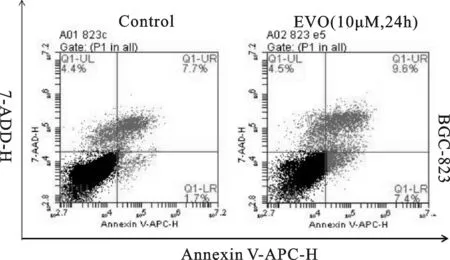
图4 10 μM EVO作用24 h后对胃癌BGC-823细胞凋亡的影响
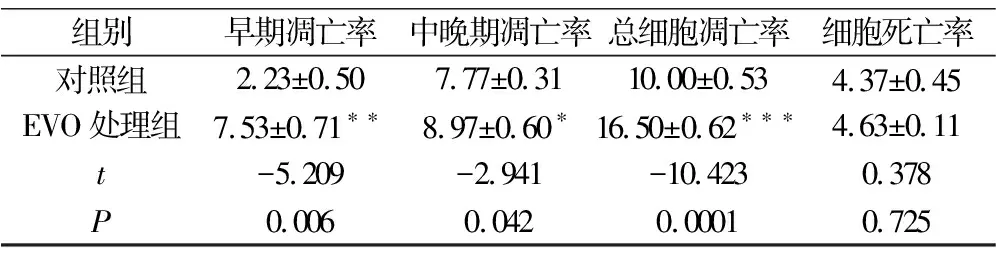
组别早期凋亡率中晚期凋亡率总细胞凋亡率细胞死亡率对照组EVO处理组2.23±0.507.53±0.71∗∗7.77±0.318.97±0.60∗10.00±0.5316.50±0.62∗∗∗4.37±0.454.63±0.11t-5.209-2.941-10.4230.378P0.0060.0420.00010.725
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001。
3.5 Western-blot检测EVO对BGC-823细胞凋亡相关蛋白和细胞周期相关蛋白表达的影响
根据EVO作用于BGC-823细胞周期阻滞实验和细胞凋亡实验的结果分析,笔者发现EVO抑制胃癌细胞增殖的机制可能是EVO将癌细胞周期阻滞于G2/M期,并诱导细胞凋亡,特别是早期凋亡而抑制胃癌细胞增殖。基于此,笔者采用Western-blot检测相关蛋白在10 μM EVO作用于BGC-823细胞不同时间段(0、3、6、9、12、24 h)后的表达情况,结果表明Cdc25C蛋白水平呈下降趋势,而p53、cleaved caspase-3、cleaved caspase-8、cleaved caspase-9和cleaved PARP-1蛋白水平呈上升趋势,见图5。由此可见,EVO可能通过上调p53、cleaved caspase-3、cleaved caspase-8、cleaved caspase-9和cleaved PARP-1蛋白水平诱导细胞凋亡,并呈时间依赖性。
4 讨论
胃癌作为我国消化系统最常见的恶性肿瘤之一,其发病机制尚未阐明,临床治疗也面临诸多挑战。现今,中医药在肿瘤中的应用越来越广泛。其中,从芸香科植物吴茱萸、石虎或疏毛吴茱萸的干燥成熟果实中提取的EVO已在乳腺癌[8]、结肠癌[9]、肺癌[10]和骨肉瘤[11]等多种肿瘤的治疗中显现出良好的抗癌活性。然而,EVO对胃癌细胞相关分子作用机制的研究尚需完善。
本实验结果显示,不同剂量的EVO处理人胃癌BGC-823细胞株24 h、48 h、72 h后,CCK-8法检测显示其能显著抑制BGC-823细胞增殖(P<0.01),并呈时间-剂量依赖性。细胞周期运转异常是肿瘤细胞恶性增殖的核心环节,研究表明,细胞的增殖、分化、衰老和凋亡均呈细胞周期依赖性[12],因此,调控细胞周期的进程是阻止肿瘤细胞异常增殖的有效途径之一。Yang Fan等[13]发现EVO能显著抑制肝癌HepG2细胞增殖,将细胞阻滞于G2/M期,最终诱导细胞凋亡。也有学者[14]研究表明低剂量EVO可将纤维肉瘤L929细胞周期阻滞于G2/M期,而高剂量则引起G0/G1期阻滞。本实验使用流式细胞术分析显示,10 μM EVO作用于BGC-823细胞24 h后,G2/M期细胞比率增长至54.90%(P<0.001),细胞凋亡率也显著增长,且以早期凋亡为主(P<0.001)。由此可知,EVO抑制BGC-823细胞增殖亦与其诱导细胞周期G2/M期阻滞和增加细胞凋亡率有关。
真核细胞顺利通过G1/S期检查点后,周期蛋白CyclinB1开始累积并与Cdc2(CDK1)形成复合物推动细胞进入M期[15],其中周期蛋白Cdc25C参与Cdc2的活化至关重要,其表达下调能抑制Cdc2/CyclinB1复合体的活化,阻滞细胞周期于G2/M期[16]。同时,Cdc25C的表达受细胞周期抑制蛋白p53的调控,p53能与Cdc25C启动子结合抑制其转录,维持细胞周期平稳运行[17]。Chien等[18]使用不同浓度的EVO干预人结肠癌COLO205、HT-29细胞,发现其能通过抑制JNK信号的活化下调细胞周期蛋白Cdc25C表达,阻滞细胞周期于G2/M期。也有研究[19]表明二烯丙基二硫化物(DADS)能通过激活p53/p21信号通路下调细胞周期蛋白CyclinB1、Cdc2、p-Cdc2和Cdc25C的表达,诱导食管鳞状癌ECA109细胞阻滞于G2/M期。与之相似,本实验研究也表明EVO作用于BGC-823细胞24 h后,p53蛋白表达上调,Cdc25C蛋白表达下调。
细胞凋亡是细胞受基因调控的自主性、程序性死亡过程,其中caspase家族蛋白和p53蛋白等在其信号调控中扮演重要角色[20-21]。研究表明,线粒体膜电位变化、死亡受体途径激活等均能引起caspases信号级联活化,通过相互激活又可自我激活模式使效应放大,导致细胞凋亡[22]。caspase-3作为执行凋亡最主要的效应因子,通过剪切死亡底物PARP-1,诱导细胞凋亡[23]。Fu Z等[24]采用大戟提取物通过caspases信号级联的激活,促使细胞凋亡,抑制了胃癌细胞增殖。用异黄酮类物质作用于胃癌细胞后,启动TRAIL-FADD-caspases-8凋亡途径,增加caspases-3和PARP-1的剪切,诱导细胞凋亡[25]。而本实验结果也发现EVO作用于BGC-823细胞后,上调了cleaved caspase-3、cleaved caspase-8、cleaved caspase-9和cleaved PARP-1的表达,诱导了细胞凋亡。

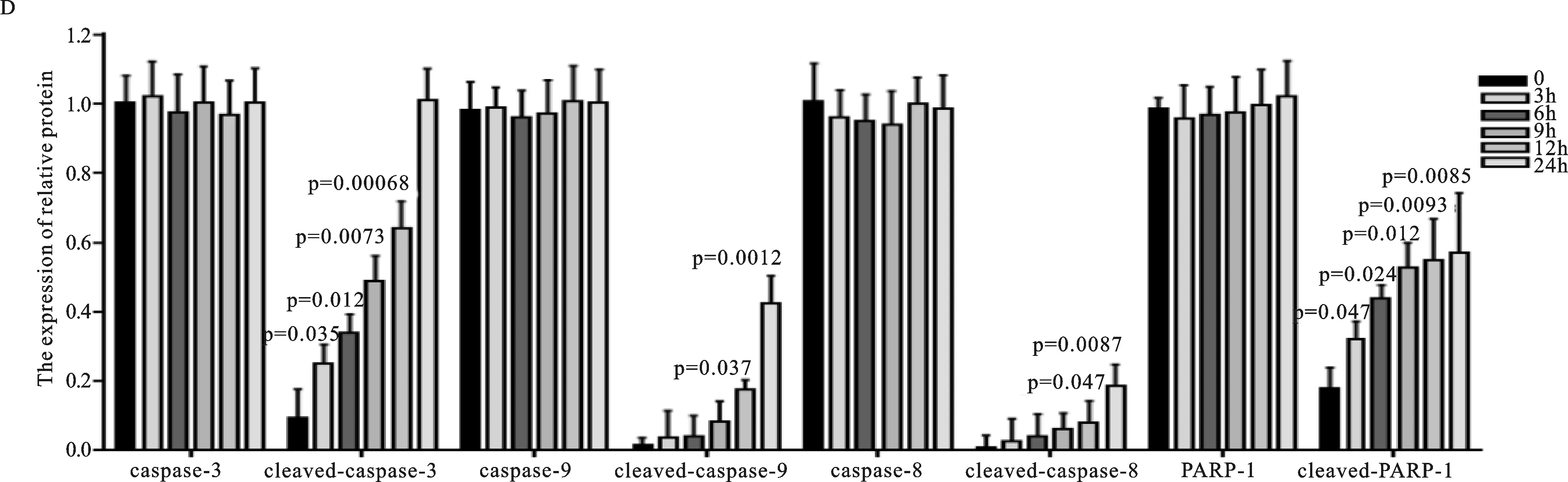
图5 10 μM EVO作用0、3 h、6 h、9 h、12 h、24 h后对胃癌BGC-823细胞凋亡相关蛋白和细胞周期相关蛋白表达的影响
综上所述,EVO可能通过上调p53表达和下调Cdc25C表达诱导胃癌细胞G2/M期阻滞,并诱导胃癌细胞凋亡,其作用机制可能与上调cleaved caspase-3、cleaved caspase-8、cleaved caspase-9和cleaved PARP-1表达相关,这也是EVO应用于胃癌治疗的新的潜在机制,为后续研究提供了参考。
