18例乳腺化生性癌临床病理分析
2019-05-18刘怡君谯蔚茜肖秀丽龙汉安
刘怡君,谯蔚茜,肖秀丽,丁 颖,易 红,龙汉安
(西南医科大学第一附属医院病理科,四川泸州 646000)
乳腺化生性癌(metaplastic breast carcinoma,MBC)是一种罕见的侵袭性乳腺癌,占所有乳腺恶性肿瘤的比例不到1%[1]。MBC是一组具有形态学异质性的浸润性乳腺癌,组成肿瘤的腺上皮细胞可不同比例的转化为另一种细胞类型,如非腺型上皮细胞(如鳞状细胞)或间叶细胞类型(如梭形细胞、软骨样、骨样或横纹肌样分化)[2-4]。由于MBC与乳腺浸润性导管癌有许多相似之处,诊断时需谨慎[5]。本研究收集了西南医科大学附属医院收治的18例MBC的病例资料,对MBC的病理特征、免疫表型及鉴别诊断进行分析并讨论,旨在加深对该肿瘤的认识,协助临床诊治。
1 资料与方法
1.1 资料
收集2001年5月至2018年5月期间本院收治的资料完整的MBC18例,患者均手术切除肿块,病理切片经过2位及以上高年资病理医生重新复片,具有完整的影像学和临床资料,无其他肿瘤及疾病。
1.2 方法
送检标本经10%甲醛充分固定,脱水后石蜡包埋切片,切片4 μm,常规HE染色,光镜观察。免疫组化染色应用Envision二步法,染色均严格按照操作说明进行。选用抗体包括:ER、PR、HER-2、EMA、CK(AE1/AE3)、CK34βE12、CK5/6、CK8、CK14、CK17、α-SMA 、CD10、desmin、Calponin、p63、S-100、EGFR和GFAP等。使用抗体均为工作浓度,一抗购自北京中杉生物技术有限公司,二抗购自丹麦DAKO公司。
1.3 结果判断
在瘤细胞胞膜、胞核和(或)胞质等特定部位对应出现棕色颗粒则判定染色呈阳性[6]。细胞核着色率在1%以上,作为判断ER、PR阳性的标准,HER2染色结果判定参照《乳腺癌HER2检测指南》[7]。
2 结 果
2.1 巨检
12例为左侧乳房肿块,6例为右侧乳房肿块,18例MBC肿块均与周围乳腺组织界限不清。肿块最大径为1.3~9.0 cm,平均5.1 cm。肿块切面多灰白实性,质韧,部分区域可见囊腔形成。
2.2 镜检
18例患者的病理组织学分类分别为伴有鳞状细胞分化的癌7例,其中鳞状细胞癌5例和腺鳞癌2例,上皮/间叶混合型分化生性癌7例,以及伴梭形细胞癌4例。见表1。
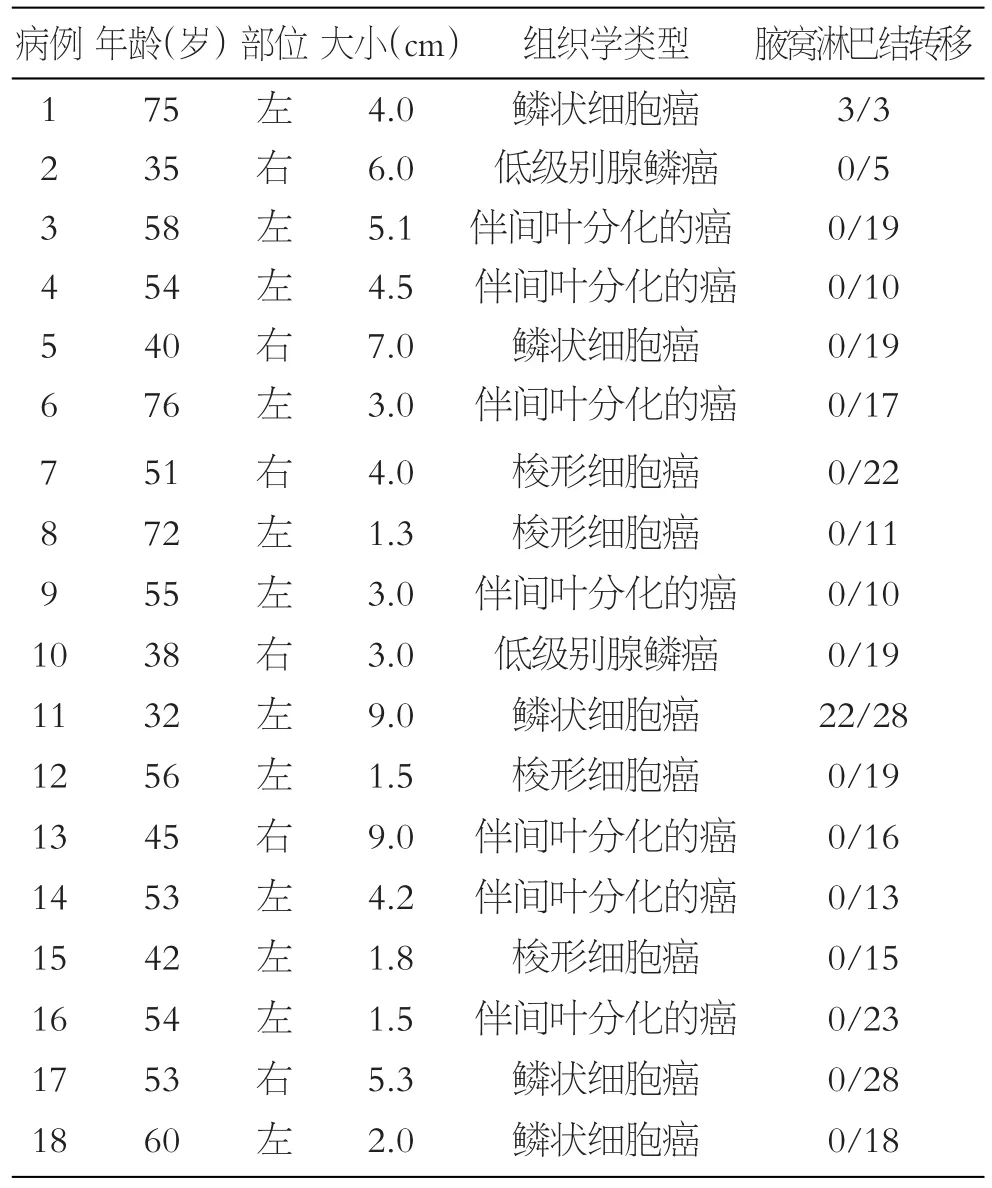
表1 18例乳腺化生性癌临床病理资料
2.2.1 伴有鳞状细胞分化的癌
2.2.1.1 鳞状细胞癌5例(27.8%)
3例肿瘤病灶内可见囊性改变,囊性变区部分内衬不同程度异型性的鳞状细胞,可见单个癌细胞的角化及癌巢中央的角化珠。1例化生性鳞状细胞癌单独存在,1例与非特殊性浸润性癌混合,见图1A、1B。
2.2.1.2 腺鳞癌2例(11.1%)
2例MBC肿瘤病灶内均可见具有分化好的腺管状结构的浸润性癌,并伴有明显鳞状细胞分化。
2.2.2 上皮/间叶混合型分化生性癌7例(占总例数的38.9%)
7例MBC可见间叶细胞类型分化的成分,包括软骨和骨成分3例(占16.7%)、肉瘤样成分3例(占16.7%)、横纹肌化生性成分1例(占5.6%),见图1C。
2.2.3 伴梭形细胞癌4例(22.2%)
肿瘤由以梭形细胞为主肿瘤细胞构成,肿瘤细胞中度异型,排列呈鱼群状,周围可见玻璃样变的胶原纤维束,见图1D。
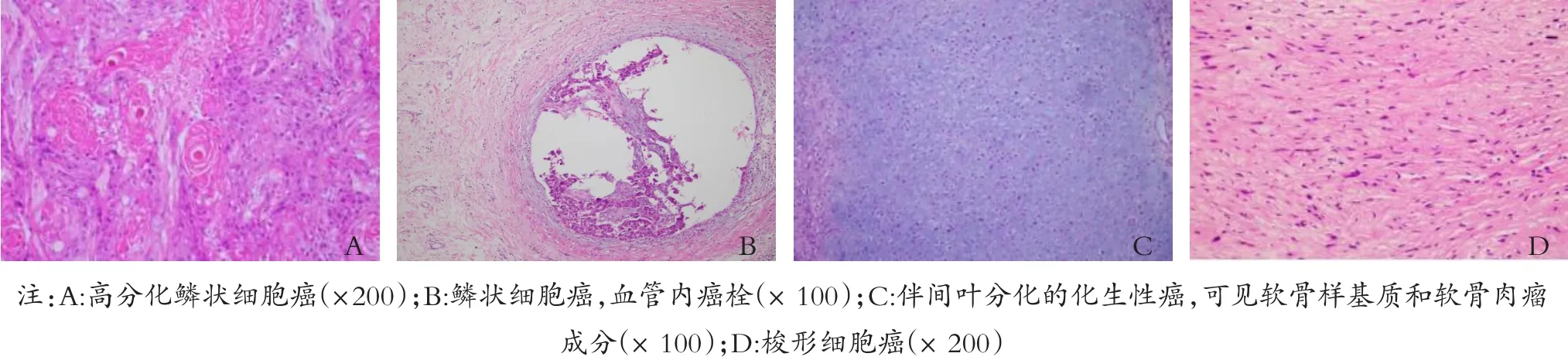
图1 乳腺肿瘤HE染色结果
2.3 免疫组化
18例MBC中,ER、PR、HER2染色结果均显示阴性共17例(占99.4%),仅有1例患者ER、PR在导管癌区域呈灶性表达,PCK阳性16例(占88.9%)(见图2A),肌上皮细胞p63阳性10例(占55.6%)(见图2B),α-SMA呈阳性(见图2C),CK5/6阳性13例(占72.2%)(见图2D)。
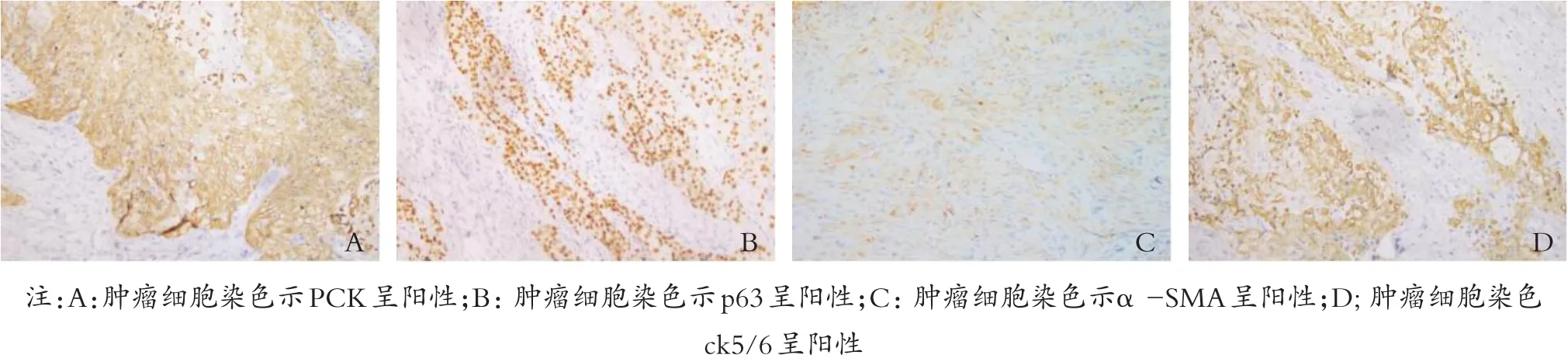
图2 乳腺肿瘤免疫组织化学染色结果(Envision二步法,×200)
3 讨论
MBC可由化生成分构成,也可由化生成分混合的非特殊类型乳腺癌构成。WHO在2012年乳腺肿瘤分类进一步阐述各类型化生性癌的临床病理特征,规范了MBC各亚型名称:低级别腺鳞癌、鳞状细胞癌、纤维瘤病样化生性癌、梭形细胞癌、伴间叶分化化生性癌(包括软骨分化、骨分化和其他间叶分化),并且将肌上皮癌也纳入化生性癌[2,3]。MBC的形态学差异明显,不同亚型的MBC生物学行为以及对治疗的反应差异较大故更需要对疾病进行正确的诊断,有助于临床选择最佳治疗方式[4]。
3.1 临床病理特征
文献报道,MBC与浸润性导管癌的临床表现无明显差异,患者多突然触及乳房内较硬肿物,直径一般在3.0~5.0 cm,有50%左右的肿块直径>6.0 cm,也有直径>20 cm,侵及乳晕或引起表面皮肤溃烂的巨大结节[8]。MBC好发于中年女性,但较少发生腋窝淋巴结转移[5]。本研究中MBC肿块最大径9.0 cm,平均5.1 cm,平均发病年龄52岁,与文献报导基本一致。
3.2 诊断与鉴别诊断
MBC肿块的直径较大,发生淋巴结转移较少,组织学分级较高和激素受体呈阴性[2]。病理学检查作为诊断MBC的金标准,由于临床特点不够典型,加上MBC细胞形态多样,存在不同亚型,因此细针穿刺细胞学检查易误诊[9]。若上皮化生成分出现鳞状细胞,可诊断为鳞状细胞癌,可见体积较大的不规则癌细胞,胞质或透亮或嗜酸,可见细胞间桥,一些癌巢中央还有角化珠出现;若有软骨样基质或是软骨肉瘤成分出现,可诊断为伴间叶分化的化生性癌。
MBC异型性明显并且化生成分多样,因此需注意与其他具有相似形态结构的乳腺肿瘤疾病鉴别。
3.2.1 恶性叶状肿瘤
MBC上皮成分多恶性。恶性叶状肿瘤上皮成分多良性,可见被覆上皮的裂隙以及叶状构象。而对于梭形细胞癌成分为主的MBC,或在细胞学穿刺诊断时由于取材量过少而不易发现恶性上皮成分,需联合免疫组化标志物进行辅助确诊,常用标记来源于上皮的抗体包括广谱角蛋白CK(AE1/AE3)、CK14和CK5/6,以上标记在MBC中表达,在叶状肿瘤中通常不表达。
3.2.2 软骨肉瘤
当MBC上皮成分较少时需注意与软骨肉瘤鉴别,软骨肉瘤缺乏CK5/6、CK7、P16等上皮来源标记。
3.2.3 癌肉瘤
MBC上皮成分多为恶性,但间叶成分可为良性、交界性或完全恶性。癌肉瘤是一类同时具有恶性上皮和间叶成分的肿瘤。并且由于MBC的间叶成分是由上皮化生而来,两种成分之间界限不清,或有移行。而乳腺癌肉瘤界限清楚,不存在上皮向间质的转化。MBC上皮来源标记,如CK5/6、CK7及EMA等阳性,癌肉瘤的上皮、间叶来源标记均为阳性。
3.2.4 多形性腺瘤
由于该疾病同样存在软骨成分,亦能双向分化,故鉴别伴间叶分化的MBC时有一定难度。但从异型性来说,MBC的细胞异型性更明显,可见大量坏死、凋亡、病理性核分裂象。多形性腺瘤的细胞则相对形态温和,异型性小。
3.3 肿瘤的组织起源
MBC组织学起源一直都是研究者关注的热点,早期研究认为MBC为两种不同的肿瘤同时发生在同一部位。经分析生物遗传和变异后,发现从遗传学角度来看,MBC的上皮和间叶组织发生了相似的改变,这一报道提示MBC中的不同成分或许是同一来源[10]。McCarthy等[11]认为基底样细胞是乳腺癌易感基因BRCA1突变的开端,也有研究认为[12]MBC分化为癌和肉瘤两种不同组织是来源于未分化干细胞。目前众多研究显示肌上皮才是MBC组织起源。肌上皮标记在基底样细胞或来源于多能干细胞的肿瘤中结果为阴性,在肌上皮来源或部分分化的肿瘤中结果为阳性。多数肌上皮标记(CK14、S-100、p63、α-SMA、P-cadherin、CD29等)在MBC中至少有一种标记呈阳性,支持MBC不是基底细胞或者干细胞起源,而是肌上皮起源[13]。
3.4 治疗与预后
MBC较罕见,病理学特征复杂,预后因组织学类型的不同而不同。国内外大部分病例选择的是乳房切除术[14],同时清扫腋窝淋巴结,保乳手术也被采用。有文献报道了约22%的MBC出现腋窝淋巴结的转移[15],可通过推广行前哨淋巴结活检、减少腋窝淋巴结的清扫,以减少手术后遗症。Rakha等[16]研究也提示,MBC的腋窝淋巴结转移与预后无关联。本文的18例MBC中有2例(11%)发生了腋窝淋巴结转移,均为鳞状细胞癌。
MBC的ER、PR呈阴性,与其他无特殊类型的三阴性乳腺癌相比,侵袭性更高、预后更坏、化疗反应更差。尽管如此,MBC的治疗及管理与高级别三阴性癌相似,主要以手术治疗辅助放化疗[17,18]。有研究对比分析了乳腺部分切除术或单纯乳房切除术并配合术后放疗与未接受放疗,MBC相关致死率及总致死率分别降低26%和36%[19]。
关于MBC的预后报道不一,有研究发现MBC生存率(包括总生存率和无瘤生存率)低于非特殊型浸润性导管癌癌,预后差,复发早[20]。也有报道称MBC预后较好,5年无瘤存活率和总存活率分别为76%和80%[21]。
4 结 论
MBC是乳腺恶性肿瘤中的罕见亚型,预后不良,诊断时需注意鉴别。深入理解乳腺化生性癌的临床病理特点对诊断该病及提出新的治疗方案具有重要意义。
