RADA16-I载氯化锂对MC3T3-E1细胞成骨能力的影响研究
2019-05-18廖媛媛李濠吉
廖媛媛,李濠吉 ,刘 敏
(西南医科大学:1口腔颌面修复重建和再生实验室;2附属口腔医院口腔修复科,四川泸州 646000;3金堂县第一人民医院口腔科)
骨缺损一直是医学领域面临的具有挑战性的课题,患者常因创伤、感染或肿瘤切除致骨组织大量丧失[1],影响功能及美观。骨的生长过程缓慢,为了加速骨愈合,近年来提出将成骨类细胞扩增以后放入可吸收的生物支架上再植入骨缺损部位的骨修复方式[2-3],其中有两个关键点,一为种子细胞的增殖,二为寻找适合的生物支架材料。目前发现有细胞因子或者药物具有促进细胞增殖及成骨的作用,如骨形成蛋白(BMP)、浓缩生长因子(CGF)等[4-5]。近年来国外不断有研究报道了锂盐能通过调控经典的Wnt信号通路来发挥成骨作用,可用于治疗骨质疏松和促进骨折愈合[6-9]。而国内鲜有关于锂盐成骨的相关报道,其作用细胞成骨的最佳剂量在国外文献中也不尽相同。作为一种新发现具有一定潜力的促成骨物质,它对细胞的影响与成骨的能力仍然值得探索。
在有足够多细胞的前提下,寻找一种能提供细胞生长的三维空间的生物支架材料越来越受到人们重视。RADA16-I是由Zhang等[10]设计出的多肽类水凝胶,它在溶液中能形成稳定的β-sheet二级结构,不与生物体发生排斥反应,能提供细胞赖以生存的三维空间,且能为细胞提供丰富的营养物质[11-13]。本实验首次将氯化锂与RADA16-I联合使用,观察二者共同使用是否更能促进细胞的增殖及成骨,为临床对骨缺损的修复以及骨增量手术提供新的修复方法。
1 材料与方法
1.1 实验材料与设备
MC3T3-E1成骨细胞株(武汉普诺赛生物);无水氯化锂LiCl(Solarbio,USA);CCK-8试剂盒(Dojindo,中国);ALP检测试剂盒(Solarbio,USA);Triton X-100(Solarbio,USA);CKX41-A32PH倒置生物显微镜(Olympus,Japan);KDC-1044低速离心机(安徽中科中佳科学仪器有限公司);Synergy2酶标仪(基因科技有限公司,中国);RADA16-Ⅰ冻干粉(海波泰生物有限公司;总RNA提取试剂盒(天根生化科技(北京)有限公司);PrimeScript RT reagent Kit(宝生物工程(大连)有限公司);SYBR Premix Ex Taq II Kit(宝生物工程(大连)有限公司);实时荧光定量(USA);扫描电子显微镜S-450(Hitachi,Japan)。
1.2 溶液配制
RADA16-Ⅰ多肽水凝胶的配置:RADA16-Ⅰ干粉使用去离子水溶解,终浓度为1%(wt/vol)。取上述溶液1 mL,加入PBS,超声混匀1 min,37℃恒温箱静置30 min。
1.3 CCK-8法检测细胞增殖情况
取对数生长期MC3T3-E1细胞消化,制成密度为5×104/mL的细胞悬浊液。每孔100μL接种于96孔板中。对照组用含5%的FBS培养基,实验组用含5 mmol/L、10 mmol/L、20 mmol/L、40 mmol/L LiCl的 5%FBS培养基,每组6个复孔,分别于1、2、3 d加入CCK-8反应2 h,测定450 nm吸光度值,确定LiCl最佳浓度。
1.4 ALP分泌活性检测
取对数生长期的成骨细胞消化并计数,将细胞以密度为2×105/mL接种于48孔板内,每孔500 μL,加不同浓度LiCl,每组5个复孔。培养5 d后,吸弃培养基,PBS清洗,加入20 μL 0.5%TritonX-100,4 ℃放置过夜后震荡,裂解离心后置于96孔板中,根据ALP检测试剂盒中说明书,加入试剂反应,在520 nm波长读取OD值,计算ALP活性。
1.6 RT-PCR检测OSX、Runx2表达
取对数期生长的小鼠前成骨细胞消化并计数,将细胞以1×106/mL的密度接种于6孔板中,待细胞贴壁后更换培养基,对照组细胞无任何处理,LiCl组加入5 mmol/L的LiCl溶液,实验组加入载LiCl的RADA16-I水凝胶,Trizol提取总RNA,按反转录试剂盒提供的实验步骤合成cDNA,本实验反转录引物名称及序列见表1,RT-PCR反应体系为蒸馏水6.4 μL,上、下游引物各0.8 μL,样品cDNA2 μL,Taq酶10 μL。RT-PCR检测OSX、Runx2 mRNA表达量。利用2-△△CT法对OSX、Runx2基因表达量进行分析。

表1PCR引物
1.7 统计学分析
数据用SPSS 17.0进行统计学分析,计量资料用均数±标准差(±s)表示,多个样本均数采用One-wayANOVA单因素方差分析,两两比较采用LSD法,P<0.05为有统计学意义。
2 实验结果
2.1 RADA16-I多肽水凝胶的性状观察
无流动性的凝胶状态,见图1。电镜下可见其内部呈多孔的三维立体结构,孔隙大小均一,表面结构凹凸有致,有利于细胞的附着,见图2。

图1 RADA16-I的水凝胶

图2RADA16-I扫描电镜图
2.2 CCK8法检测各组浓度LiCl作用下细胞活力变化
经统计学分析,细胞活力在第1 d内5 mmol/L、10 mmol/L、20 mmol/L浓度组无明显增高,差异无统计学意义。在随后的第2 d和第3 d,5 mmol/L、10 mmol/L LiCl均表现出对细胞增殖促进作用,且5 mmol/L促进作用强于10 mmol/L,差异有统计学意义(P<0.05),而20 mmol/L下的细胞数量则出现一定程度上的停止甚至减少,40 mmol/L细胞数量明显减少,细胞活力大大降低(P <0.05),见表2。

表2 各组浓度LiCl对细胞活力影响
2.3 ALP活性
5 mmol/LLiCl组对细胞ALP活性的促进作用强于其余组,差异有统计学意义(P<0.05),而10 mmol/L与对照组比较差异无统计学意义。20 mmol/L(P < 0.05)和40 mmol/L(P < 0.05)均表现出对细胞ALP活性抑制作用,见表3。

表3 ALP活性检测结果
2.4 RT-PCR检测OSX、Runx2表达
OSX、Runx2基因表达水平LiCl组和实验组较对照组都有增加。实验组的OSX及Runx2表达量较LiCl组要高(P < 0.05),见表4。
表4 OSX Runx2基因表达量(±s)
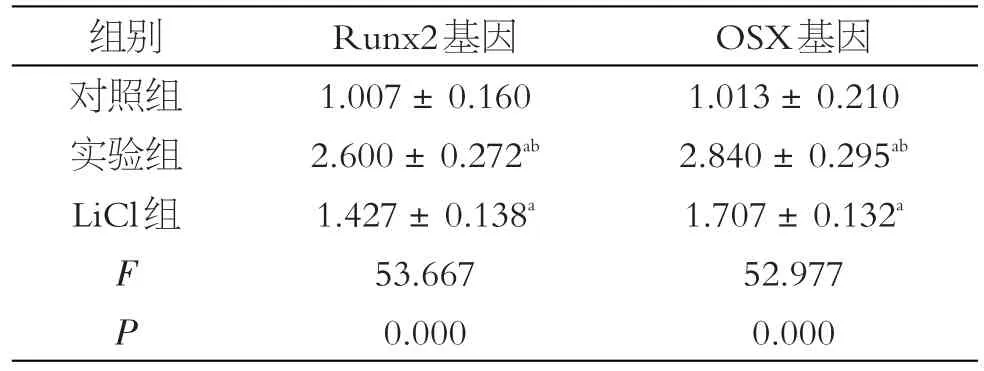
表4 OSX Runx2基因表达量(±s)
注:a与对照组相比,P< 0.05;b与LiCl组相比,P< 0.05
组别对照组实验组LiCl组OSX基因1.013±0.210 2.840±0.295ab 1.707±0.132a 52.977 0.000 F P Runx2基因1.007±0.160 2.600±0.272ab 1.427±0.138a 53.667 0.000
3 讨 论
锂盐是近年来发现的具有成骨作用的药物,锂盐促进细胞增殖的浓度,目前国外研究报道的差异较大,但总体测试浓度位于50 mmol/L以内[14-18]。鉴于使用细胞品种不同及所用试剂的差异,且目前国内鲜有关于锂盐对小鼠MC3T3-E1成骨作用的基础研究,本次研究则选择该细胞进行实验,探讨锂盐对其增殖及成骨能力的影响。LiCl浓度在5 mmol/L时,能显著促进细胞的增殖,10 mmol/L虽然同样也能促进细胞增殖但无5 mmol/L明显,二者间有统计学差异。随着剂量增加,在20 mmol/L浓度下LiCl表现出对细胞的抑制作用,同对细胞增殖的影响相似,LiCl对细胞成骨向分化的作用也是双向的。本次研究中发现锂盐浓度在5 mmol/L与其余三组浓度比较能最大程度的促进细胞增殖与成骨,可选用该浓度作为下一部分实验浓度。但鉴于实验中所选浓度的局限性与作用时间关系,并不能完全认为该浓度为促进细胞增殖的最适浓度。关于LiCl作用浓度一直存在争议[19-20]。究其原因,可能与LiCl成骨机制及外部条件有关。目前相关研究表明LiCl成骨机制主要是调控Wnt信号通路,该通路是调节细胞增殖与分化的主要途径,而对于该机制目前仍在继续研究中[11]。
组织生物工程中支架材料是指能与活体细胞结合并植入生物体不同组织,为细胞提供生长环境,促进细胞增殖与分化的一类生物材料。国外一项Meta分析表明,细胞是否加载生物支架,结果差异明显,通过将成骨细胞添加到生物材料支架中,可以提高种植体周围骨的再生和骨整合[21]。在制备1%(W/V)RADA16-I水凝胶过程中发现,RADA16-I溶液的流动性与水无明显差异。通过盐溶液触发的自组装行为,溶液在较短的时间内形成凝胶状物质,体积无明显变化,能黏附在管底不脱落,这使得在修复骨缺损类模型中,加入的水凝胶不会因体位变化或关节的运动而大量流失。临床上骨缺损常不规则,有时甚至位于肉眼不可见或者充填器械无法达到的深处,RADA16-I水凝胶前期的流动性可使得它能适应各种不规则形态充满骨缺损的每个角落,随后立马凝胶化维持形态,使药物能持续作用周围成骨细胞。通过观察,RADA16-I形成凝胶的时间在30 min以内,不至于因形成时间过长导致液体大量流失使成骨效果大打折扣。
RADA16-I单独使用即可促进细胞增殖,还能诱导细胞成骨向分化,使成骨活动更加活跃,也可作为支架材料或载药缓释系统使用。文献报道,RADA16-I能对新西兰兔髂骨缺损模型起到止血及加速成骨的双重作用[22]。本次研究中第一部分选取了一个能促进细胞增殖及成骨的LiCl浓度值,再将该浓度下的LiCl加入到RADA16-I中共同培养细胞4 d后,通过real-time PCR对提取的OSX、Runx2 mRNA定量分析。实验发现负载LiCl的RADA16-I成骨细胞相关特异性转录因子OSX、Runx2表达量较单独使用LiCl增加(P<0.01),这提示了二者联合使用比单独LiCl处理对细胞成骨作用更明显。
骨组织的愈合本身是一个相对漫长的过程,完全愈合一般需要3~6个月甚至更久,多肽水凝胶本身为氨基酸易被机体代谢,而本次实验所选择的作用时间也相对较短,实验结果可以表明负载LiCl的RADA16-I能促进细胞早期成骨,对于远期效果目前无法确定,但有相关研究对SD大鼠股骨缺损模型应用RADA16-I,观察到8周、12周的骨缺损周围新骨生成较PBS治疗组高[23],由此可见,多肽水凝胶的远期成骨效果仍值得期待。
4 结 论
LiCl及载LiCl的RADA16-I均能提高OSX、Runx2表达水平,促进细胞成骨。但载LiCl的RADA16-I较单独使用LiCl成骨相关基因的表达更显著,成骨效果更佳。
