利用HRM技术鉴定db/db小鼠基因型方法的建立
2019-05-18谭睿陟刘彤彤张宇韦
林 晓,谭睿陟,刘彤彤,张宇韦,王 丽
(西南医科大学附属中医医院中西医结合研究中心,四川泸州 646000)
随着我国生活水平不断提高,糖尿病等慢性代谢疾病的发病率呈直线上升趋势[1],严重威胁到人类健康,已成为较大的医疗负担[2]。
db/db小鼠为美国Jackson实验室研发,该小鼠4号染色体的瘦素受体等位基因突变形成了自发性的糖尿病。db/db小鼠没有繁殖能力,将杂合子db/m与db/m进行交配,繁殖的后代有三种表型:1/4的野生型m/m,1/2的杂合子db/m,1/4的纯合子db/db。db/m和m/m在体型上相似,它们的血糖、体重、血浆都正常。但是由于m基因对代谢影响较大,所以m/m与db/m相比,代谢效率更高,更容易耐受饥饿。而db/db在2周龄左右即出现高胰岛素血症,3到4周龄明显肥胖,4到8周龄出现高糖血症,并表现出多食,消渴,多尿等典型糖尿病的临床表现,其肾脏,心血管,末梢神经等多个系统可观察到病理变化,在研究糖尿病发病机制及治疗方面具有较高的应用价值[3-4]。HRM(high resolution melting),即“高分辨率熔解曲线”,是最近在国内外兴起的最新SNP及突变研究工具,具有简单、快速、高通量、低成本的特点,可用于突变扫描,基因分型和甲基化研究。该技术在标准qPCR试剂的基础上再加入饱和双链DNA结合染料即可进行,无需序列特异性探针,直接运行高分辨率熔解曲线,即可完成对样品基因型的分析。由于纯合db/db小鼠基因型鉴定困难,常用的小鼠基因型鉴定方法酶切法和DNA测序法费时费力,成本相对较高。本文采用HRM技术建立了对db/db小鼠基因型鉴定的方法,并对其结果的准确性和一致性进行了验证[4-5],现总结报告如下。
1 材料与方法
1.1 材料
1.1.1 实验动物
db/db小鼠(BKS.Cg-Dock7m+/+Leprdb/J,Jax编号:000642)购于Jax Lab。于SPF级实验动物中心常规饲养,在饲养期间每日给予小鼠足够的SPF级饲料和新鲜的饮用水,室温20~22℃,相对湿度60%~70%,光照12 h明暗交替。在出生3周左右剪取鼠尾提取DNA,利用HRM技术鉴别野生型(m/m),杂合子(db/m),纯合子(db/db)[6]。
1.1.2 实验试剂
2×Super EvaGreenMaster Mix for HRM试剂盒购于US Everbright;DNA提取试剂:SDS购于上海伯乐生命医学产品有限公司,Tris、EDTA购于上海生工工程股份有限公司,蛋白酶K购于上海艾研生物科技有限公司;酶切试剂:Taq polymerase购于北京全式金生物技术有限公司,dNTP、AfaI、0.1%BSA、10×buffer购于Takara。
1.1.3 实验仪器
主要仪器LightCycler®480 II实时荧光定量PCR仪 ,MSC-100ThermoShakerIncubator,Nano-Drop2000 Spectrophotometer,BIO-RAD PowerPac Basic电泳仪及电泳槽,Veriti™96-Well Thermal Cycler。
1.2 方法
1.2.1 模型小鼠DNA提取
酚氯仿提取法:剪取0.3~0.5 cm小鼠尾巴,放入1.5 mL EP管;加入190 μL裂解液和10 μL蛋白酶K(10 mg/mL),55℃,750 r/min过夜震荡,使之充分消化;加入10 μL RNA酶(20 mg/mL),混匀,37 ℃恒温箱中放置1 h后13 000 r/min离心5 min,取上清到新的1.5 mL EP管中;加入等体积(200 μL)的酚∶氯仿∶异戊醇=25∶24∶1,反复颠倒 20次后室温放置5 min;4℃下13 000 r/min离心5 min,转移上层水相(约200 μL)至一新的1.5 mL EP管中;加入等体积(200 μL)异丙醇沉淀DNA,反复颠倒离心管20次,13000 r/min,15 min收集沉淀的DNA;小心倾倒出异丙醇。将DNA沉淀浸没于1 mL 70%乙醇里。如果沉淀比较松散,再离心5 min。倾倒除去乙醇,开盖在室温下放置15~20 min或在37℃孵育箱中放置5 min,让乙醇充分挥发(此步骤重复两次);加入50 μL ddH2O,轻微震荡使DNA沉淀溶解,-20℃保存备用。
改良后的DNA提取方法:剪取小鼠尾端约0.5~1 cm,放入1.5 mL EP管中;每管加0.5 mL裂解液[0.5%SDS,0.05 M Tris-HCL(pH 8.0),2.5 mM EDTA,0.1 M Nacl]和 50μl蛋白酶 K(100 μg/mL)[7],55 ℃震荡过夜;第2 d将样本,12 000 r/min,4℃,离心 10 min;收集上清加入1.5 mL EP管中,加1 mL100%乙醇,盖紧盖子后轻摇,可见絮状沉淀;13 000 r/min,离心15 min,弃上清;加70%乙醇1 ml,洗涤,13000 r/min,离心10~15 min;弃上清,收集沉淀,室温放置10~15 min;每管加100 μL ddH2O,盖好后在室温放置1 h或数小时使之充分溶解;待DNA全部溶解后-20℃保存(如DNA溶解不完全,在37℃水浴中放置30~60 min,但不可过夜)。
1.2.2 引物的设计与合成:
根据Geenbank中Lepr基因序列(NC_000070),设计用于PCR扩增的引物,见表1、表2。

表1 用于HRM的正向和反向引物
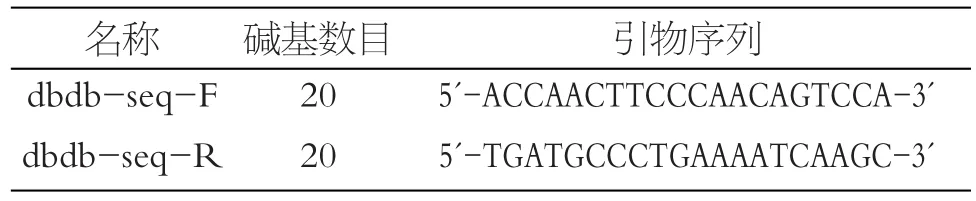
表2 用于DNA测序的正向和反向引物
1.2.3 反应体系及条件
PCR扩增及HRM分型:PCR扩增及HRM分型在LightCycler®480 II实时荧光定量PCR仪上完成,使用包含一种专为qPCR和高分辨溶解曲线分析设计的DNA结合染料的2×Super EvaGreen Master Mix for HRM试剂盒(US Everbright Inc.),在PCR仪上运行Gene Scanning选项对PCR扩增产物进行分析。最初的反应体系:2 × Mix for HRM 10 μL;primer hrm F+R 1 μL;DNA模板(10 ng/uL),1 μL;ddH2O8 uL;优化后的反应体系:2× Mix for HRM 5 uL;primer hrm F+R 1.5 uL;DNA模板(5 ng/μL)1 μL;dd H2O 2.5 μL。最适反应条件:pre-incubation,95 ℃ 2 min;amplication,95 ℃ 10 s,58 ℃ 10 s,72 ℃ 10 s,45个循环;HRM,95 ℃ 1 min,40 ℃ 1 min,65 ℃ 1 s;cooling 1 h。
测序法:PCR扩增体系10 × buffer 2 μL;PrimerF 0.5 μL;PrimerR 0.5 μL;dNTP 1 μL;Taq polymerase 0.2 μL;ddH2O 14.8 μL;DNA 1 μL;然后在PCR仪直接运行“Genotyping”程序(stage 1:95℃ 5 min;stage 2:95 ℃ 30 s,50 ℃ 45 s,68 ℃ 1 min,35个循环;stage 3:68℃ 10 min,16℃ ∞。)PCR完成后,用1%的胶点样2 μL检测是否有条带,将有条带的阳性样本送上海生物工程有限公司测序。
1.2.4 血糖测定
糖尿病小鼠会出现糖代谢紊乱,所以在小鼠空腹12 h后,抽取尾尖静脉血测定其血糖含量,从出生后第8周龄开始,每隔一周检测一次,持续一个月,观察三种基因型小鼠的血糖变化趋势。
1.2.5 数据统计
数据结果采用SPSS 17.0进行统计分析,计量资料用均数±标准差(±s),多个样本均数比较采用单因素方差分析(one-way ANOVA),两两比较用LSD法,P<0.05为差异具有统计学意义。
2 结 果
2.1 改良DNA提取方法与常规方法的结果
对所提取的DNA测定其在260 nm和280 nm处的吸光度值,通过A260/A280的比值判定DNA的纯度。检测结果显示,用常规方法提取的DNA其A260/A280比值多数小于1.8,提示可能存在蛋白质污染;而改良方法提取的DNA其A260/A280比值多为1.8~2.0,纯度较高,说明改良DNA提取方法比常规方法更优。
2.2 利用HRM技术进行基因鉴定的三种分型结果
由于野生型,纯合子,杂合子三种基因型具有不同的核酸序列,溶解曲线有所差异,据此可以分辨出三种基因型。在所设计的反应条件下对样品进行鉴定,能够准确区分出野生型(m/m),纯合子(db/m),杂合子(db/db),见图1。
2.3 HRM反应条件优化结果

图1 利用高分辨溶解曲线(HRM)分析技术对db/db小鼠的基因分型结果
本实验设计了三种不同退火温度,分别是58℃、62℃、65℃,最后的结果表明当退火温度为58℃时更能准确地区分出三种基因型的熔解曲线。通过对退火温度的优化,找到最适反应条件,提高了分型准确性。当所用DNA模板浓度和其他试剂用量减半,也能获得良好的分型结果,在很大程度上节约了实验成本。
2.4HRM分型结果与DNA测序法结果一致
将用qPCR-HRM已经分型的三种基因型样品,再用DNA测序方法进行验证。结果显示HRM分型结果与DNA测序法分型结果一致,证明HRM分型结果的准确性(见图2)。
2.5 HRM分型结果与小鼠表型一致
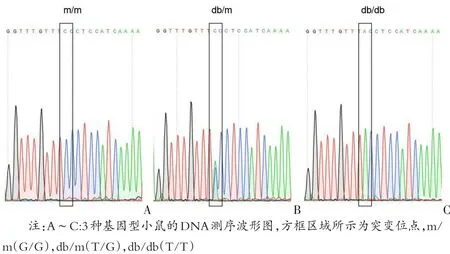
图2 db/db小鼠的DNA测序分型结果
小鼠在出生三周左右就被减尾鉴定基因型,在剪去尾后继续饲养观察。在出生2~3个月后,与野生型和杂合子相比,db/db小鼠多饮,多食,多尿症状明显,体重大幅度上升,差异具有统计学意义(F=1015,P<0.000 1)。测定空腹状态下db/db小鼠的血糖,可高达20 mmol/L,耐受糖的能力明显下降。表明HRM分型结果是准确的,小鼠表型符合预期结果(见图3)。
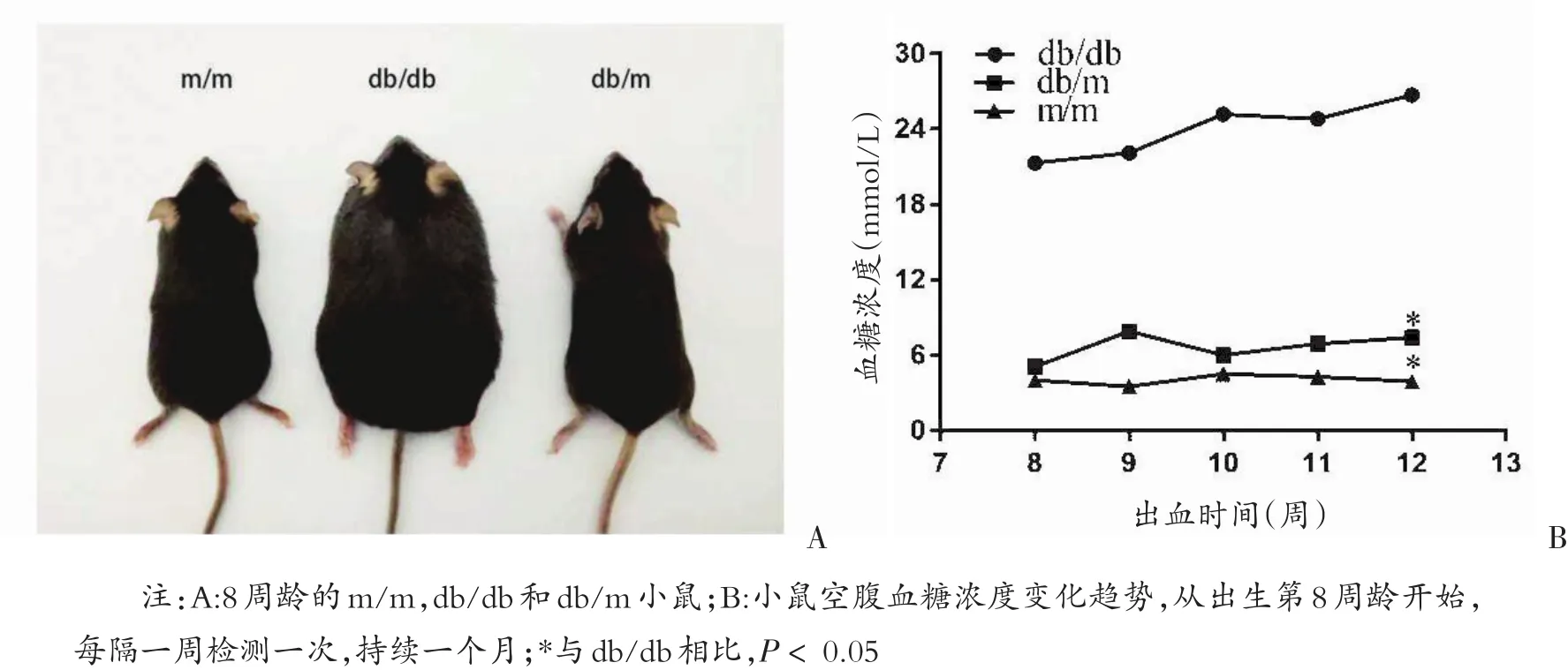
图3 通过HRM鉴定的三种基因型小鼠的表型
3 讨论
糖尿病在我国乃至全世界其发病率均呈逐年上升趋势,已经成为全世界致死率极高的疾病之一。因其病因复杂,与多种因素相关,在研究和治疗糖尿病方面还有诸多问题亟待解决。与以往用的ob/ob小鼠相比,db/db小鼠糖尿病的发病进程与人类T2DM相似,病程长,病情稳定,“三多一少”合并肥胖症状明显,是现在应用较为广泛的一种糖尿病模型。而对于只是发生点突变的糖尿病小鼠模型的基因检测,采用常规的基因测序和酶切法普遍存在耗时长,过程复杂,难以实现高通量需求等问题。HRM技术是近几年兴起的一种检测技术,通过PCR扩增产物的溶解曲线,能分析检测出基因序列之间的微小差异[8-9]。本实验利用HRM技术建立了db/db小鼠的基因分型方法,减少了DNA提取样品和试剂的消耗,并且通过对退火温度的优化,使其准确度和稳定性更高。该方法省时省力、交叉污染小、结果准确度高,在批量进行db/db小鼠基因鉴定上值得大力推广。
3.1 改良DNA提取方法,获得纯度较高的DNA产物
与以往的DNA提取方法相比,本实验采用了改良后的DNA提取法。因酚保存时间短,容易造成DNA产量降低和DNA碎片,从而会影响后面的基因分型结果[7]。而改良后的方法操作简便,大大减少了交叉污染的几率,并且能够得到高纯度的DNA,提高基因分型的准确性,适用于提取大量样品。
3.2 优化后的HRM方法鉴定db/db小鼠省时省力,准确度高
随着对基因领域研究的不断深入,传统的测序和酶切方法操作繁琐,耗时长,而近几年兴起的HRM技术能够具有高通量,快速,准确度高,稳定性好的特点[10]。在临床研究,疾病诊断方面受到了很多科学家的赏识。另外,Gene Scan是一种用途十分广泛的DNA片段分析技术,是将荧光标记的DNA片段,如PCR产物,在测序仪上对其进行片段大小、拷贝数量分析检测的过程。用HRM方法分析样品时,需要用到Gene Scan对PCR扩增产物进行数据分析,以保证结果的准确性[11-12]。
本文以db/db小鼠为例,建立了qPCR-HRM基因分型方法,分型结果与DNA测序法结果高度一致,且分型结果与小鼠表型所体现出来的疾病状态一致,说明该方法鉴定db/db小鼠基因型的可靠性。通过对HRM反应退火温度进行优化,找到了最适的退火温度,能够更加准确清楚的分辨出三种基因型的熔解曲线。在减少了DNA模板的浓度和反应体系的体积之后,PCR扩增依然能达到平台期,没有发生非特异性扩增,效果好,在一定程度上减少了消耗。与DNA测序法相比,大大缩短了实验时间,操作简便,省时省力。整个扩增过程中为闭管操作,污染小,同时一次可分析大量样品,可用于大批样本的检测。
4 结论
随着市场对db/db糖尿病小鼠模型的需求增加,利用HRM方法能够提高鉴定db/db小鼠基因型的效率,利于db/db小鼠大规模生产,并且也寄希望于进一步应用到其他与db/db小鼠相似的小鼠模型的基因鉴定当中去。
