基于原生质体法保加利亚乳杆菌电转化条件的研究
2019-05-18王莎莎卢海强田洪涛罗云波
郭 鑫 王莎莎 李 晨 卢海强 田洪涛* 罗云波
(1 河北农业大学食品科技学院 河北保定071001 2 中国农业大学食品科学与营养工程学院 北京100083)
乳酸菌是正常人肠道中重要的生理菌群,具有维持人体中微生态平衡的作用,与人体健康息息相关。目前,乳酸菌转化载体DNA 的方法主要有电转化法和原生质体转化法。与电转化法相比,原生质体转化法的设备条件要求较低、方法简单、结果可靠,具有明显的技术优势,而实现乳酸菌原生质体转化的关键步骤是原生质体的制备与再生[1]。近年来,已有关于嗜热链球菌、嗜酸乳杆菌、保加利亚乳杆菌、 干酪乳杆菌及瑞士乳杆菌等乳酸菌原生质体制备、再生及融合方面的研究报道[2-6]。
保加利亚乳杆菌属于化能异养型微生物,是酸奶及发酵乳饮料在储藏期间发生后酸化的主要菌株,其具有非常强的产酸能力和耐酸性,同时具有产香的特性使酸奶具有特殊的香气。鉴于保加利亚乳杆菌的重要益生作用与特点,对其进行深入研究至关重要。
本研究以质粒pMG36e 为载体,保加利亚乳杆菌Lb-MH 为受体,采用原生质体电转化方法研究溶菌酶浓度、质粒浓度、电转化参数、复苏培养基组成对电转化效率的影响,建立最佳的转化条件,提高电转化效率,为进一步乳杆菌的改造和基因功能探究奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒 保加利亚乳杆菌MH(Lactobacillus delbrueckii subsp.bulgaricus,MH)来自本试验分离的优良菌种。质粒pMG36e,由中国科学院微生物研究所赠送;大肠杆菌-乳酸乳球菌穿梭组成型表达载体,保存于大肠杆菌DH5α 中;乳酸乳球菌复制子pWV01,滚环型复制(RCR),大小3.6 kb;启动子P32;红霉素抗性标记(Emr);多克隆位点(MCS)。
1.1.2 培养基及缓冲液
1)MRS 培养基:参照文献[7]配制MRS 液体或固体培养基,调节pH 6.4~6.8,115 ℃灭菌20 min,室温冷却备用。
2)SMRS 培养基:含有0.5 mol/L 蔗糖的MRS培养基。
3)含2%甘氨酸的SMRS 培养基:用蒸馏水配成40%的甘氨酸母液,115 ℃20 min 灭菌,使用时取0.5 mL 加入SMRS 培养基中。用来培养受体细胞,制成原生质体。
4)再生培养基RM1:液体MRS 培养基。5)再生培养基RM2:液体SMRS 培养基。
6)再生培养基RM3[8-9]:在不含Tween 80 的MRS 培养基中添加CaCl22.8 g/L,MgCl25.0 g/L,蔗糖171.2 g/L,胎牛血清(BSA)5.0 mL/L。
7)再生培养基RM4[10]:以甘露醇91.0 g/L 代替RM3 中的蔗糖,其它成分和配制方法相同。
8)原生质体制备液[11](SMM):0.5 mol/L 蔗糖,顺丁烯二酸0.019 mol/L,MgCl20.02 mol/L,用1 mol/L NaOH 调pH 值至7.8。
9)电击缓冲液 (PB):0.5 mol/L 蔗糖,10%的甘油,调pH 值至7.0。
1.1.3 酶和试剂 红霉素用无水乙醇配成质量浓度为2.5 mg/mL 的母液,0.22 μm 微孔滤膜过滤,于-20 ℃保存备用;Taq DNA 聚合酶为大连宝生物公司产品;溶菌酶(20.000 U/mg):购自上海生工。
1.1.4 主要仪器 PC Module & Gene Pulser X cell:BIO RAD;0.1 cm 规格电转杯;BiometraTprofessional PCR 仪,德国Biometra;高速台式冷冻离心机(型号20G),上海安亭科学仪器厂。
1.2 试验方法
1.2.1 大肠杆菌DH5α 中质粒(pMG36e)的提取及定量检测
1)大肠杆菌DH5α 中质粒(pMG36e)的提取:采用SDS 碱裂解小量分离大肠杆菌质粒的方法。
2)质粒(pMG36e)的定量检测:质粒 DNA(μg/mL)=OD260×50(μg/mL)×稀释倍数
1.2.2 筛选转化子的红霉素浓度的确定 配制不同 含 量0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0,6.0,7.0,8.0,9.0,10.0 μg/mL 红霉素的MRS 平板,进行涂布生长,到达对数期的保加利亚乳杆菌05-20 在37 ℃静止培养2~3 d 观察结果,根据抗生素平板上保加利亚乳杆菌菌落的生长情况确定筛选转化子的红霉素浓度。
1.2.3 原生质体的制备 将保加利亚乳杆菌菌粉活化3 次,镜检,平板划线挑取单菌落,37 ℃培养16~18 h,以1%接种量转接到含2%甘氨酸的10 mL SMRS 培养基中,37 ℃培养16 h,4 ℃,12 000 r/min,离心2 min 收集菌体,加预冷的SMM 缓冲液洗涤3 次离心去上清,用质量浓度为10,20,30,40 mg/mL 的溶菌酶重悬,37 ℃酶解。0.5 h 后每10 min 取样进行革兰氏染色后用光学显微镜观察原生质体形成情况,待视野内原生质体的形成率达60%~70%即可终止酶解反应。酶解结束后以加入1 mL 冰冷的电击缓冲液PB,3 500 r/min,10 min,4 ℃离心收集原生质体。再用电击缓冲液洗涤3 次后重悬于电击缓冲液中,以50 μL 每支分装于预冷的无菌EP 管中,-80 ℃储存备用。
1.2.4 电转化 分别取1 μL 质量浓度为0.2,0.4,0.6,0.8,1.0,1.2,1.4 μg/μL 的质粒pMG36e(大肠杆菌中提取)加入50 μL 原生质体,混合后冰浴5 min。另取一支50 μL 原生质体不加入质粒作为对照。将混合液加入预冷的电转杯中(0.1 cm),使用BIO-RAD 电转仪,设置相应的电转化参数,进行电击。电击后立即向电转杯中加入950 μL 再生培养基,混匀后倒入无菌EP 管中。于37 ℃水浴复苏培养,取用复苏培养基梯度稀释后的电击转化细胞液100 μL,涂布到含相应浓度红霉素的MRS 平板上,于37 ℃倒置培养2~3 d 后,对转化子进行计数并计算转化效率。
转化效率:即每微克外源DNA 所能产生的转化子数。转化效率=转化子数/加入的DNA 量(μg)×稀释倍数
1.2.5 正交试验确定影响电转化效率的因素 用不同的溶菌酶浓度、质粒浓度、电场强度、再生培养基进行四因素四水平的正交试验,筛选电转化保加利亚乳杆菌Lb-MH 的最优条件(表1)。
1.2.6 保加利亚乳杆菌MH 阳性转化子的鉴定随机挑取红霉素筛选平板上的单菌落于含红霉素的10 mL 液体MRS 培养基中,37 ℃置培养16~18 h,进行菌液PCR。根据pMG36e 的红霉素抗性和终止子相关基因序列分别设计引物,即:pMG36e1:5’-CAATTCCTGCATGTTTTAAGG-3’;pMG36e2:5’-GAGGATGAGGAGGCAGATTG-3’,采用常规方法进行PCR 扩增,预期PCR 产物为800 bp。然后采用乳酸菌提质粒方法[12]对阳性菌株进行提质粒验证。

表1 保加利亚乳杆菌正交试验因素水平表Table 1 Factors and levels of orthogonal test on the Lb-MH
2 结果
2.1 溶菌酶浓度对电转化效率的影响
将保加利亚乳杆菌MH 在一定培养条件下培养至对数中期经洗涤缓冲液Ⅰ洗涤,并配成质量浓度分别为10,20,30 和40 mg/mL 的溶菌酶酶液在37 ℃酶解,至镜检时视野内出现60%左右原生质体,加入1 μL 质量浓度为1 μg/uL 的从大肠杆菌中提取的质粒pMG36e,用2 mm 电转杯按电阻200 Ω,电容25 μF,电场强度7.5 kV/cm 进行电击,之后用RM3 作为再生培养基进行复苏培养,最终获得的电转化效率如图1。
2.2 质粒浓度对电转化效率的影响
将保加利亚乳杆菌MH 在MRS 培养至对数中期接至含甘氨酸浓度最适的SMRS(即分别含甘氨酸2%)中继续培养至对数中期,收获菌体后以洗涤缓冲液Ⅰ处理,采用溶菌酶进行酶解,制成原生质体后加入1 μL 不同浓度的质粒进行电转化结果见图2。
2.3 电场强度对电转化效率的影响

图1 不同溶菌酶浓度对保加利亚乳杆菌MH 电转化效率的影响Fig.1 Effects of different Lysozyme concentrations on electrotransformation efficiency with Lb-MH
电转化过程中每个因素都可能对电转化效率造成影响,相对来说电场强度是对其影响较大的因素。本试验采用0.1 cm 的电转杯,在电容为25 μF,电阻为200 Ω 固定不变的条件下。选取6.0,6.5,7.0,7.5,8.0,8.5,9.0,9.5 和10.0 kV/cm 等几个不同的电场强度,研究电场强度对保加利亚乳杆菌MH 电转化效率的影响。
由图3可知,在固定电阻为200 Ω,电容为25 μF 时,开始电转化效率随电场强度的增加而提高,当电场强度达到8.0 kV/cm 时,转化效率达到最高,随后随着电场强度的增加电转化效率反而下降。造成这种现象的原因可能是,当电场强度过低时不能使细胞膜形成孔洞,致使外源DNA 分子不容易进入细胞[13],而电场强度过高时细胞死亡率会增大。所以在一定范围内电场强度越强时,细胞膜上产生的孔洞越多,通透性越好,外源DNA分子越易进入细胞,电场强度过高或过低都会降低转化效率。
2.4 复苏培养基对电转化效率的影响
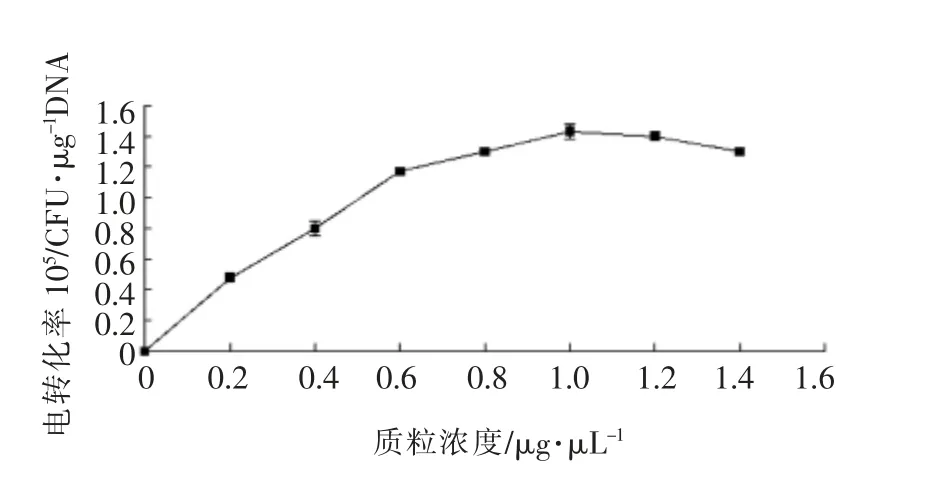
图2 质粒浓度对保加利亚乳杆菌MH 电转化效率的影响Fig.2 Effects of plasmid concentrations on electrotransformation efficiency with Lb-MH
将保加利亚乳杆菌MH 在MRS 培养至对数中期后分别转接至含甘氨酸浓度最适的SMRS(即分别含甘氨酸2%)中继续培养至对数中期,收获菌体后以洗涤缓冲液Ⅰ处理,用30 mg/mL 溶菌酶进行酶解,制成原生质体后加入1 μL 质量浓度为1 μg/μL 的质粒,用2 mm 电转杯按电阻200 Ω,电容25 μF,电场强度7.5 kV/cm 进行电转化,分别以RM1、RM2、RM3 和RM4作为再生培养基,测得其对应电转化效率见图4。
由于电击使细胞膜产生孔洞,致使细胞在非高渗液中容易破裂,因此细胞在电击后必须在高渗的培养基中进行复苏。本试验在电击完毕后分别向电转杯中加入950 μL 的RM1、RM2、RM3、RM4 液体培养基,混匀后倒入无菌EP 管中,37℃培养。探究复苏培养基对电转化效率的影响。
在其它条件相同的情况下,用RM3 作为再生培养基比使用RM1、RM2、RM4 获得的电转化效率有大幅度的提高。方差分析显示:RM1、RM2 和RM3 复苏培养基对电转化效率的影响差异极显著(P<0.01),RM3 再生培养基的效果最好。因此后续研究选RM3 作为复苏培养基。
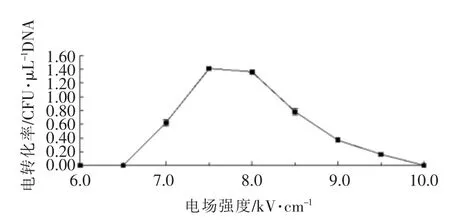
图3 电场强度对保加利亚乳杆菌MH 电转化效率的影响Fig.3 Effects of electric filed strength on electrotransformation efficiency with Lb-MH

图4 再生培养基对保加利亚乳杆菌MH 电转化效率影响Fig.4 Effects of incubation medium components on electrotransformation efficiency with Lb-MH
2.5 正交试验优化
分析结果表明,影响保加利亚乳杆菌MH 电转化效率的4 个因素主次顺序为:电场强度>复苏培养基>质粒浓度>溶菌酶浓度(表2),而保加利亚乳杆菌电转化的最适条件为C2D3B3A2,即场强为7.5 kV/cm,复苏培养基Ⅲ,质粒质量浓度1.2 μg/μL、溶菌酶质量浓度30 mg/mL。按此最优条件进行试验验证,重复3 次取平均数,电转化效率达到1.42×105CFU/μg DNA。对阳性转化子进行PCR 及提质粒验证。

表2 正交试验优化电转化保加利亚乳杆菌的条件Table 2 Results of orthogonal tests for optimizing electro transformation of Lb-MH
2.6 转化子的鉴定
2.6.1 阳性转化子PCR 鉴定 从红霉素筛选平板上随机挑取10 个单菌落,接入新鲜的含红霉素质量浓度为0.5 μg/mL 的MRS 液体培养基中,37℃培养16 h。经菌液PCR 后,电泳检测结果表明,在800 bp 左右均出现了与目的条带大小吻合的条带。表明含有Emr 的PMG36e 质粒已成功电转化到保加利亚乳杆菌MH 中。
2.6.2 提质粒鉴定 保加利亚乳杆菌MH 转化子进行质粒提取,经电泳检测结果可知,保加利亚乳杆菌MH 转化子中提取的质粒分子质量大小与从大肠杆菌DH5α 中提取的质粒大小一致(3 610 bp),即证明质粒pMG36e 成功转入保加利亚乳杆菌MH 中。
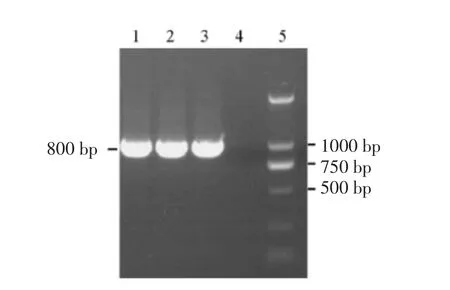
图5 保加利亚乳杆菌MH 转化子菌液PCR 图Fig.5 The detection of plasmid in Lb-MH by colony PCR

图6 保加利亚乳杆菌MH 质粒图Fig.6 Agarose gel electrophoresis of plasmid Lb-MH
3 讨论
电转化方法是细菌、 真菌等微生物体内导入外源基因的常见方法之一,该方法操作简单方便,近年来已广泛应用于乳酸菌的转化中。电转化的原理是利用高压电脉冲使细胞膜发生瞬间的可逆穿孔,从而使游离的外源DNA 穿过细胞膜转移到细胞中。然而由于其存在转化率低、重复性差等缺点,已成为制约乳酸菌分子生物学研究和基因工程技术发展的关键因素。本研究针对影响电转化效率的几个主要因素——溶菌酶浓度、 质粒浓度、电场强度、复苏培养基组成等进行了研究,探明电转化的最适条件,成功实现了保加利亚乳杆菌的高效遗传转化。
本研究发现,在其他条件一定的情况下,保加利亚乳杆菌在7.5 kV/cm 时达到最高的电转化效率,这可能跟乳酸菌细胞璧厚度有关。有文献表明变溶菌素对于弱化细胞壁制备原生质体效果更佳,但其成本较高。因此本试验通过适当提高溶菌酶浓度,并配合最适洗涤缓冲液,在保证适宜的pH 和离子条件下也可实现较高的原生质体制备率,因为在原生质体制备过程中,缓冲液通过洗涤细胞使其处于理想的离子环境中。本研究结果表明溶菌酶质量浓度为30 mg/mL 可提高转化效率。外源质粒的浓度对电转化效率也有影响。1989年Mcintyre 研究发现在细胞浓度不变的情况下,添加不同浓度的外源质粒,得到的转化子数目也会发生变化[15]。质粒DNA 浓度过低或过高时转化效率都有所下降。本研究发现在细胞浓度一定,DNA质量浓度为1.2 μg/μL 时电转化效率最高。细胞在经过电击后,可直接涂布在含有抗生素的平板上,或在不含抗生素的液体培养基中复苏一段时间,再涂布于含抗性的固体平板上,两种方法对转化效率有很大的影响[15]。Wei 等[16]研究发现后者比前者转化效率高60~80 倍。除此之外,对于电击后菌体复苏来说,除去复苏时间的影响,复苏培养基中的成分也起着很大作用,如蔗糖有利于细胞膜的恢复,并且可使细胞在渗透压突然改变的情况下不致死亡。只有复苏培养基中含有的稳定剂能够提供菌体所需要的营养成分和渗透压,才会提高细胞的存活率,从而提高转化效率。
综上所述,本试验中确定了质粒pMG36e 电转化保加利亚乳杆菌Lb-MH 的最适参数,为外源基因电转化保加利亚乳杆菌提供了可靠的参考数据。同时为乳杆菌进一步改造和基因功能探究以及遗传育种、菌种改良奠定了基础。
