黄曲霉毒素M1与赭曲霉毒素A联合作用诱导分化Caco-2细胞凋亡的机制
2019-05-18高亚男王加启
张 焕 高亚男 郑 楠 王加启 任 辉*
(1 吉林大学食品科学与工程学院 长春130022 2 中国农业科学院北京畜牧兽医研究所 动物营养学国家重点实验室 北京100193 3 中国农业科学院北京畜牧兽医研究所 农业部奶及奶制品质量监督检验测试中心(北京)北京100193)
黄曲霉毒素(aflatoxin,AFs)是寄生曲霉和黑曲霉等曲霉菌属的次生代谢产物[1],包括黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素G1(aflatoxin G1,AFG1)和黄曲霉毒素G2(aflatoxin G2,AFG2)。干旱、高温、存储时间和条件等自然环境会影响霉菌的生长和AFs的产生[2]。其中AFB1的毒性最强,具有致癌、致畸、致突变的作用[3],被国际癌症研究机构列为I 类致癌物[4]。哺乳动物摄入被AFB1污染的饲料或食品后,通过羟基化作用将AFB1转化成黄曲霉毒素M1(aflatoxin M1,AFM1)[5]。AFB1在机体内的转化过程如图1所示[6]。AFM1热稳定性较强。Oruc 等[7]对奶和奶制品中黄曲霉毒素的调查发现,在奶酪存储期间黄曲霉毒素稳定性强,AFB1能在传统奶酪中保持活性90 d 以上。
赭曲霉毒素A(ochratoxin A,OTA)是由多种曲霉和青霉菌产生的次生代谢产物[8],广泛存在于谷物和肉类等食品和饲料中[9]。其残留在动物体内具有肾毒性和免疫毒性,引发癌变畸变[10-11]。然而,没有确切的证据能够证实OTA 导致肾病和癌症的发生[12],其与肠道上皮细胞的相互作用的研究也较少[13]。动物实验表明,高浓度的OTA 导致大鼠、狗、猪和鸡肠黏膜损伤[14],改变肠道细胞膜通透性,引起快速炎症反应,引发胃肠道功能紊乱,腹泻,呕吐和营养不良等症状[15-16]。OTA 与AFM1毒性相当,同样存在于牛奶中,研究OTA 与AFM1联合作用,对于奶制品中霉菌毒素的风险评估工作具有重要意义。
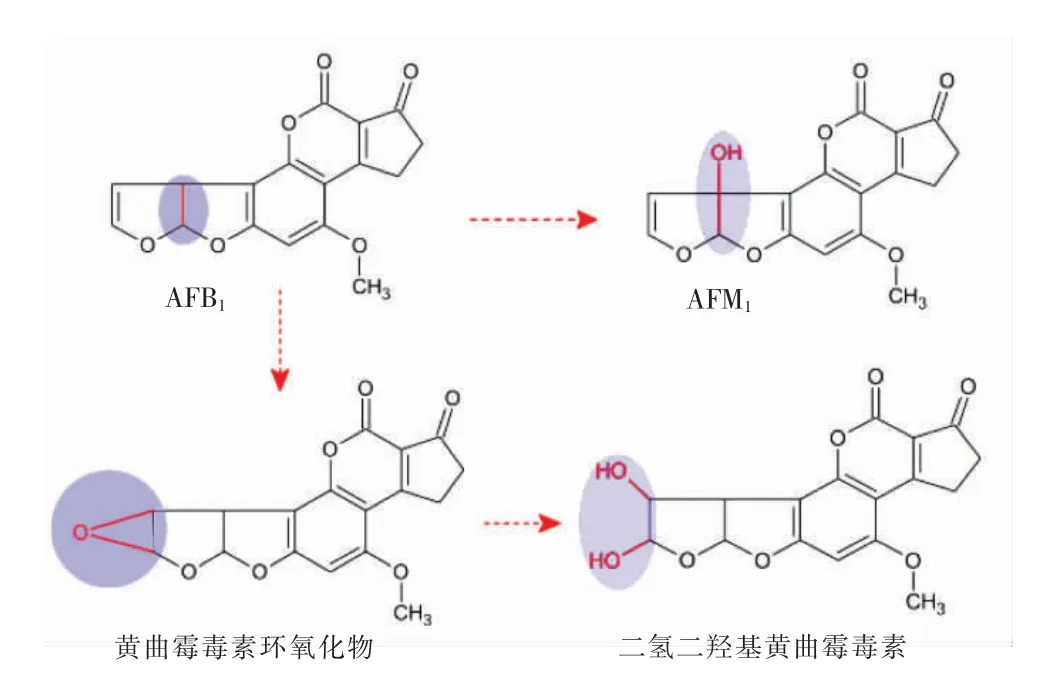
图1 肝脏中黄曲霉毒素的转化Fig.1 Aflatoxin B1 metabolism in liver
作为抵御食品污染的第一道屏障,肠道上皮细胞对霉菌毒素具有高度敏感性[17]。其中体外培养分化的Caco-2 细胞结构和功能类似于人体真实小肠上皮细胞结构和功能,其具有微绒毛等结构,并含有与小肠刷状缘上皮相关的酶系,具有相同的细胞极性和紧密连接[18]。James 等[19]以未分化Caco-2 细胞为体外模型,研究多种霉菌毒素的交互作用,如DON 和ZEA 联合作用可促进细胞丙二醛(malondialdehyde,MDA)的产生,引起细胞氧化DNA 损伤,且两种霉菌毒素联合后比单独作用毒性更强。饲料及其原料中往往含多种霉菌毒素,一种霉菌也可产生多种毒素,因此食品中往往存在多种霉菌毒素共存的情况。
细胞凋亡表现为天冬氨酸蛋白水解酶(caspase)家族活化、DNA 损伤、蛋白交联、线粒体膜电位改变等[20]。引发细胞凋亡主要通过两条途径[21]:一条为体外路线,即死亡受体通路;另一条为体内途径,即线粒体通路。线粒体途径又称内源途径,一般由细胞内信号引发,通过作用Bcl-2 蛋白家族改变线粒体膜结构,使线粒体膜通透性转换孔开放,释放促凋亡物质,如细胞色素C、半胱氨酸蛋白酶激活剂(Smac/DIABLO)、凋亡诱导因子(AIF)及核酸内切酶G、丝氨酸蛋白酶(HtrA2/Omi)等。本文通过研究AFM1和OTA 单一及联合作用对Caco-2 细胞凋亡的影响,判断作用机制,为牛奶质量安全风险评估提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞株及试验试剂 人的结肠癌细胞(Caco-2),购自美国ATCC 公司;黄曲霉毒素M1 标准品,百灵威科技有限公司;OTA 标准品,美国Fermentek 公司;DMEM 培养基,美国Gibco 公司;胎牛血清(fetal bovine serum,FBS),美国Gibco 公司;非必须氨基酸 (nonessential amino acid,NEAA),美国Macgene 公司;双抗,碧云天生物技术研究所;二甲基亚砜(dimethylsulphoxide,DMSO),美国Sigma 公司;PBS,碧云天生物技术研究所;胰酶,碧云天生物技术研究所;DCFH-DA,美国Sigma 公司;细胞凋亡试剂盒,美国BD 公司;线粒体膜电位试剂盒,碧云天生物;Alamar-Blue,美国Sigma 公司;细胞凋亡蛋白抗体Caspase-3 和caspase-9 抗体,美国Cell signaling technology 公司等。
1.1.2 试验仪器 冷冻离心机SK15,美国Sigma;恒温CO2培养箱3111,美国Thermo;倒置显微镜IX71,日本Olympus;细胞计数仪506BR1544,美国Bio-Rad TC10;酶标仪AMR-100,美国Thermo;Beckman Altra 流 式 细 胞 仪,美 国Thermo;SDS-PAGE 电泳仪JP300C,北京君意东方电泳设备有限公司;转膜仪IB21001,美国生命技术公司;摇床WSZ-20A,上海一恒科技有限公司等。
1.2 方法
1.2.1 细胞培养 Caco-2 细胞接种于培养皿中,加入10%的胎牛血清DMEM 培养液(1%非必须氨基酸、0.1%青霉素和链霉素)在5% CO2、37 ℃的条件下培养,待细胞长至80%~90%融合时,用0.25%胰蛋白酶消化传代,每3 天传代一次。培养分化细胞是将消化下来的细胞悬浮液用细胞记数板记数,用完全培养液将细胞浓度稀释至3×104个/mL,向12 孔Transwell 板的顶端绒毛面加入0.5 mL 稀释过的细胞悬浮液,底端基底面加入1.5 mL 完全培养液,轻轻摇晃混匀,放入5%CO2、37 ℃恒温培养箱中培养,每2 天换液一次,直至第21 天。试验所用的细胞均处于对数生长期生长状态良好的细胞,后续所有试验采用的均为培养21 d 分化的Caco-2 细胞。
毒素处理细胞。固体毒素用甲醇溶解之后溶解在无血清的培养基中,分别设计空白对照组、单独AFM1组、单独OTA 组、AFM1和OTA 联合作用4 组试验,放入5% CO2、37 ℃恒温培养箱中培养24 h 后,测定相应指标。
1.2.2 细胞存活率测定 Alamar-Blue 法检测分化的Caco-2 细胞存活率,细胞于24 孔板中培养成分化状态后,移去上层培养液,用PBS 清洗2~3次,处理组加入含有不同浓度不同种类毒素的处理液,对照组加入100 μL 不含毒素完全培养基,培养24 h 后吸去培养液,每孔中加入1 mL 含10% Alamar-Blue 溶液的培养基,37 ℃条件下过夜培养,活细胞将Alamar-Blue 氧化蓝色转化成粉色形式,用酶标仪在570 nm 处(以630 nm 为参考波长)测定吸光度值。试验重复3 次。计算公式如下[22]。

1.2.3 细胞凋亡率测定 取对数生长期分化的Caco-2 细胞,毒素处理24 h 后,吸去细胞培养液,PBS 洗涤细胞1 次,加入适量0.25%不含EDTA 的胰酶细胞消化液消化细胞。吸除胰酶细胞消化液。加入收集的细胞培养液,稍混匀后转移到离心管内,1 000 r/min 离心5 min,弃上清,收集细胞,按照Annexin V-FITC/PI 细胞凋亡检测试剂盒说明进行细胞凋亡率检测,在流氏细胞仪上检测结果。
1.2.4 细胞活性氧释放量检测 用PBS 溶液将毒素处理过的样品稀释为1×107cells/mL 的细胞悬液,加入 20 μmol/L 活性氧荧光探针carboxy-H2DCFDA(Eugene,OR),在30 ℃条件下孵育30 min;使用PBS 洗涤2 次,并通过酶标仪测定其荧光强度(488 nm 激发波长,525 nm 发射波长),按照试剂盒说明进行操作。
1.2.5 线粒体膜电位 (mitochondrial membrane potential,MMP)检测 用六孔板培养Caco-2 细胞,分化完成时,用毒素处理24 h 后,用PBS 洗涤细胞,每孔加入1 mL 细胞培养液和1 mL JC-1染色工作液,充分混匀,细胞培养箱中37 ℃孵育20 min。孵育结束后,吸除上清,用JC-1 染色缓冲液洗涤2 次。每孔加入2 mL 细胞培养液,按照线粒体膜电位检测试剂盒(JC-1)说明在荧光显微镜下观察测定。通常情况下,当线粒体的膜电位会完全丧失时,JC-1 染色后观察应呈绿色荧光;而正常的细胞经JC-1 染色后应显示红色荧光。荧光强度越大,线粒体膜电位越高。
1.2.6 线粒体相关蛋白表达检测 提取细胞总蛋白,95 ℃变性5 min,将样本在30%聚丙烯酰胺凝胶上进行分离电泳(80 V,2.5 h),将分离的蛋白转至PVDF 膜(60 V,2 h)。将载有蛋白质的PVDF 膜在封闭液中封闭1 h,分别与抗Caspase-3 和caspase-9 抗体 (1 ∶1 000)4 ℃作用过夜,用0.1%Triton-PBS 溶液漂洗3 次,每次10 min,与相应二抗(1 ∶1 000)常温下作用1 h,0.1% Triton-PBS 溶液漂洗3 次,每次10 min。漂洗后化学发光显色试剂盒显色,在凝胶成像系统将胶片曝光、显影、定影。免疫印迹条带用Alpha View SA 软件进行定量分析。
1.2.7 数据分析 数据用SAS9.2 软件来分析,用平均数±标准差来表示。每组试验重复3 次,每个试验重复3 次。显著性用P 值表示,P<0.05 为显著。判断交互作用类型参照Clarke 等[23]描述方法。
2 结果与分析
2.1 AFM1 和OTA 单独及联合作用对分化Caco-2 细胞活性的影响
Alamar-Blue 法检测AFM1和OTA 单独及联合作用对分化的Caco-2 细胞存活率的影响如图2所示,由图可见,与对照组相比,AFM1 和OTA对细胞的生长具有抑制作用,且OTA 对细胞的抑制作用比AFM1更强,分别为95.59%±13.58%和93.14%±8.63%,两者联合作用对细胞生长抑制作用加强,为81.57%±12.74%,参照Clarke 等[23]描述判断交互作用类型数据分析方法,单独AFM1与OTA 之和减去100 所得数值即为AFM1和OTA 联合作用的预测值,试验中得到的AFM1和OTA 联合作用的真实值低于预测值,可以判断AFM1和OTA 联合作用时对细胞存活率具有协同作用。
2.2 AFM1 和OTA 单独及联合作用对分化Caco-2 细胞凋亡的影响
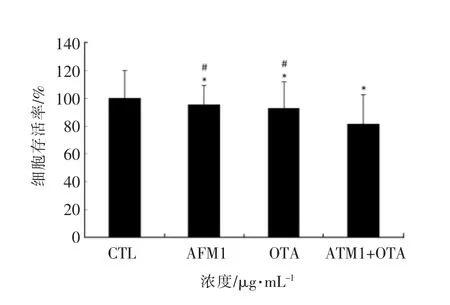
图2 AFM1 和OTA 单独及联合作用对分化Caco-2 细胞存活率的影响Fig.2 Effects of AFM1 and OTA alone and in combination on the survival rate of differentiated Caco-2 cells
细胞凋亡是由基因控制的细胞自主有序性死亡,对维持机体胚胎发育、组织修复、内环境的稳定有重要作用。Annexin V 为一种磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,Annexin V 用荧光素FITC 标记后,可以用来检测细胞凋亡的发生。碘化丙锭(PI)是一种核酸染料,它不能透过完整的细胞膜,然而能够穿透凋亡晚期细胞和坏死细胞的破损细胞膜,并使细胞核染色。将Annexin V 和PI 匹配使用,就可区分处于不同凋亡时期的细胞。图3中B1 代表坏死细胞,B2 代表细胞凋亡早期,B3 代表细胞凋亡晚期,B4 代表存活细胞。由图可以看出,单独AFM1和单独OTA 都能够诱导分化Caco-2 细胞凋亡,当12 μmol/L AFM1作用于分化的Caco-2 细胞时,凋亡率为25.68%,坏死率为3.35%;当6 μmol/L OTA 作用于分化的Caco-2细胞时,凋亡率为33.7%,坏死率为2.53%;当AFM1和OTA 同时作用于分化的Caco-2 细胞时,凋亡率为37.4%,坏死率为3.99%。AFM1和OTA联合作用的死亡率大于任何一种单独作用的作用效果,因此AFM1 和OTA 联合作用能够增加细胞死亡率,并且能够增强诱导细胞凋亡。
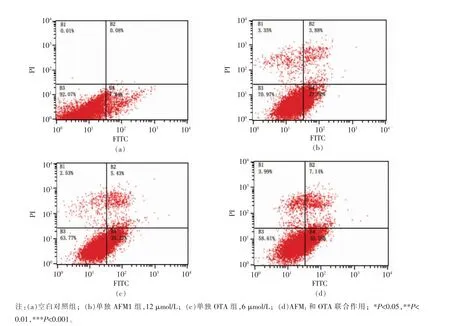
图3 AFM1 和OTA 单独及联合作用对分化Caco-2 细胞凋亡率的影响Fig.3 Effect of single and combined AFM1 and OTA on apoptosis rate of differentiated Caco-2 cells
2.3 AFM1 和OTA 单独及联合作用对分化Caco-2 细胞活性氧释放量的影响
线粒体使ROS 产生的重要场所,线粒体通透性孔道的开放释放出大量活性氧,这些活性氧又能够进一步激活该孔道,以正反馈的形式进一步加剧孔道的打开,放大凋亡信号。低浓度的ROS具有有益的生理功能,高浓度的ROS 具有有害的病理功能,可触发细胞内的氧化应激,一方面影响亚细胞器的功能,通过改变线粒体膜的通透性而引起线粒体的损伤,另一方面直接作用于蛋白质、脂类和DNA,造成氧化损伤,引起癌症、糖尿病、心脑血管疾病、神经退行性疾病和衰老等。由图4可以看出,AFM1 和OTA 作用于分化Caco-2 细胞后,细胞内的荧光强度增强,细胞ROS 生成增多,空白组荧光强度较弱,ROS 生成少,AFM1单独作用是对照组的1.37 倍,OTA 单独作用是对照组的1.79 倍;AFM1和OTA 联合作用ROS 的释放量显著增多,是对照组的6.21 倍。活性氧的生成可对细胞造成氧化应激反应,活性氧从线粒体释放到细胞质中,对线粒体电位产生影响,激活凋亡蛋白的表达。
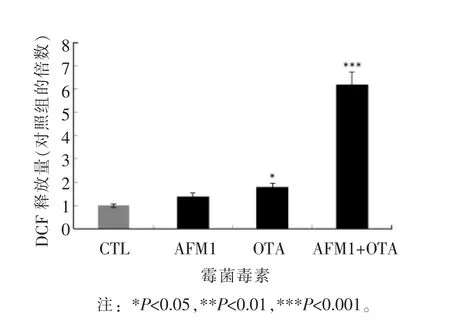
图4 AFM1 和OTA 单独及联合作用对分化Caco-2细胞活性氧释放量的影响Fig.4 Effect of single and combined AFM1 and OTA on reactive oxygen release of differentiated Caco-2 cells
2.4 AFM1 和OTA 单独及联合作用对分化Caco-2 细胞线粒体膜电位的影响
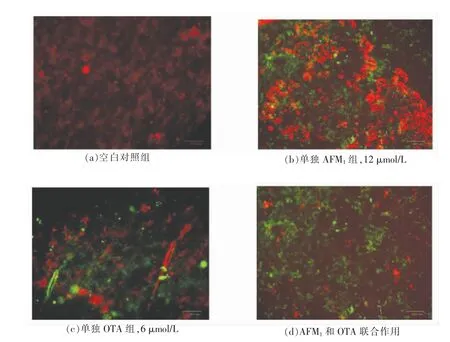
图5 AFM1 和OTA 单独及联合作用对分化Caco-2 细胞线粒体膜电位的影响Fig.5 Mitochondrial membrane of differentiated Caco-2 cells treated with single and combined AFM1 and OTA for 24 h by JC-1
线粒体的膜通透性转换现象主要是指线粒体内膜的非特异的通透性变大,促使线粒体基质的蛋白浓度高于线粒体内外膜间隙及胞浆内的蛋白浓度,胶体渗透压导致线粒体肿胀,表现出线粒体膜电位发生改变,细胞内氧化应激可诱导线粒体肿胀。AFM1和OTA 单独及联合作用对分化Caco-2 细胞线粒体膜电位的影响如图5所示,a 图对照组中,荧光显微镜下观测到细胞膜电位基本正常,细胞培养液中加入AFM1或OTA 后,代表线粒体膜电位的红绿光比值逐渐降低,说明AFM1和OTA 处理细胞后引起细胞线粒体膜电位的下降和膜通透性增加。当同时加入AFM1和OTA 时,荧光显微镜下已基本呈现绿色荧光,细胞线粒体膜电位显著下降,膜通透性显著增加。由此说明AFM1和OTA 联合作用可能通过线粒体途径诱导分化Caco-2 细胞凋亡。
2.5 AFM1 和OTA 单独及联合作用对分化的Caco-2 细胞凋亡相关蛋白表达的影响
在细胞凋亡的晚期,由于线粒体和胞浆中的抗氧化系统紊乱,产生的ROS 无法得到有效的清除,细胞内的ROS 水平会显著升,高浓度的ROS会触发细胞内的氧化应激,造成氧化损伤,导致线粒体功能的丧失,并最终引发细胞凋亡,凋亡效应分子caspase-3 位于凋亡通路枢纽地位,caspase-3活化能引起细胞凋亡。caspase-3 的活化主要依靠caspase-9 的激活,试验中分别检测凋亡蛋白caspase-3 和caspase-9 表达量变化,由图6可以看出,AFM1 和OTA 单独作用都可以促进凋亡蛋白表达量增加,caspase-3 蛋白结果具有显著性;AFM1 和OTA 联合作用与单独作用组相比,凋亡蛋白caspase-3 和caspase-9 表达量均变高,由Clarke 法数据分析可知,AFM1 和OTA 联合作用对caspase-3 凋亡蛋白的表达具有拮抗作用,对caspase-9 凋亡蛋白的表达具有协同作用,在此剂量条件下,由此说明霉菌毒素作用细胞方式不一致,促进细胞凋亡方式也不同。
以上结果可以得出,AFM1和OTA 促进细胞凋亡可能由于AFM1和OTA 促进细胞活性氧产生,活性氧进入线粒体后,改变细胞膜电位,促进细胞色素C 生成,细胞色素C 由线粒体进入细胞质中,激活凋亡蛋白产生,最后引起细胞凋亡级联反应,这也说明了氧化损伤是细胞凋亡机制之一。
3 讨论
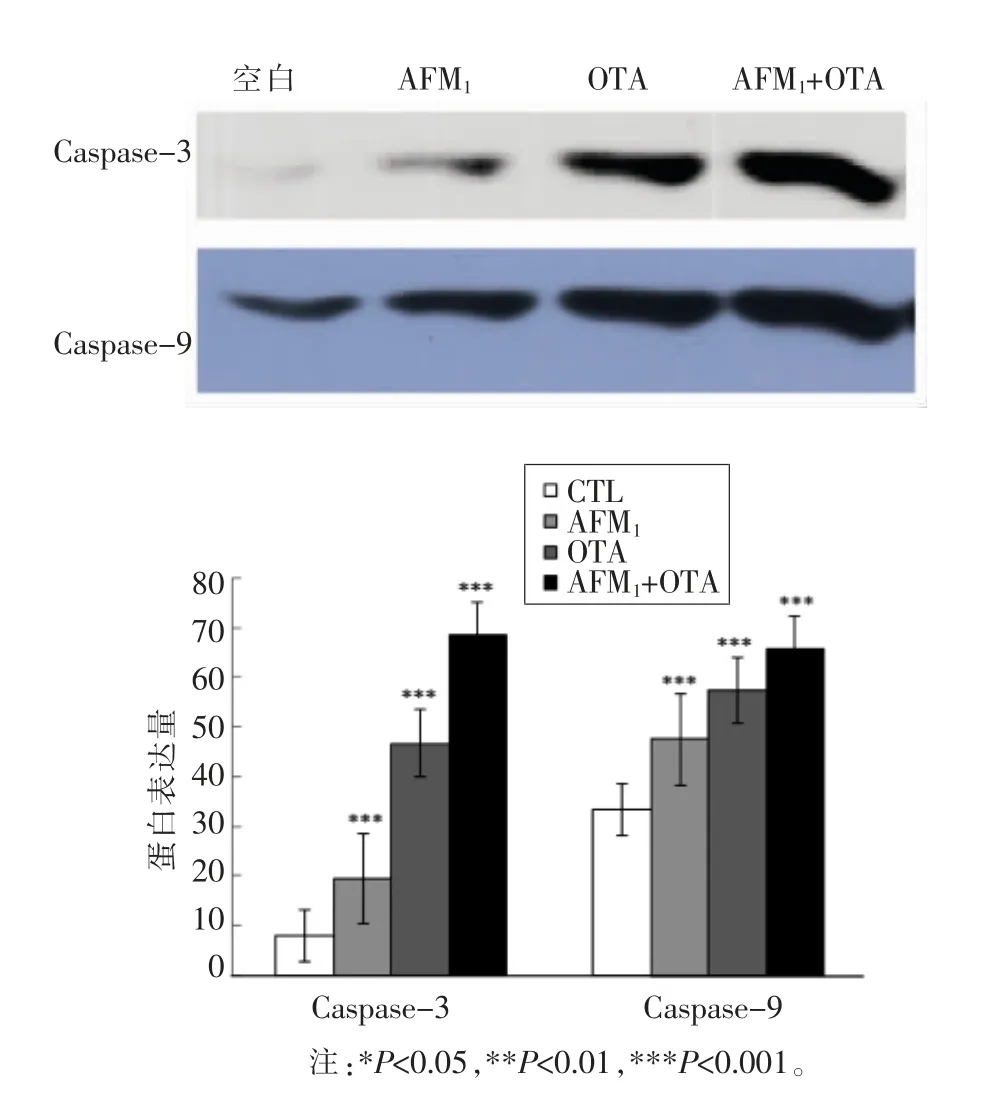
图6 AFM1 和OTA 单独及联合作用对分化的Caco-2 细胞凋亡蛋白表达量的影响Fig.6 Effect of single and combined AFM1 and OTA on the expression of apoptosis protein of differentiated Caco-2 cells
霉菌毒素可以增加动物体重和相关脏器质量,引起肠胃功能紊乱,导致腹泻、食欲减退、肝肿大,造成肠道上皮细胞凋亡[24]。Zhang 等[25]研究表明,AFM1降低分化和未分化Caco-2 细胞存活率,对细胞造成氧化DNA 损伤。Maresca 等[26]研究发现OTA 能够改变肠道的吸收功能。OTA 能够引起Caco-2 和HepG-2 共培养细胞的炎症反应[27]。本试验以分化Caco-2 细胞为体外模型,研究AFM1和OTA 两种霉菌毒素单独和联合作用。有研究发现,细胞受到毒素刺激后,细胞内线粒体膜电位下降伴随着ATP 水平下降[28],同时线粒体是活性氧产生的主要场所,又是活性氧作用最敏感的部位,活性氧会对线粒体造成氧化损伤,进而诱导细胞凋亡[29]。试验研究发现,AFM1和OTA 显著抑制分化Caco-2 生长、增殖,诱导细胞凋亡,表现出凋亡细胞特征,AFM1和OTA 联合作用毒性效果增加。AFM1和OTA 增加细胞ROS 释放量,ROS以细胞线粒体为靶点,攻击线粒体,降低膜电位[30],试验发现AFM1 和OTA 联合作用与单独作用相比,细胞ROS 释放量显著增加。AFM1和OTA 进入细胞后激发细胞凋亡蛋白Caspase-3 和Caspase-9 表达,从而使细胞发生凋亡,这说明AFM1和OTA 诱导细胞凋亡与线粒体相关蛋白的表达有关。本研究尽管是体外细胞试验,随着对AFM1和OTA 单独及联合作用及其机制的深入研究,进一步揭示霉菌毒素对人体毒性作用机理,为深入研究多种霉菌毒素在体内对人体肠道功能的影响,将对于制定霉菌毒素在食品中的限量标准及开发生物技术对食品及原料中的霉菌毒素的控制将具有重要意义。
对于食品中真菌毒素的最大允许量,国家有明确的规定[31],但规定中没有提及两种以上的真菌毒素共同存在时的限量标准,所以当两种以上毒素共存时,其含量分别符合限量标准,但如果联合加和或协同作用,则会对人体造成更大伤害。因此,通过研究食品中常见的真菌毒素共存时的联合作用,可为食品安全提供更准确的理论依据。
