金属离子对微生物蛋白酶活性的影响及机理
2019-05-18张国丽敖晓琳
余 茜 张国丽 敖晓琳
(四川农业大学食品学院 四川雅安625000)
微生物蛋白酶作为工业上主要的蛋白酶制剂来源,广泛应用于食品、医药及生物工业等方面。目前,关于微生物蛋白酶的相关研究主要集中在高产菌株的选育,基因结构及功能方面,对于金属离子影响微生物蛋白酶活性及其机理的研究较少。相关报道表明添加一定量的金属离子可以显著提高蛋白酶活性。这一研究发现对于微生物蛋白酶制剂的生产及相关发酵食品工业进步具有重大意义。
1 微生物蛋白酶主要概述
蛋白酶是一类能催化分解蛋白质中的肽键断裂产生氨基酸、多肽或者肽段的酶的总称。根据反应最适pH 可将蛋白酶分为酸性、 中性和碱性蛋白酶。
蛋白酶分布广泛,其来源可分为动物、植物和微生物3 个方面。动、植物蛋白酶主要存在生产周期长,成本高,提取工艺较复杂和蛋白酶得率较低等问题。因此,从动、植物中生产蛋白酶已逐渐被微生物替代。微生物蛋白酶主要来源于真菌、细菌和病毒,其中真菌以霉菌属(Aspergillus)为主,细菌以芽孢杆菌属(Bacillus)为主,病毒主要有脊髓灰质炎病毒和T4噬菌体,用于工业生产的微生物蛋白酶主要来自真菌和细菌(表1)。
蛋白酶是一种重要的工业酶,据统计蛋白酶的销售占全球总酶销售量60%左右[1]。其中70%的工业蛋白酶用于食品发酵、皮革加工、清洁剂、明胶产业等[2]。其中,酸性蛋白酶主要用于调味品及传统发酵食品的生产[3-4],如在干酪制作过程中酸性蛋白酶催化酪蛋白沉淀这一关键步骤常常作为干酪品质好坏的指标之一;中性蛋白酶主要用于酱油脱苦[5]、啤酒酿造[6]方面,如在酱油发酵过程,中性蛋白酶可以有效地水解蛋白质原料,利用中性蛋白酶修饰作用去除水解产物的苦味;碱性蛋白酶主要用于皮革加工、食品烘焙、肉类软化等方面[7],如在面包制作过程中加入一定量的碱性蛋白酶能够有效提高面团的延伸性和韧性,增强面包起泡性[8]。
2 金属离子作用微生物蛋白酶相关研究
国内外学者研究发现添加少量的金属离子对于蛋白酶活性有显著提高,其中以二价金属离子为主。并且在不同来源蛋白酶样品中添加同种金属离子其作用效果与蛋白酶最适pH 及其活性部位结构密切相关,根据最佳pH 与活性位点的差异微生物蛋白酶被分为天冬氨酰基蛋白酶 (酸性)、金属蛋白酶(中性)、半胱氨酸或巯基蛋白酶(碱性)和丝氨酸蛋白酶(碱性)。根据近几年国内外关于金属离子作用微生物蛋白酶的相关研究结果表明:部分金属离子对微生物蛋白酶具有明显的激活作用,同种金属离子对于不同来源的蛋白酶作用效果不同,不同添加量的作用效果也具有明显差异。

表1 微生物蛋白酶主要来源Table1 Production strain of microbial protease
2.1 金属离子对微生物酸性蛋白酶的影响及机理研究
微生物酸性蛋白酶主要来源于曲霉属,其最适反应pH 值主要在2.0~4.0。微生物酸性蛋白酶的活性位点一般为天冬氨酰基,在所有的蛋白酶中天冬氨酸型蛋白酶的反应机制最为含糊不清,且没有简单的化学模式作为指导,然而可以确定的是天冬氨酸型蛋白酶的催化活性与两个天冬氨酸残基有关。研究发现,部分金属离子能与酸性蛋白酶活性位点的残基发生反应从而改变酸性蛋白酶活性。表2归纳了国内、外近6年关于金属离子作用微生物酸性蛋白酶的研究,包括酸性蛋白酶的来源、最适pH 值、金属离子添加量及其作用效果等内容。
2.1.1 金属离子激活酸性蛋白酶机理研究 从表2可以看出Cu2+、Mn2+和Fe2+对酸性蛋白酶活性影响最为显著,在大部分研究中Mn2+对于酸性蛋白酶主要表现为激活作用,Lee 等[14]的研究中添加1 mmol/L 的Mn2+使米曲霉LK-101 的酸性蛋白酶相对酶活高达197%,添加1 mmol/L 的Cu2+后酸性蛋白酶相对酶活达到184%。Yin 等[11]的研究中添加10 mmol/L 的Fe2+后,酸性蛋白酶相对酶活高达225%。从作用机理来看,Mn2+提高酸性蛋白酶活性的机理主要是Mn2+参与了酸性蛋白酶分子结构的稳定,防止其在催化反应过程中构象的变化,从而提高了反应速率,所以Mn2+常常作为酸性蛋白酶的稳定剂[15]。Cu2+激活酸性蛋白酶活性的机理研究主要在于Cu2+可以和酸性蛋白酶活性中心的天冬氨酸残基发生复杂的配体磷酸化反应,从而改变酸性蛋白酶的构象,天冬氨酸蛋白酶具有极其复杂的催化机制,这种通过变构而提高酶活的发现在Ida 等[16]和Karsten[17]的研究中得到了验证。在很多研究报道中证明一定浓度的Fe2+对于酸性蛋白酶具有刺激作用,而作用机理尚不明确。王习文等[18]在金属离子对漆酶活性影响的相关研究中提及添加一定浓度的Fe2+能够提高漆酶活性,进一步研究发现Fe2+主要是通过与底物催化氧化产物ABTS·的反应来影响漆酶的活性,这一研究结果给Fe2+激活蛋白酶活性提供了一定的启示。然而,Fe2+对于不同菌株所产酸性蛋白酶作用效果不一致,比如在表2中方春玉[12]和张秀春[13]的研究结果表明Fe2+对酸性蛋白酶起抑制作用。

表2 金属离子作用微生物酸性蛋白酶研究Table2 Study on the effect of metal ions on microbial acid protease
2.1.2 金属离子抑制酸性蛋白酶机理研究 大部分重金属离子如Ag+、Hg2+和Fe3+等对酸性蛋白酶活性产生明显的抑制作用。Sawada 等[19]对金属离子作用拟青霉酸性蛋白酶进行研究,结果表明Hg2+对酸性蛋白酶活性高度抑制。关于金属离子抑制酸性蛋白酶活性的机理在曹志云等[20]的研究中获得解释,金属离子如Cd2+、Pb2+及Hg2+能与酸性蛋白酶中的功能蛋白质结合,占据酶的活性位点,导致蛋白酶失活;除占据酶的活性位点,其抑制机理可能还与金属离子结合酶的活性基团有关。
2.2 金属离子对微生物中性蛋白酶的影响及机理研究
微生物中性蛋白酶一般来源于曲霉属和芽孢杆菌属,其最适反应pH 值主要在6.5~7.5。微生物中性蛋白酶大部分属于金属蛋白酶,其中主要为活性部位含锌的蛋白酶,还有一些是含有两种金属离子的蛋白酶。金属离子与3 个保守氨基酸残基结合,这些氨基酸通常为组氨酸、天冬氨酸、谷氨酸或赖氨酸。还有一部分中性蛋白酶属于丝氨酸蛋白酶,这部分蛋白酶主要是以丝氨酸酰基的酰基-酶作为催化机制。表3主要归纳了近3年国内、 外关于金属离子及其添加量对不同来源中性蛋白酶活性影响的研究。

表3 金属离子作用微生物中性蛋白酶的研究Table3 Study on the effect of metal ions on microbial neutral protease
2.2.1 金属离子激活中性蛋白酶机理研究 在中性蛋白酶酶学性质的相关研究中,Ca2+往往表现为明显激活作用,其影响机理主要是中性蛋白酶往往不耐高温,Ca2+能够维持中性蛋白酶的空间构象,提高中性蛋白酶的热稳定性,从而提高蛋白酶活性,因此Ca2+常常作为稳定剂添加到蛋白酶中。Zn2+对于部分中性蛋白酶起激活作用,激活机理往往是这部分中性蛋白酶活性部位不含Zn2+,Zn2+能通过疏水键结合、 金属结合和离子相互作用等方式提高中性蛋白酶的热稳定性,从而提高中性蛋白酶活性[26]。如枯草杆菌中性蛋白酶就是一种金属含锌酶,其活性中心含一个Zn2+[27],Zn2+作为酶的催化活性中心,它对维持酶的活性及其活性部位构象具有重要作用,而在大部分研究中添加Zn2+往往表现为抑制作用。Mg2+对于大部分菌株所产的中性蛋白酶起激活作用,激活机理主要是Mg2+置换了中性金属蛋白酶活性部位的部分Zn2+,改变了蛋白酶活性位点微环境,这种改变有利于中性蛋白酶活性的提高[28]。另一种原因则是Mg2+与中性蛋白酶结构中除活性位点外的其它氨基酸附着点相结合,形成稳定结构的化学键,从而提高相应的酶活[29]。K+和Li+对中性蛋白酶的作用机理与此机理相似,都是与保守氨基酸残基结合并参与催化反应,提高中性蛋白酶催化效率。
2.2.2 金属离子抑制中性蛋白酶机理研究 表3中Zn2+对中性蛋白酶活性主要起抑制作用,其抑制机理为大部分中性蛋白酶属于金属蛋白酶,其活性中心含有Zn2+,添加过量Zn2+往往会抑制中性蛋白酶活性,这与很多文献报道结果相符[30];研究发现部分金属离子能替代中性蛋白酶活性部位的金属离子,这种替代反应造成了活性部位结构的不利改变,从而抑制其活性[31];高浓度的Fe3+、Ge2+和Co2+等重金属离子能与反应体系螯合或与蛋白酶发生反应,破坏蛋白酶空间结构,致使蛋白酶活性显著抑制,甚至失活。胡皆汉[32]在研究枯草杆菌中性蛋白酶与Co(Ⅱ)相互作用的核磁共振谱中发现,枯草杆菌中性蛋白酶活性中心的Zn(Ⅱ)与外加的Co(Ⅱ)存在直接相互作用,Co(Ⅱ)部分置换原酶活性中心的Zn(Ⅱ),形成“Co-NP”酶衍生物,影响酶的催化活性。
2.3 金属离子对微生物碱性蛋白酶影响研究
微生物碱性蛋白酶来源较广,其最适反应pH值主要在8.0~12.0。微生物碱性蛋白酶活性位点有半胱氨酸、巯基和丝氨酸,其中以丝氨酸为主,故碱性蛋白酶又称为丝氨酸蛋白酶。丝氨酸蛋白酶由丝氨酸(Ser)、组氨酸(His)和天冬氨酸(Asp)组成的催化三元体所表征。它们按照Ser-His,His-Asp 成对起作用。以第2 个组氨酸代替天冬氨酸揭示了天冬氨酸的辅助性质,所有催化步骤都是由Ser-His 二元体完成。部分金属离子能够与碱性蛋白酶的活性位点残基发生反应,改变碱性蛋白酶的高级结构,从而导致碱性蛋白酶活性发生改变。表4中针对近6年国内、外关于金属离子作用微生物碱性蛋白酶活性的相关研究进行了归纳。
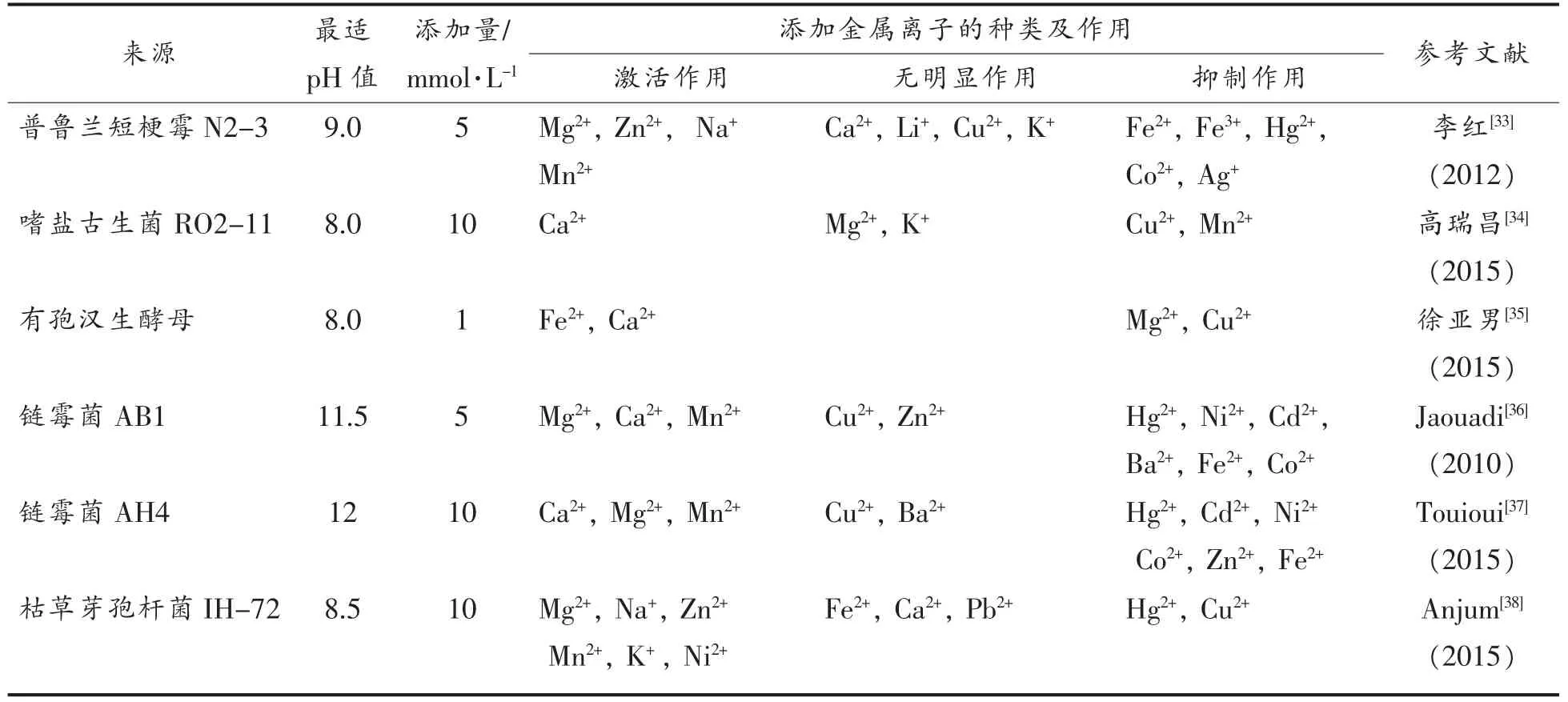
表4 金属离子作用微生物碱性蛋白酶的研究Table4 Study on the effect of metal ions on microbial alkali protease
2.3.1 金属离子激活碱性蛋白酶机理研究 枯草杆菌碱性蛋白酶属于丝氨酸型蛋白酶家族,其活性位点具有一个丝氨酸关键残基,此残基是天冬氨酸、组氨酸和丝氨酸催化三元体的一部分,枯草
3 总结与展望
金属离子提高蛋白酶活性的机理可分为三大类。第一类主要是提高蛋白酶稳定性,包括热稳定性和结构稳定性。金属离子特别是二价金属离子与蛋白酶分子中的基团发生联结形成金属键,对维持蛋白酶空间构型方面起到一定稳定作用。金属离子还能有效促进蛋白酶分子链内和链间的氢键作用及肽链的稳定折叠或部分折叠状态。第二类主要是金属阳离子通过与除活性位点外的其它氨基酸附着点相结合来提高蛋白酶活力。金属离子通过与内源和外源配体配位,形成金属活性部位,这部分金属离子常常作为激活剂使用,其中最常见的金属离子是Zn2+,其次是Co2+、Mn2+和Cu2+。第三类是金属离子在催化反应过程中传递电子,进行亲电或者亲核攻击,促进酶和底物的结合等作用。
笔者曾从霉豆瓣中分离得到一株高产蛋白酶的菌株,在研究其酶学特征过程中发现添加微量的Mn2+和Cu2+对其酶活有显著提高,且与对照组相比表现出明显的生产优势,从而大大缩短了发酵周期。在低温条件下,笔者发现添加Mn2+和Cu2+的试验菌株其生长速率和蛋白酶活性都比对照组表现出明显优势。目前很多传统发酵食品的生产仍处于落后阶段,其发酵过程处于开放式环境,季节变化对实际生产影响较大。一年中霉豆瓣的生产主要在6月~8月,环境温度低于28 ℃将会延长发酵周期,增加生产成本。针对金属离子能在低温条件下提高酶活和生长速率这一特性,若将其运用到实际生产中,对于企业提高生产效率和节约生产成本具有重要意义。笔者在Cu2+激活米曲霉蛋白酶活性机理的研究过程中发现,Cu2+激活蛋白酶活性主要与蛋白酶等电点、 氨基酸序列和二级结构有关。在研究Cu2+激活蛋白酶机理过程中,笔者发现纯化所得的蛋白酶量较少,酶活损耗较大,从而增加了试验难度,优化层析方法有助于解决这一难题。目前国内、外对于金属离子影响蛋白酶活性的机理研究尚处于初级阶段,仍需要进一步探索。深入研究金属离子激活蛋白酶活性的机理为今后研究蛋白酶催化机理奠定坚实基础,更为今后阐明蛋白酶结构与功能关系提供理论依据。杆菌蛋白酶家族至少有一个钙结合位点,这使得它们具有良好的热稳定性[39]。在多位学者[40-41]的研究中,Ca2+、Mn2+和Mg2+对来自芽孢杆菌属产生的碱性蛋白酶活性都有明显提高,其中Ghorbel[42]从蜡状芽孢杆菌BG1 中分离纯化得到碱性蛋白酶,分别添加5 mmol/L Ca2+、Mg2+和Mn2+作用后蛋白酶相对酶活达到450%、285.5%和157.5%。Ca2+、Mn2+和Mg2+提高碱性蛋白酶酶活的国内、 外相关报道[42-43]有很多,而关于其影响机理的研究甚少。Ca2+对大多数碱性蛋白酶的热稳定性具有明显的增强作用[44],研究认为Ca2+提高碱性蛋白酶活性的机理主要是在一定温度条件下Ca2+能够保护碱性蛋白酶不发生热变性,且在高温情况下也能避免其构象发生改变[45]。在丝氨酸蛋白酶空间结构的研究中发现其活性部位含有两个钙的结合位点,去除强结合位点上的一个钙离子将使蛋白酶热稳定性显著下降[46],进一步验证了Ca2+对于碱性蛋白酶热稳定性方面具有重要作用。对于Mn2+和Mg2+影响碱性蛋白酶活性的机理研究中发现,Mn2+和Mg2+能与碱性蛋白酶分子中的侧链氨基酸残基结合,并在不改变碱性蛋白酶催化构象的基础上稳定碱性蛋白酶的分子构象,调节碱性蛋白酶活性。然而,大量研究中发现Mg2+对于不同来源的碱性蛋白酶作用效果往往表现出较大差异,其原因可能与不同碱性蛋白酶氨基酸序列及其高级结构有关。对于Na+和K+提高碱性丝氨酸蛋白酶活性机理,除在Wang[47]的文献中提及与蛋白酶稳定性有关外,暂无其它报道。因此Na+和K+提高蛋白酶活性的机理可能是增强了碱性蛋白酶的结构稳定性。Becker[48]的研究也证实了碱性蛋白酶在室温条件下碱金属卤化物、 碱金属磷酸盐和碱金属碳酸盐等的加入能够增强碱性蛋白酶的稳定性,其中以氯化钠效果最为显著。
2.3.2 金属离子抑制碱性蛋白酶机理研究 重金属抑制碱性蛋白酶活性的文献报道较多,主要是金属汞、镉、铅等与碱性蛋白酶分子中的巯基反应将其转换为硫醇,或者是与碱性蛋白酶中的组氨酸和色氨酸残发生反应,从而抑制酶的活性。此外,通过银和汞的作用可将碱性蛋白酶分子中的二硫键通过水解的方式降解[49]。这些不可逆反应的发生使得碱性蛋白酶活性降低或彻底失活。
