体外模拟胃、肠消化对萝卜苗中活性物质、抗氧化功能及代谢差异物的影响
2019-05-18李茹朱毅
李 茹 朱 毅
(中国农业大学食品科学与营养工程学院 北京100083)
萝卜芽苗菜属于十字花科植物,已经被公认是丰富的多功能生物活性化合物的来源[1-3],如维生素、酚类等,摄入较多的萝卜苗有助于降低某些慢性疾病和癌症的发病率。作为植物中重要的次生代谢产物,酚类化合物如酚酸、类黄酮、花青素、原花青素等具有许多生物活性,降低癌症、心脏病和糖尿病的发生风险;抑制血浆血小板聚集,环氧合酶(COX)活性和组胺释放;以及体外抗菌,抗病毒,抗炎和抗过敏活性[4-6]。维生素C 具有清除羟基自由基,保护细胞组织,预防慢性疾病及癌症的发生等功效[7]。除了上述组分外,萝卜苗还含有十字花科蔬菜特有的活性物质——硫代葡萄糖苷 (硫苷)。研究发现,十字花科芽苗菜的营养价值远远高于其成熟蔬菜。Cevallos 等[3]研究表明,西兰花、甘蓝和萝卜等十字花科芽苗菜中酚类物质和硫苷的含量大约是成熟蔬菜的10 倍。异硫氰酸盐(硫代葡萄糖苷的降解产物之一),特别是萝卜硫素,具有较强的抗癌,预防慢性疾病和细胞保护等功效[8-10]。此外,一些抗氧化酶,如超氧化物歧化酶,也有助于抗氧化剂的潜在有益作用。
目前关于人体营养摄入的建议,大多基于研究中采用化学溶剂提取食品中活性成分而获得的含量数据,未考虑活性成分在胃、肠道中的释放量及消化过程中可能发生的变化[11]。关于苹果模拟消化的研究表明,模拟消化过程中苹果释放的多酚低于甲醇萃取的含量,且苹果经胃、肠模拟消化后,可溶于胃、肠道的多酚和黄酮含量仅占总量的45%和60%,这说明多酚和黄酮经胃、肠模拟消化后,虽大量释放,但不能完全被吸收[11-12]。在人体胃、 肠道消化系统中,食物消化于胃(酸性酶环境)、小肠(弱碱性肠环境)、大肠(中性微生物环境)。要实现食物的保健功能,在胃、肠道中,抗氧化物质和其它功能因子必须首先从固体食糜中释放出来,并进一步转化为其它可吸收和有生物活性的物质。可通过气-质谱联用、液-质谱联用等手段进行相关代谢物的定性和定量验证,然而由于标准物质的缺乏,所以限制了此种方法的实施。在消化过程中,可能发生降解转化和不完全释放,这会影响食物表现出来的抗氧化能力。传统的有机溶剂水溶液萃取方法不能反映来自食物的抗氧化活性物质在胃、肠道中的利用率(从食糜中的释放量)、降解及转化和吸收等情况[13]。
另外,由于生产、加工和食用过程中果蔬多以不可分割的整体形式存在,而其中的营养物质变化也是一个整体的动态变化过程,存在于果蔬中的一种功能活性物质在含量、种类、组成、活性等方面的变化必然影响共同存在于其中的其它活性物质。在此种状态下以单一种类功能活性物质的存在状态来衡量果蔬的功能活性品质并不恰当。蔬菜、 水果发挥抗氧化作用并不是其中的某种抗氧化物质发挥的作用,而是所含的抗氧化活性物质的拮抗和协同作用的结果[13]。
本研究以新鲜栽培的萝卜苗进行体外模拟胃肠消化和吸收,检验此过程中的主要活性物质(酚类、硫苷及异硫氰酸盐和维生素C)的含量,采用亚铁还原能力 (FRAP)、DPPH 自由基清除能力(DPPH)、 还原能力 (RP)、 抗超氧阴离子能力(ASA)和超氧化物岐化酶活性(SOD)对其总抗氧化能力进行评价,最后用代谢组学手段补充鉴定涉及的其它代谢物质,进而评价体外模拟胃肠消化对萝卜苗营养品质的影响。
1 材料与方法
1.1 试验材料
盛丰白萝卜种子,北京京研盛丰种苗研究所;α-淀粉酶、胃蛋白酶A、胰液素、胆汁提取物和透析袋等,美国Sigma 公司;其余试剂为分析纯级,北京化工厂。
1.2 仪器与设备
PGX 光照培养箱,宁波莱福科技有限公司;M200 Pro 多功能酶标仪,奥地利帝肯公司。
1.3 试验方法
1.3.1 萝卜苗培育 挑选颗粒饱满、 无霉变的萝卜种子。将萝卜种子清洗干净,蒸馏水浸泡5 h,浸种后再掏洗种子2~3 遍。浸泡后的种子均匀播撒在30 cm×20 cm 育苗盘内,育苗盘内铺有4 层纱布,均匀铺满种子(每盘约200 粒),25 ℃避光催芽3 d,早晚喷洒适量去离子水。3 d 后恢复光照(光照强度100 mmol/m2/s,光照时间16 h/8 h(昼/夜),温度25 ℃,相对湿度70%~80%,7 d 得到成品萝卜苗[16],液氮保护下磨粉。
1.3.2 体外模拟消化吸收 模拟唾液:2.38 g Na2HPO4,0.19 g KH2PO4和8 g NaCl 溶 解 至1 L去离子水中,调节pH 值至6.75,加入α-淀粉酶12.5 mg (E.C.3.2.1.1,A3176-500KU,16 U/mg 固体,Sigma)获得200 U/mL 酶活。
模拟胃液:添加胃蛋白酶A(EC3.4.23.1,P7012-250 MG,3641 U/mg 蛋白,87%蛋白含量,Sigma)(来自猪胃粘膜)至0.03 mol/L NaCl,获得300 U/mL 的酶活,调节pH 值至1.2。
模拟肠液:0.05 g 胰液素 (等于4 倍USP,P1750-25G,Sigma)和0.3 g 胆汁提取物(B8631-100 g,Sigma)溶解至35 mL 的0.1 mol/L NaHCO3。
终液:120 mmol/L NaCl 和5 mmol/L KCl。
新鲜提取物:各样品粉末取2 g 置于50 mL离心管中,加20 mL PBS(pH 7.4),室温振荡1 h,3 000 g 室温离心15 min,取上清,最终质量浓度为0.1 g(鲜重)/mL。
消化提取物:5 g 样品粉末在5 mL 模拟唾液中均质后,在37 ℃下振荡10 min;然后,样品用HCl(5 mmol/L)调节pH 值至1.2,悬浮在15 mL 模拟胃液中在37 ℃下振荡120 min 后;然后,样品用0.1 mol/L NaHCO3调节至pH 6,悬浮在15 mL 模拟肠液中,用1 mol/L NaOH 调节pH 7,再加入5 mL 终液,体外消化120 min。最终质量浓度为0.1 g(鲜重)/mL[17]。
吸收提取物:将模拟消化混合物置于透析袋中(D6066-25EA,Sigma-Aldrich),透析袋置于含有50 mL PBS 的锥形瓶中,锥形瓶置于旋转振荡器上振荡 (2×2 h,37 ℃),PBS 和最终经过透析膜的物质作为原始材料经过消化后由肠道吸收的物质。结果以原始材料每g 鲜重计,即0.1 g(鲜重)/mL[18]。
1.3.3 活性物质测定方法 总酚 (Total phenolic substances,TP) 测定:取0.2 g 样品溶液加入2 mL 95%的乙醇溶液,黑暗条件下室温振荡提取48 h,12 000×g 离心10 min,取0.1 mL 上清液加入0.1 mL 福林酚试剂、1 mL 蒸馏水以及0.3 mL 0.7 mol/L 碳酸钠溶液。静置2 h,在765 nm 下测量吸光值,以没食子酸(Gallic acid,100 μg/mL)为标样制作标准曲线,结果以每克鲜重样品中含有的没食子酸当量来表示,即mg/g[16]。
总酚酸(Total phenolic acids,TPA)测定:取样品溶液8 μL 至1.5 mL 离心管中,乙醇补足至200 μL,加0.3%十二烷基硫酸钠80 μL,0.6%三氯化铁-0.9%铁氰化钾混合溶液(体积比1∶1)40 μL,混匀,暗处放置5 min,用0.1 mol/L 盐酸补足至1 mL,避光放置20 min,在736 nm 波长处测定吸光度。以咖啡酸(Caffeic acid,100 μg/mL)做标曲[19],结果以mg/g 表示。
类黄酮(Flavonoids,FD)测定:0.5 mL 样品溶液中加入0.5 mL 2%六水合氯化铝(AlCl3·6H2O),充分混匀(漩涡),剧烈振荡后孵育10 min,在367 nm 波长处测定吸光度,以槲皮素(Quercetin,50 μg/mL)做标曲[20],结果以mg/g 表示。
花青素(Anthocyanins,AN)测定:取样品上清液在530 nm 和657 nm 波长处测定吸光度。花青素相对含量按下式计算。花青素相对含量 =A530nm-1/4A657nm,以矢车菊氯化物(Cyanidin chloride,50 μg/mL)做标准曲线[21],结果以mg/g 表示。
原花青素(Procyanidins,PC)测定:0.05 mL 提取液中加入0.6 mL 95%正丁醇/盐酸,再加入0.02 mL 2%的硫酸铁铵(NH4Fe(SO4)2·12H2O)盐酸(2 mol/L)溶液,然后在95 ℃孵育40 min,在550 nm 处测定吸光度,以矢车菊氯化物(50 μg/mL)作标曲[20],结果以mg/g 表示。
硫代葡萄糖苷(Glucosinolates,GLs)测定:取样品溶液0.2 mL,加质量分数0.15%的羧甲基纤维素钠0.4 mL,摇匀后再加0.2 mL 8 mmol/L 的氯化钯显色溶液,放置2 h,在紫外可见分光光度计540 nm 波长处以氯化钯羧甲基纤维素钠空白溶液作为参比溶液,测其吸光度,以黑芥子硫苷酸钾(Sinigrin,0.5 μmol/mL)做标曲[16],结果以mg/g 表示。
异硫氰酸盐(Isothiocyanates,ITCs)测定:取样品100 μL 溶液于5 mL 离心管中,氮气吹干,快速加入2 mL 无水甲醇,1.8 mL 50 mmol/L 的硼酸钠缓冲液(pH 8.5),0.2 mL 8 mmol/L 的1,2-苯二硫醇,混合物在65 ℃水浴1 h 后冷却至室温。365 nm 波长处测定吸光度,以苯基异硫氰酸酯(PITC,100 mmol/L)作标曲[22],结果以mg/g 表示。
维生素C(Vitamin C,VC)测定:参照南京建成维生素C 测定试剂盒,结果以mg/g 表示。
1.3.4 抗氧化功能测定 亚铁还原能力(Ferric reducing antioxidant power,FRAP)试验:参照南京建成总抗氧化能力 (T-AOC) 检测试剂盒(FRAP法),结果以U/mL 表示。
DPPH 自由基清除(DPPH radical scavenging power,DPPH)试验:0.5 mL DPPH 的乙醇溶液(0.1 mmol/L)中加入0.5 mL 样品溶液,漩涡振荡混匀,室温放置30 min,在518 nm 波长处测定吸光度。
清除率=[A0-(A1-A2)]/A0×100%
式中,A0——DPPH 溶液加入无水乙醇的吸光度;A1——DPPH 溶液加入样品溶液的吸光度;A2——样品溶液加入无水乙醇的吸光度;公式中引入A2是为了消除样品溶液中本身颜色对试验结果的干扰[23]。
还原能力(Reducing Power,RP)试验:0.1 mL样品溶液与0.25 mL 磷酸缓冲液(pH 6.6)和0.25 mL 1%铁氰化钾混合,50 ℃反应20 min 后,加入0.25 mL 10%三氯乙酸,有沉淀生成,1 000 r/min离心10 min,取0.25 mL 上清液与0.25 mL 去离子水和0.05 mL 0.1%氯化铁溶液混合,静置10 min,紫外分光光度计700 nm 波长处测定吸光度值,吸光值越高还原能力越强[24],以各样品对应的提取试剂为空白。以还原能力率来表示结果:
还原能力率=(1-A空白/A样品)×100%
抗超氧阴离子能力 (Anti-superoxide anion power,ASA)试验:参照南京建成抑制与产生超氧阴离子自由基测定试剂盒,结果以U/mL 表示。
超氧化物歧化酶活性(Superoxide dismutase,SOD)试验:参照南京建成总超氧化物歧化酶(TSOD)测试盒,结果以U/mL 表示。
1.3.5 异性代谢产物的挖掘及鉴定 样本信息及分析内容:10 例萝卜苗样品2 组(CK:萝卜苗的磷酸盐缓冲液提取物;GD:萝卜苗的体外模拟胃肠消化提取物),采用正负两种模式进行LC-MS检测(n=5),针对检测结果,分组比较:CK 组和GD组比较,共1 次。
样本预处理:称取约50 mg 样本,加入800 μL 甲醇(含内标5 μg/mL,二氯苯丙氨酸);将其置于组织研磨仪中65 Hz 研磨45 s;涡旋混匀30 s,而后置于4 ℃离心机中,12 000 r/min 离心15 min;吸取200 μL 上清液,转入进样小瓶中待LCMS 检测分析。
LC/MS 分析:色谱条件:仪器:ACQUITYTMUPLC-QTOF 系统;色谱柱:Waters ACQUITY UPLC HSS T3 柱(2.1 mm×100 mm,1.8 μm);色谱分离条件:柱温40 ℃;流动相A 为水(含0.1%甲酸),流动相B 为乙腈(含0.1%甲酸);流速为0.3 mL/min;进样量为6 μL;梯度洗脱程序见表1。
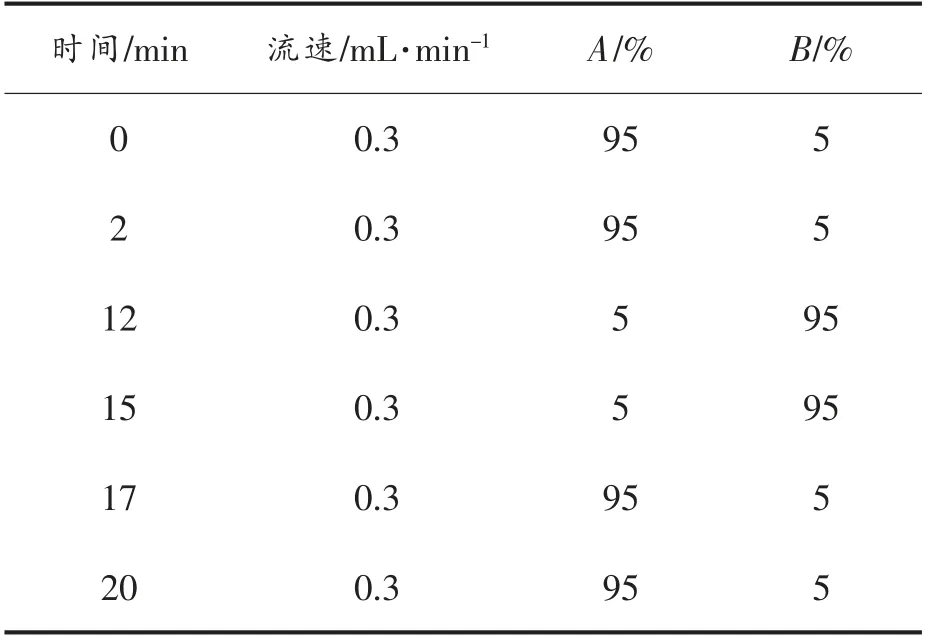
表1 流动相洗脱梯度Table1 The gradient of mobile phase
质谱条件:ESI (Electrosprary inoization,ESI)源,扫描方式:ESI+、ESI-模式;毛细管电压:1.4 kV和1.3 kV;锥孔电压:40 V 和23 V;离子源温度:120 ℃,脱溶剂气温度:350 ℃,锥孔气流量:50 L/h,脱溶剂气流量:600 L/h;碰撞能量:10~40 V;离子能量:1 V,每0.2 s 采集1 次图谱;准确质量测定采用芦丁溶液为锁定质量溶液;质量扫描范围:50-1 500 m/z。
1.4 数据处理
采用SPSS 20.0 软件进行数据分析,结果均表示为平均值±标准偏差,应用Origin 9.0 进行图形绘制,每组试验重复3 次。不同小写字母表示差异显著(P<0.05)。
2 结果与分析
多酚在植物体内通常与蛋白质、 多糖以氢键和疏水键形式形成稳定的分子复合物,多酚分子之间也是如此,这种现象对于分子量大、羟基数量多的植物单宁尤为突出。一般来说,存在于果蔬中的多酚一部分为可溶性自由酚,在搅碎和均质的过程中就被释放出来;一部分多酚以结合酚的形式存在,(1)酚分子自身之间,多酚与蛋白质、多糖之间以氢键和疏水键的形式形成稳定的复合物,在酸、碱性环境下,可以水解断裂氢键和疏水键而得到释放,(2)与蛋白质以酚酰键形式结合,或与多糖以酯键的形式形成糖苷,或以自身聚合物的形式,在酸、碱、酶的作用下水解释放[13]。图1显示,萝卜苗中的总酚在体外模拟胃消化后显著上升134.90%,而肠吸收后却比新鲜提取物中的总酚含量低。首先,根据相似相溶原理,磷酸盐缓冲溶液作为总酚的提取试剂相对于有机溶剂(如乙醇或甲醇)来讲,总酚的提取效率本身就不高[12];其次,消化过程中pH、胃蛋白酶等使得结合形式的多酚以有利形式释放出来;再次,模拟肠吸收阻挡了多数大分子酚类,一般来说,只有苷元可以在小肠中被吸收。大多数多酚以酯、糖苷或不能以天然形式吸收的聚合物的形式存在于食品中,经过消化后释放出小分子苷元[25]。萝卜苗中的总酚酸在体外模拟胃消化和肠吸收下的变化与总酚类似,在消化后总酚酸却只增加了26.53%,除了与总酚类似的原因外,酚酸类物质有自己的特点。酚酸类本身处于游离形式的占多数,在消化后,胃蛋白酶减弱了部分酚酸与细胞壁间的酯键,使酚酸从细胞壁中脱离,从而使总酚酸含量上升[11]。从体外模拟胃肠消化对萝卜苗中的类黄酮和花青素的影响,也发现这两类物质在体外胃消化后分别显著降低 (33.66%和20.27%)。在类似的试验中,Gil-Izquierdo 等[26]证明了在模拟消化不同的橙汁后总黄酮含量降低,发现能够渗透通过透析膜的化合物和保留在渗余物中的化合物的水平低于未消化的汁液中的水平。花青素代表了一类水溶性黄酮类化合物。黄酮含量的降低,没有在多酚中表现出来,有可能是(1)消化过程中释放的黄酮类物质占多酚的总含量比较少;(2)黄酮降解、转化产生的物质不影响多酚含量的测量[13]。原花青素在模拟胃肠消化后的变化趋势与总酚类似,在消化后增加了19.15%,而肠吸收后急剧降低(80.35%)。
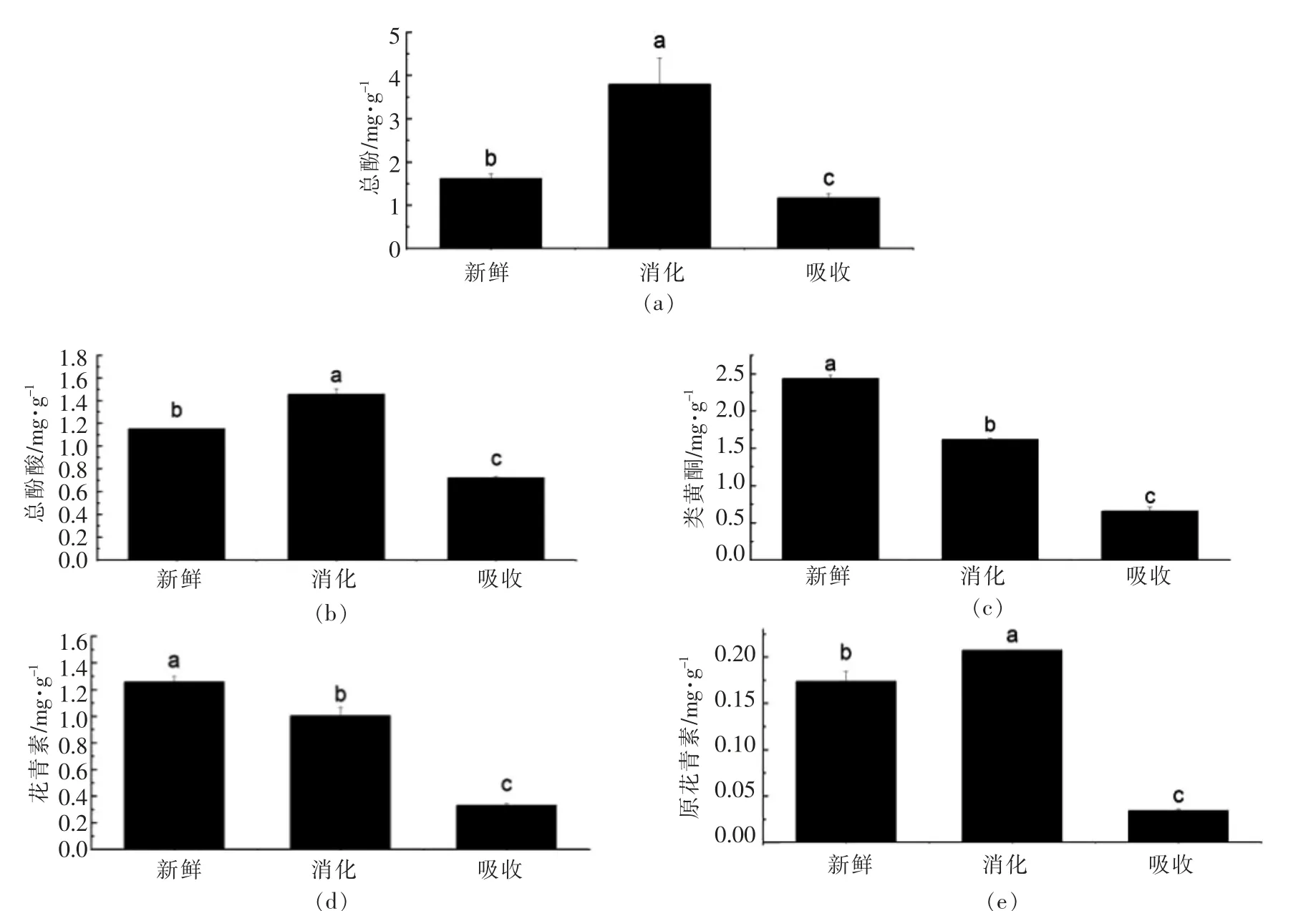
图1 体外模拟胃肠消化对萝卜苗中的酚类物质影响Fig.1 Effects of in vitro simulated gastrointestinal digestion on phenolic compounds in radish sprouts
硫代葡萄糖苷在模拟胃肠消化后显著降低(49.18%)(图2),类似的研究表明西兰花体外胃消化后,总硫苷显著降低 (69%),脂肪族硫苷(27%)比吲哚族(73%)稳定;当分析胰酶-胆汁盐的作用时,观察到总硫代葡萄糖苷浓度的额外降低。因此,可以得出结论,硫代葡萄糖苷在胃部条件下比酚类更不稳定[27]。对于消化过程中可能的解释是在胃酸下这些化合物高度降解为腈,此外,硫代葡萄糖苷在肠(pH 7)的低稳定性导致其分解成它们的次级反应产物(异硫氰酸盐)[27]。体外模拟胃消化后异硫氰酸盐显著下降,这是因为胃蛋白酶消化对异硫氰酸盐的稳定性有显著影响[27]。
肠吸收后得到透析和非透析两部分。透析的部分含有可用于在小肠中吸收,并能够通过被动扩散穿过膜的游离可溶性酚和硫代葡萄糖苷。研究发现,通过体外胃肠研究的草莓、洋葱和茶的可溶性黄酮醇和咖啡酸衍生物可用于吸收,而不溶性黄酮醇和羟基肉桂酸衍生物的仍然不可用[28-31],而它们仍有可能被肠道微生物群落代谢。非透析的部分包括存在于与大肠杆菌可以代谢的大分子(蛋白质、纤维等)结合的可溶性和不溶性部分中的酚类和硫苷、异硫氰酸盐,因此,它们在小肠中不是生物有效的。
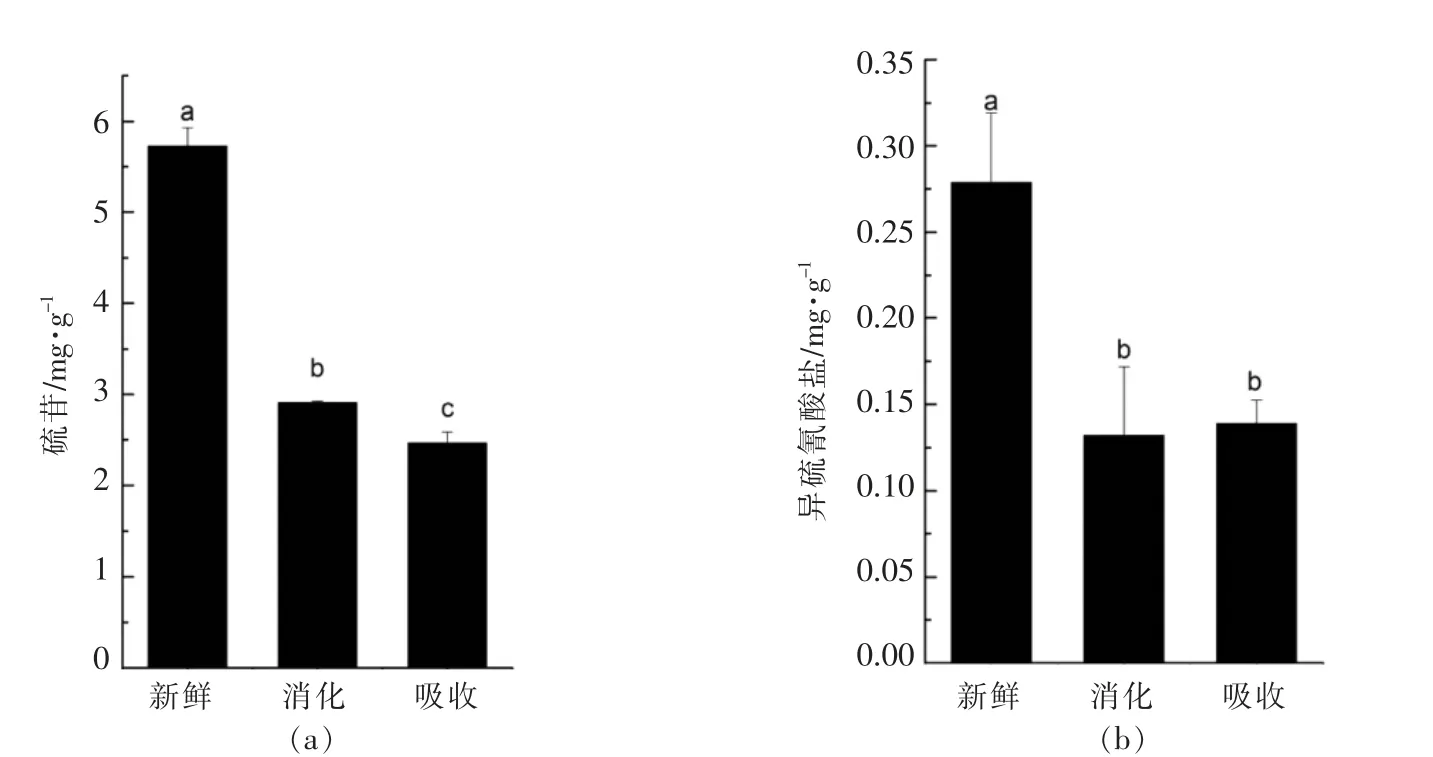
图2 体外模拟胃肠消化对萝卜苗中的硫代葡萄糖苷和异硫氰酸盐影响Fig.2 Effects of in vitro simulated gastrointestinal digestion on glucosinolates and isothiocyanates in radish sprouts
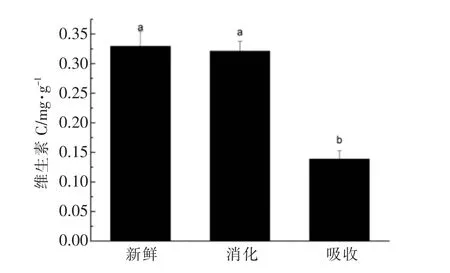
图3 体外模拟胃肠消化对萝卜苗中的维生素C 影响Fig.3 Effects of in vitro simulated gastrointestinal digestion on vitamin C in radish sprouts
体外胃消化对维生素C 的影响不显著,虽然与以前的发现[32]一致,但考虑磷酸盐缓冲溶液对维生素C 的提取效率不是最好的,也就是说在这个阶段有一部分维生素没有在提取物中,在试验结果中没有体现出来;胃消化阶段的pH 条件对维生素C 稳定性有非常小的影响,而在肠消化阶段的高pH 值条件也降低了维生素的低稳定性,最终显示与PBS 提取不显著。然而,在体外肠吸收后,维生素C 的透析部分浓度为42.14%,这与以前的橙汁和石榴汁[28,32]的研究结果一致,这是由于其在高pH 值下的低稳定性。因此,维生素C 的性能类似于酚类化合物的性能,与硫代葡萄糖苷的性能相反。
图4是萝卜苗体外模拟胃肠消化前、 后不同角度的抗氧化能力结果。对于FRAP,消化导致萝卜苗的总抗氧化能力剧烈下降(85.05%),而吸收又有少许回升(53.09%);对于DPPH,消化和吸收都导致萝卜苗的清除自由基能力显著下降(61.33%和64.77%);对于RP,消化导致萝卜苗的还原能力剧烈下降(20.39%),而吸收又有少许回升(16.25%);对于ASA,消化和吸收都导致萝卜苗的抗超氧阴离子能力显著上升 (205.15%和22.05%);对于SOD,消化对萝卜苗的超氧化物岐化酶活力影响不显著,而吸收却使得SOD 能力显著上升62.18%。
从这些结果中发现在模拟胃肠消化和吸收下,FRAP 和RP 能力变化趋势是一致的,均表现为先下降后略有回升,而DPPH 能力与ASA 能力变化相反,SOD 则只是吸收阶段显著上升。这些抗氧化能力检测机理不同,也就是萝卜苗中参与各个检测的活性物质情况各不一致。在胃肠消化过程中的pH、胃蛋白酶等因素导致食品中的抗氧化活性物质以原始形式降解,其它物质转化,结合形式解离等原因而释放,还有从非活性形式转化为活性形式[17,27]。因此,以单一抗氧化结果来判定多物质共存体系的抗氧化能力是不合理的,应以多角度,多层次(细胞外、内)来考虑功能特性的研究,同时考虑实际情况来综合评判。
以未经任何处理的新鲜采摘的萝卜苗为对照(CK),构建模型分析经过体外模拟胃肠消化(GD)的萝卜苗与对照组的差异,模型参数如表2所示。
从模型的参数值可知,不同试验组之间比较后,所构建的模型的质量较好,可以准确的反应不同组之间的差异情况。结果可以用于下一步分析。CK 与GD 的差异性代谢物数据如表3、表4所示。
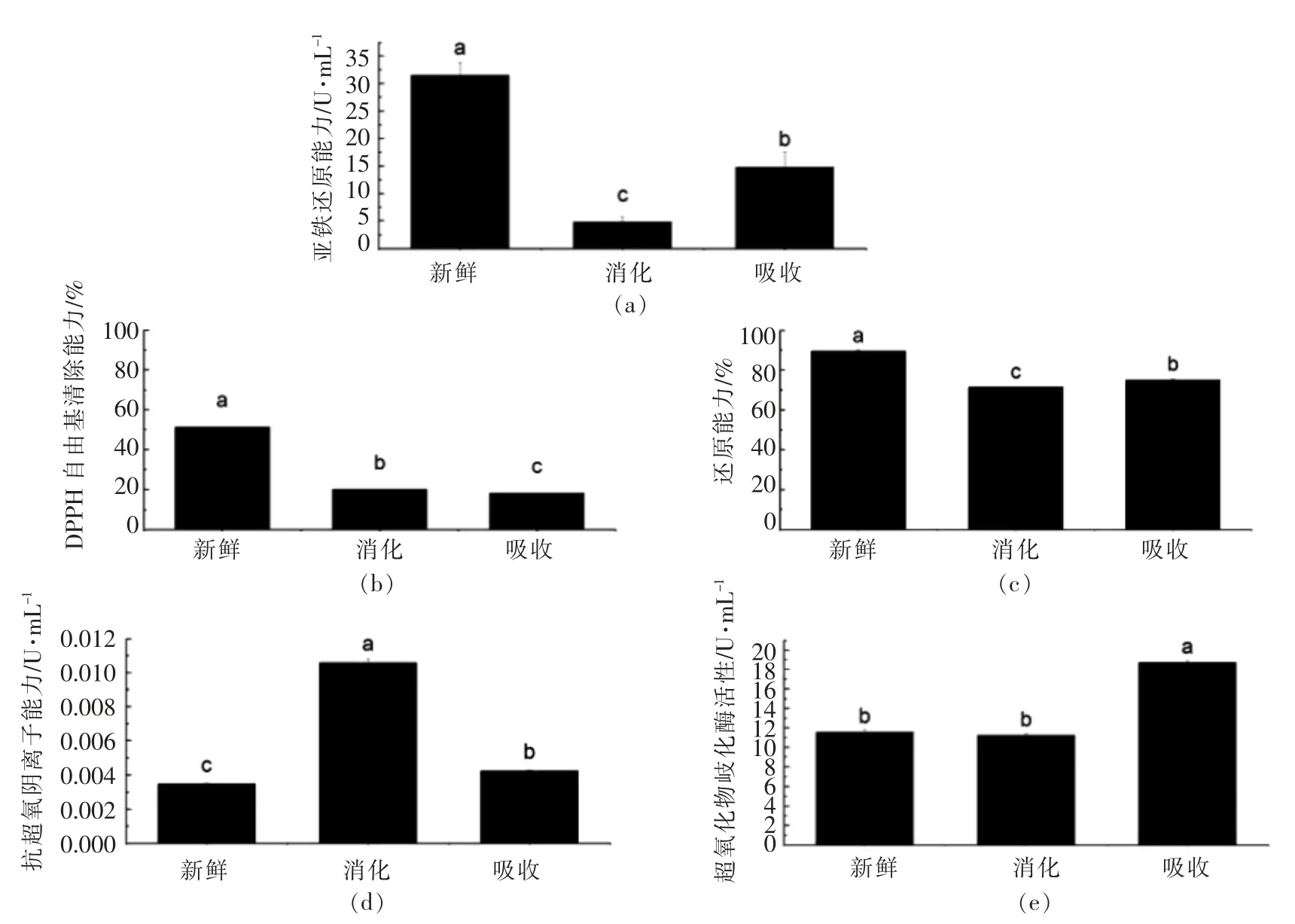
图4 体外模拟胃肠消化对萝卜苗的抗氧化能力影响Fig.4 Effects of in vitro simulated gastrointestinal digestion on antioxidant activity of radish sprouts
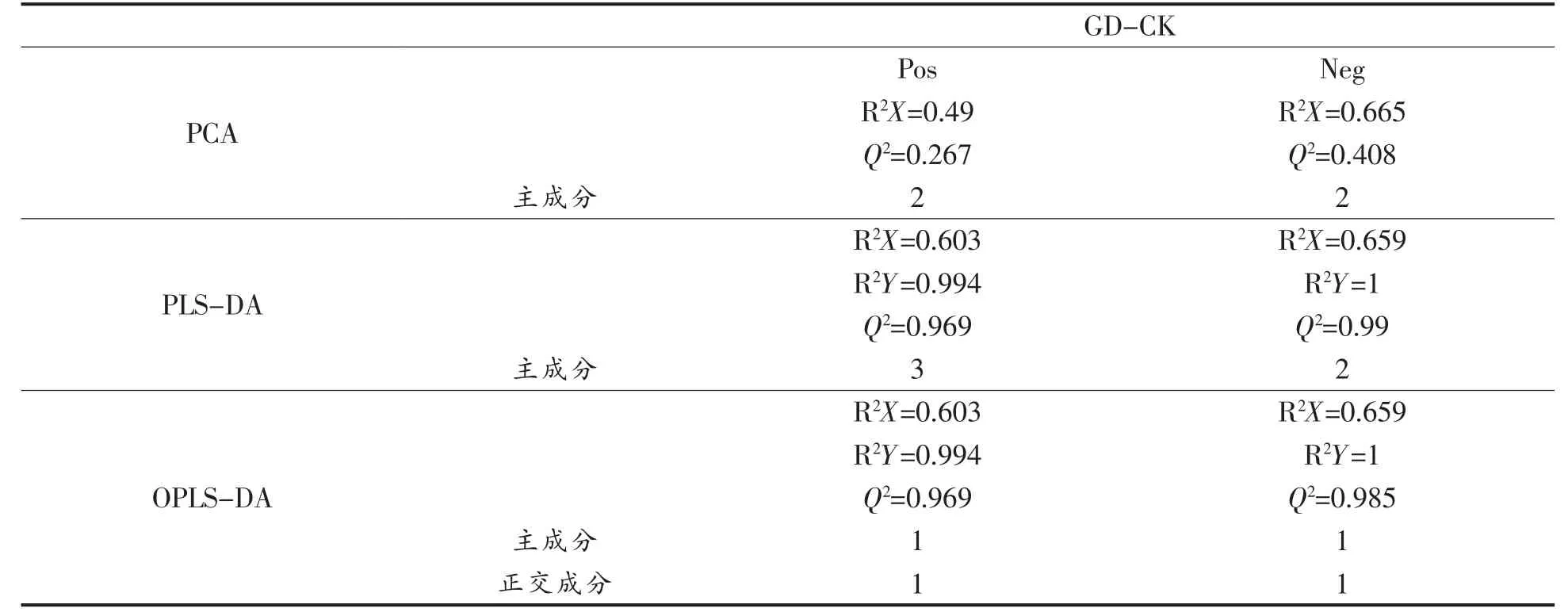
表2 体外模拟胃肠消化的萝卜苗的差异模型参数Table2 Differential model parameter of radish sprouts in vitro gastrointestinal digestion treatments
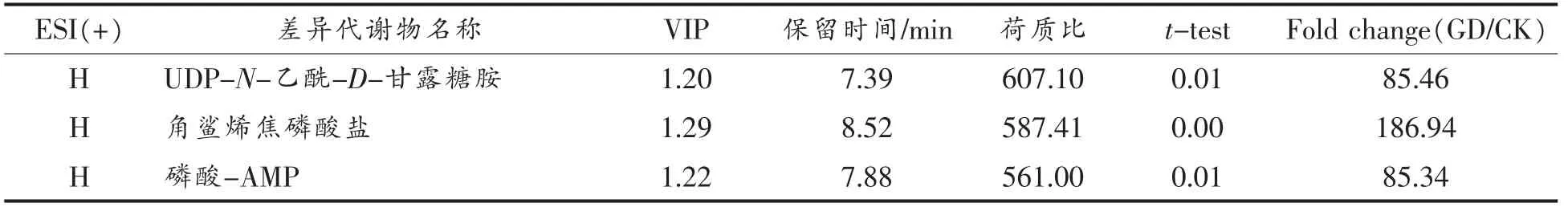
表3 正模式下CK-GD 两组的差异性代谢物Table3 The significantly different metabolites between CK-GD at ESI+

(续表3)
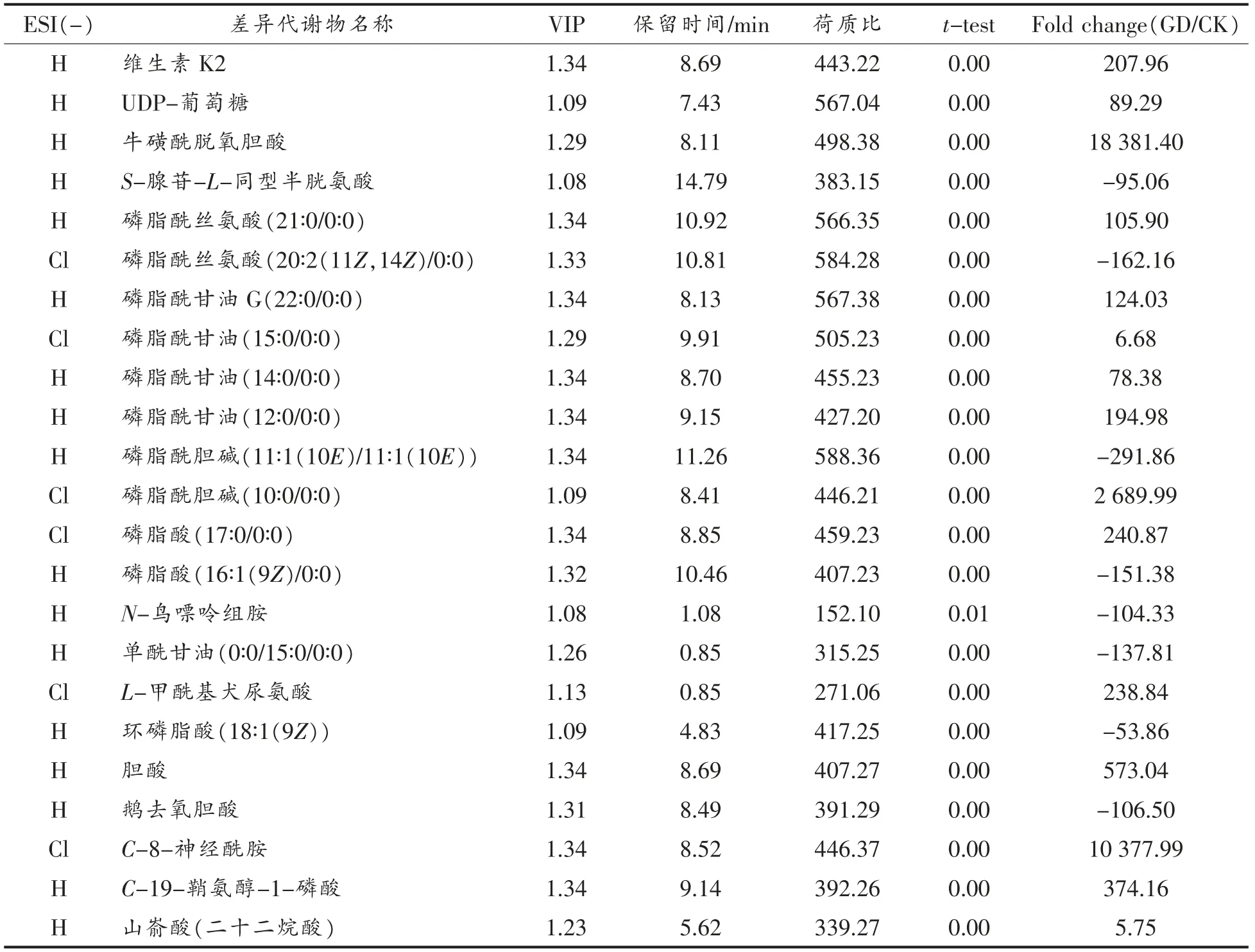
表4 负模式下CK-GD 两组的差异性代谢物Table4 The significantly different metabolites between CK-GD at ESI-
GD 试验组与CK 组相比在正负模式下的代谢差异物共有16+21 种,其中没有可以在正模式和负模式下均能检测的物质,所以共鉴定出37 种差异物,多以磷脂累积物、有机酸等为主。在正模式下检测出的差异物有16 种,Fold change 值基本上都大于10,多数高达上百甚至上千,表示这些差异物在GD 和CK 组之间差异巨大,基本上可以认为是萝卜苗在模拟胃肠消化后这些差异物含量剧烈上升,同时,这些代谢差异物涉及到的主要代谢途径有氨基糖和核苷酸糖代谢、组氨酸代谢、甘油磷脂代谢、组氨酸代谢/由组氨酸和嘌呤衍生的生物碱的生物合成、淀粉和蔗糖代谢、原发性胆汁酸生物合成/继发性胆汁酸生物合成、叶酸生物合成/苯丙素的生物合成等代谢过程。在负模式下的代谢差异物有21 种,其中有8 种代谢物的Fold change 值在-50 到-300 之间,基本上可以认为是萝卜苗在模拟胃肠消化后使这些差异物质量剧烈下降甚至消失,它们涉及到的代谢途径主要有半胱氨酸和蛋氨酸代谢、甘氨酸、丝氨酸和苏氨酸代谢/甘油磷脂代谢、甘油磷脂代谢、原发性胆汁酸生物合成等。而正模式下检测到的其它差异代谢物的Fold change 值在5-18 500 之间,属于模拟消化后含量急剧上升的物质,它们涉及的代谢途径主要有泛醌和其它萜类醌生物合成,戊糖、葡萄糖醛酸转换,甘氨酸、丝氨酸和苏氨酸代谢/甘油磷脂代谢、甘油磷脂代谢、色氨酸代谢、神经鞘脂的信号转导通路、不饱和脂肪酸的生物合成等。
萝卜苗的模拟消化前、 后的代谢差异物结果差异如此之大,表明未经消化吸收的样品的活性物质与人体消化后的实际吸收的营养价值的评判关系不大。
3 结论
1) 萝卜苗中的总酚在体外模拟胃消化后显著上升,而肠吸收后却比新鲜提取物中的总酚含量低。萝卜苗中的总酚酸在体外模拟胃消化和肠吸收下的变化与总酚类似,在消化后总酚酸却只增多了26.53%,研究也发现萝卜苗中的类黄酮和花青素在体外胃消化后分别显著降低 (33.66%和20.27%)。原花青素在模拟胃肠消化后的变化趋势与总酚类似,在消化后增加了19.15%,而肠吸收后急剧降低(80.35%)。这些主要是因为消化过程中的pH 值、胃蛋白酶等使得结合形式的多酚以有利形式释放出来,而模拟肠吸收阻挡了多数大分子酚类,只有苷元可以在小肠中被吸收。硫代葡萄糖苷在模拟胃肠消化后显著降低(49.18%),体外模拟胃消化后异硫氰酸盐显著下降,体外胃消化对维生素C 的影响不显著。
2) 消化导致萝卜苗的FRAP 能力剧烈下降(85.05%),吸收阶段有少许回升(53.09%);消化和吸收导致萝卜苗的清除自由基能力显著下降(61.33%和64.77%);消化导致萝卜苗的还原能力剧烈下降(20.39%),而吸收又有少许回升(16.25%);消化和吸收均导致萝卜苗的抗超氧阴离子能力显著上升(205.15%和22.05%);消化对萝卜苗的超氧化物岐化酶活力影响不显著,而吸收却使得SOD 能力显著上升62.18%。这些抗氧化能力检测机理不同和结果不同,也就是说,每种测试代表了萝卜苗中参与各个检测的活性物质情况各不一致。应以多角度,多层次(细胞外、内)来考虑功能特性的研究。
3) GD 试验组与CK 组相比共鉴定出37 种差异物,多以磷脂累积物、有机酸等为主。正模式下检测出的16 种差异物,Fold change 值多数高达上百甚至上千,可以认为是萝卜苗在模拟胃肠消化后这些差异物含量剧烈上升,在负模式下的代谢差异物有21 种,其中有8 种代谢物的Fold change 值在-50 到-300 之间,基本上可以认为是萝卜苗在模拟胃肠消化后使这些差异物质量剧烈下降甚至消失,而正模式下检测到的其它差异代谢物的Fold change 值在5-18 500 之间,属于模拟消化后含量急剧上升的物质。这些差异代谢物主要涉及氨基糖代谢、 组氨酸代谢、 甘油磷脂代谢、淀粉和蔗糖代谢、胆汁酸生物合成、泛醌和其它萜类醌生物合成、 不饱和脂肪酸的生物合成等代谢途径。未经消化吸收的样品的活性物质与人体消化后的实际吸收的营养价值评判关系不大。
