色素上皮衍生因子对氧化低密度脂蛋白诱导的巨噬细胞炎性反应的影响研究
2019-05-17张燕姚树桐田华王曙霞马守原李曼秦树存朱平
张燕,姚树桐,田华,王曙霞,马守原,李曼,秦树存,朱平
动脉粥样硬化(atherosclerosis,AS)是心血管疾病的主要病理基础,是一种以粥样斑块形成为特征的慢性血管炎性疾病[1-2]。既往研究表明,巨噬细胞与AS的发生、发展密切相关,抑制巨噬细胞炎性反应可能成为延缓AS进展的关键[3]。氧化低密度脂蛋白(oxidized low-density lipoprotein,Ox-LDL)作为贯穿 AS发生发展的关键致炎因子,在内皮细胞功能损伤及启动AS中发挥着重要作用[4]。色素上皮衍生因子(pigment epithelium-derived factor,PEDF)是一种丝氨酸蛋白酶抑制剂超家族的多功能糖蛋白,具有抗炎、抗氧化应激、稳定斑块等作用,其与AS发生密切相关[5-7]。笔者所在课题组前期研究发现,急性冠脉综合征(acute coronary syndrome,ACS)患者血浆PEDF水平低于健康人群,且PEDF在AS早期具有减轻Ox-LDL诱导的内皮细胞功能损伤等作用[8]。本研究旨在探讨PEDF对Ox-LDL诱导的巨噬细胞炎性反应的影响,现报道如下。
1 材料与方法
1.1 主要试剂与仪器 鼠源RAW 264.7巨噬细胞购自中国科学院上海生物化学与细胞生物学研究所细胞库,Ox-LDL(北京协生生物科技有限公司生产),胎牛血清(fetal calf serum,FBS)、DMEM 培 养 基(Gibco 公司生产),PEDF(PeproTech公司生产),CCK-8(上海碧云天生物科技有限公司生产),兔抗β-actin抗体(Sigma公司生产),抗白介素1(IL-1)抗体、抗单核细胞趋化因子1(MCP-1)抗体(Abcam公司生产),辣根过氧化物酶标记山羊抗兔免疫球蛋白G(IgG)(北京中杉金桥生物技术有限公司生产),增强化学发光(enhanced chemiluminescence,ECL)试剂盒(Pierce公司生产),PVDF膜(Millpore公司生产),Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司生产),IL-1、MCP-1酶联免疫吸附试验(ELISA)试剂盒(上海蓝基生物科技有限公司生产),RIPA裂解液、BCA蛋白定量试剂盒、二甲基亚砜(DMSO)、碱性磷酸盐、青链霉素混合液、胰蛋白酶、4×蛋白上样缓冲液、30%丙烯酰胺、4×SDSPAGE分离胶缓冲液、4×SDS-PAGE浓缩胶缓冲液(北京Solarbio公司生产)。
1.2 方法
1.2.1 细胞培养 本实验于2018年1—8月完成。采用DMEM培养基(含10% FBS、1%青链霉素混合液)于37 ℃、5%二氧化碳(CO2)培养箱中培养巨噬细胞。
1.2.2 细胞毒性试验 将DMEM培养基更换为含1%FBS的DMEM培养基,将巨噬细胞分为空白对照组及A、B、C、D组,A、B、C、D组细胞分别给予终浓度为 100、200、400、800 ng/ml的 PEDF 处理 24 h。
1.2.3 分组 将DMEM培养基更换为1% FBS的DMEM培养基培养12 h,之后将巨噬细胞随机分为实验对照组、炎性反应组、低浓度组、中浓度组、高浓度组。炎性反应组细胞加Ox-LDL 80 mg/L处理24 h诱导炎性反应;低浓度组、中浓度组、高浓度组分别加终浓度为100、200、400 ng/ml的 PEDF 处理 24 h, 之 后 加 Ox-LDL 80 mg/L 处理 24 h 诱导炎性反应。
1.3 CCK-8法 采用CCK-8法检测细胞活力,具体如下:将巨噬细胞以1×104/孔接种于96孔培养板内,按照上述分组方法处理细胞后,每孔加100 μl无FBS DMEM 培养基与 10 μl CCK-8,37 ℃继续培养 2 h。酶标仪在波长450 nm处测定各孔吸光度(optical density,OD)值,测定前轻微振荡。
1.4 Western blot法 采用 Western blot法检测细胞内IL-1和MCP-1蛋白表达,具体如下:将巨噬细胞以1×106/孔接种于6孔培养板内,按照上述分组方法处理细胞后,采用RIPA裂解液提取各组细胞蛋白,经BCA蛋白定量、金属浴变性处理,并进行SDS-PAGE(10%分离胶)分离后电转印至PVDF膜,5%脱脂奶粉封闭 2 h,后分别用兔抗 β-actin 抗体(1∶1 000)、抗 IL-1 抗 体(1∶1 500)、 抗 MCP-1 抗 体(1∶1 500)4 ℃孵育过夜,TBST-T洗膜3次,采用辣根过氧化物酶标记相应二抗孵育2 h,再次TBST-T洗膜3次。免疫条带用ECL法显影,暗室曝光,采用Image-Pro Plus软件分析蛋白条带积分吸光度(integrated absorbance,IA)值,以目的蛋白IA值/β-actin IA值的比值反映目的蛋白相对表达量。
1.5 ELISA 采用ELISA检测细胞外IL-1、MCP-1蛋白表达,具体如下:收集各组培养基,4 ℃ 1 000 r/min离心5 min(离心半径30 cm),取上清。取出试剂盒,于室温(20~25 ℃)放置 15~30 min。取出酶标板,按照标准品的次序分别加入50 μl标准品溶液于空白微孔中,空白微孔中加入50 μl样品,空白对照孔加入50 μl蒸馏水,在样品孔中加入10 μl生物素,除空白对照孔外各孔中加入100 μl酶标记溶液,将酶标板用封口胶密封,37 ℃孵育1 h。浓缩洗涤液用蒸馏水1∶100稀释,然后充分清洗酶标板5次,吸水纸彻底拍干。除空白对照孔外各孔加入显色剂A、B液各50 μl,室温避光反应15 min后各孔加入50 μl终止液终止反应,酶标仪在波长450 nm处测定各孔OD值。
1.6 Annexin V-FITC/PI双染法流 式 细胞术 采用Annexin V-FITC/PI双染法流式细胞术检测细胞凋亡率,具体如下:收集各组巨噬细胞,调整细胞密度为5×105/ml,4 ℃ 1 000 r/min 离心 10 min(离心半径 30 cm),冰冷PBS漂洗细胞2次。弃上清,加入500 μl Binding Buffer重悬细胞,加入 5 μl Annexin V-FITC 混匀后室温避光孵育 15 min,上机前 5 min 加入 5 μl碘化丙碇(propidium iodide,PI)染色,流式细胞仪检测细胞凋亡情况。凋亡细胞可定量分为4个细胞亚群,包括正常活细胞(左下象限:Annexin-/PI-)、坏死细胞(左上象限:Annexin-/PI+)、早期凋亡细胞(右下象限:Annexin+/PI-)和晚期凋亡细胞(右上象限:Annexin+/PI+),细胞凋亡率=早期细胞凋亡率+晚期细胞凋亡率。
1.7 统计学方法 采用SPSS 18.0统计学软件进行数据分析,计量资料以(± s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK法。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞毒性试验结果 空白对照组细胞活力为(0.569±0.009),A组 为(0.566±0.011),B组 为(0.561±0.008)、C组 为(0.558±0.009),D组 为(0.548±0.006)。各组细胞活力比较,差异有统计学意义(P<0.05);其中D组细胞活力低于空白对照组,差异有统计学意义(P<0.05);A、B、C组细胞活力与空白对照组比较,差异无统计学意义(P>0.05);PEDF 适宜干预浓度为 100、200、400 ng/ml。
2.2 细胞活力 实验对照组细胞活力为(0.524±0.031),炎性反应组为(0.333±0.022),低浓度组为(0.329±0.016),中浓度组为(0.289±0.021),高浓度组为(0.247±0.018)。各组细胞活力比较,差异有统计学意义(F=114.704,P<0.05);炎性反应组、低浓度组、中浓度组、高浓度组细胞活力低于实验对照组,中浓度组、高浓度组细胞活力低于炎性反应组,差异有统计学意义(P<0.05)。
2.3 细胞内外IL-1和MCP-1蛋白相对表达量 各组细胞内外IL-1和MCP-1蛋白相对表达量比较,差异有统计学意义(P<0.05);炎性反应组、低浓度组、中浓度组、高浓度组细胞内外IL-1蛋白相对表达量高于实验对照组,低浓度组、中浓度组、高浓度组细胞内外IL-1蛋白相对表达量低于炎性反应组,差异有统计学意义(P<0.05);炎性反应组、低浓度组、中浓度组、高浓度组细胞内外MCP-1蛋白相对表达量高于实验对照组,中浓度组、高浓度组细胞内外MCP-1蛋白相对表达量低于炎性反应组,差异有统计学意义(P<0.05,见表1、图1)。
表1 5组细胞内外IL-1和MCP-1蛋白相对表达量比较(±s)Table 1 Comparison of relative expression quantity of intracellular and extracellular IL-1 protein and MCP-1 protein in the five groups
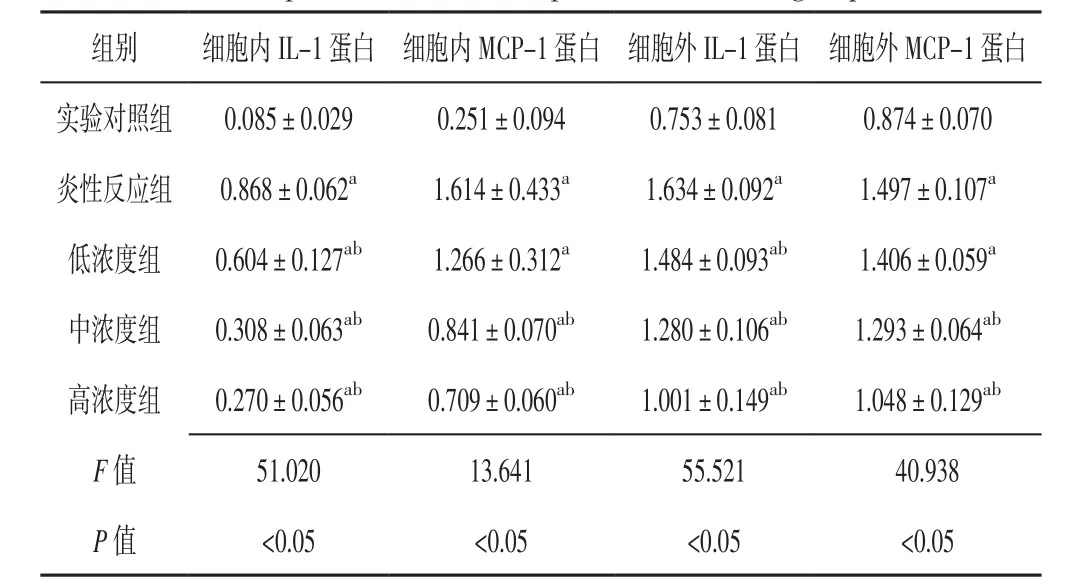
表1 5组细胞内外IL-1和MCP-1蛋白相对表达量比较(±s)Table 1 Comparison of relative expression quantity of intracellular and extracellular IL-1 protein and MCP-1 protein in the five groups
注:IL-1=白介素1,MCP-1=单核细胞趋化因子1;与实验对照组比较,aP<0.05;与炎性反应组比较,bP<0.05
组别 细胞内IL-1蛋白 细胞内MCP-1蛋白 细胞外IL-1蛋白 细胞外MCP-1蛋白实验对照组 0.085±0.029 0.251±0.094 0.753±0.081 0.874±0.070炎性反应组 0.868±0.062a 1.614±0.433a 1.634±0.092a 1.497±0.107a低浓度组 0.604±0.127ab 1.266±0.312a 1.484±0.093ab 1.406±0.059a中浓度组 0.308±0.063ab 0.841±0.070ab 1.280±0.106ab 1.293±0.064ab高浓度组 0.270±0.056ab 0.709±0.060ab 1.001±0.149ab 1.048±0.129ab F值 51.020 13.641 55.521 40.938 P 值 <0.05 <0.05 <0.05 <0.05
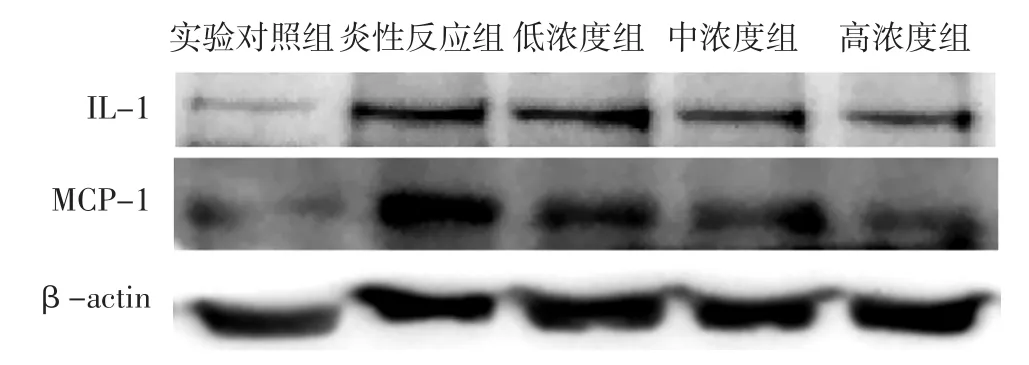
图1 5组细胞内IL-1和MCP-1蛋白表达电泳图Figure 1 Electrophoretogram for expression of intracellular IL-1 protein and MCP-1 protein in the five groups
2.4 细胞凋亡率 实验对照组细胞凋亡率为(9.937±1.459)%,炎性反应组为(14.060±1.128)%,低 浓 度 组 为(16.977±1.132)%, 中 浓 度 组 为(30.517±3.820)%,高浓度组为(40.200±4.431)%。各组细胞凋亡率比较,差异有统计学意义(F=40.928,P<0.05);炎性反应组、低浓度组、中浓度组、高浓度组细胞凋亡率高于实验对照组,中浓度组、高浓度组细胞凋亡率高于炎性反应组,差异有统计学意义(P<0.05,见图2)。
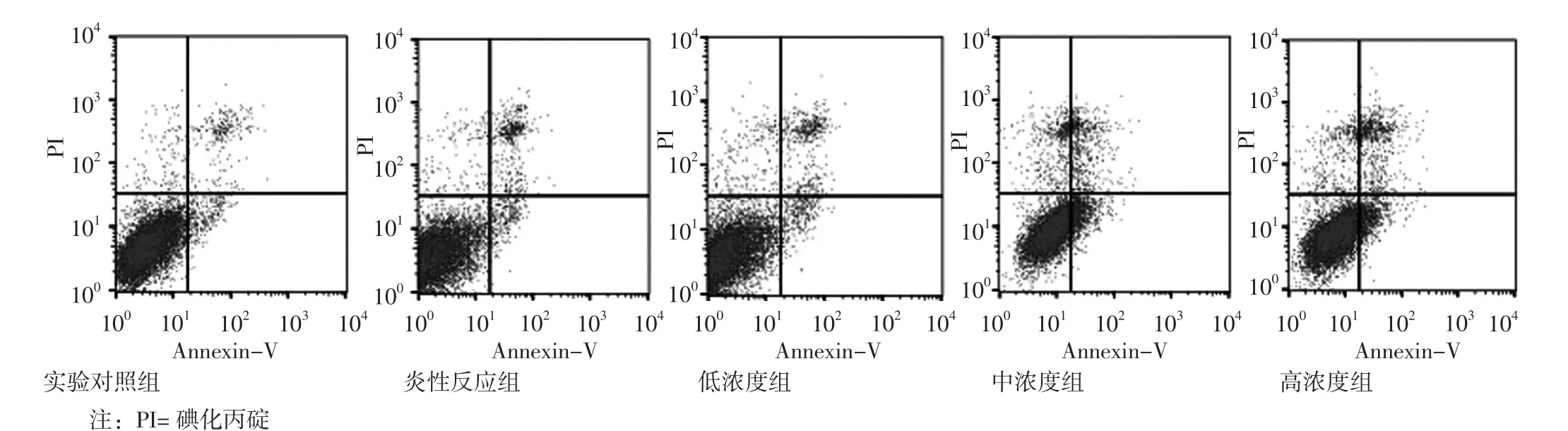
图2 5组流式细胞图Figure 2 Flow cytometry for the five groups
3 讨论
AS是一种全身、弥漫性血管壁慢性炎性反应,可导致心、脑、肾等重要脏器功能损伤,其主要病理过程与炎性反应密切相关,故在AS早期抗炎或可成为其治疗关键。Ox-LDL可诱导炎性反应,上调血管内皮细胞及巨噬细胞产生炎性因子,促进巨噬细胞迁移至血管内皮下吞噬脂质,进一步进展为泡沫细胞,其在AS始动阶段具有关键作用,但具体机制尚未十分清楚。既往研究表明,局部和系统性炎性反应是导致AS斑块不稳定的关键,减轻巨噬细胞炎性反应有利于增加斑块稳定性[9-10]。巨噬细胞是释放促炎因子和破坏斑块稳定性因子的主要细胞群,因此抑制巨噬细胞炎性反应可能抑制AS进展。
PEDF是最先在人胎儿视网膜色素上皮细胞培养基中发现的一种神经营养活性物质,体内多种细胞均可表达PEDF蛋白,其具有抑制血管新生及炎性反应、抗肿瘤、抗氧化应激、抗血栓形成、促进细胞凋亡、免疫调节等作用[11-14]。本研究结果显示,D组细胞活力低于对照组,A、B、C组细胞活力与空白对照组比较差异无统计学意义,提示PEDF终浓度为800 ng/ml对细胞有明显毒性作用,PEDF适宜干预浓度为100、200、400 ng/ml。
巨噬细胞通过在血管内皮迁徙、聚集、释放炎性因子及炎性趋化因子(如MCP-1、IL-1)等复杂过程而导致炎性反应[15]。既往研究表明,PEDF可通过抑制AS过程中MCP-1、IL-1、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)等各种炎性因子生成,进而发挥抗炎作用[16]。本研究结果显示,炎性反应组、低浓度组、中浓度组、高浓度组细胞内外IL-1蛋白相对表达量高于实验对照组,低浓度组、中浓度组、高浓度组细胞内外IL-1蛋白相对表达量低于炎性反应组;炎性反应组、低浓度组、中浓度组、高浓度组细胞内外MCP-1蛋白相对表达量高于对照组,中浓度组、高浓度组细胞内外MCP-1蛋白相对表达量低于炎性反应组,提示终浓度为200、400 ng/ml的PEDF能有效下调IL-1和MCP-1蛋白表达,进而发挥抗炎作用。
WEN等[17]研究表明,降低巨噬细胞活性或促进巨噬细胞凋亡均可达到抗炎效果,因此促进巨噬细胞凋亡实质也是抗炎过程。本研究结果显示,炎性反应组、低浓度组、中浓度组、高浓度组细胞活力低于实验对照组,细胞凋亡率高于实验对照组;中浓度组、高浓度组细胞活力低于炎性反应组,细胞凋亡率高于炎性反应组,提示终浓度为200、400 ng/ml的PEDF能有效降低巨噬细胞活力、促进细胞凋亡。
综上所述,终浓度为200、400 ng/ml的PEDF能有效降低巨噬细胞活力,下调IL-1和MCP-1蛋白表达,促进巨噬细胞凋亡,进而抑制Ox-LDL诱导的巨噬细胞炎性反应。但PEDF延缓AS发展的可能机制仍有待进一步研究探索。
作者贡献:姚树桐、秦树存进行文章的构思与设计;张燕、马守原、李曼进行研究的实施与可行性分析;张燕进行数据收集、整理、分析,结果分析与解释,负责撰写论文;田华、王曙霞进行论文的修订;王曙霞、秦树存负责文章的质量控制及审校;朱平对文章整体负责,监督管理。
本文无利益冲突。
