大黄鱼源杀香鱼假单胞菌外膜蛋白OmpA的原核表达及免疫原性分析
2019-05-17许文军谢建军王庚申
汪 浩 ,汪 玮 ,2,许文军 ,2,施 慧 ,2,何 杰 ,2,谢建军 ,2,王庚申 ,2
(1.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021;2.浙江省海水增养殖重点实验室,浙江舟山 316021)
杀香鱼假单胞菌Pseudomonas plecoglossicida,最早由日本学者在香鱼上发现,因其可引起香鱼出血性腹水症、致死率高而得名[1]。近年来,在我国浙东及福建等地沿海地区网箱养殖的大黄鱼频繁爆发一种疾病,死亡率达50%以上,该病以鱼体脾、肾等内脏器官出现大量白色结点为症状,被命名为内脏白点病[2]。经多位学者研究,证实引起大黄鱼内脏白点病的病原为杀香鱼假单胞菌[3-4]。目前,杀香鱼假单胞菌引起的大黄鱼内脏白点病每年均有不同程度的爆发,尚无有效的防治方法[5],已成为威胁大黄鱼养殖业发展的主要病原之一。
外膜蛋白定位于革兰氏阴性细菌的表面,作为菌体与宿主接触的第一界面,通常可引起宿主的特异性免疫反应,具有良好的免疫原性,是亚单位疫苗开发中具有潜力的一类候选免疫原[6-7]。外膜蛋白A(OmpA)是一类具有跨膜结构的外膜蛋白,在大肠杆菌中研究最为透彻,其主要功能是维持外膜的完整性,同时也参与病原对宿主的黏附、侵染、免疫防御和逃逸等功能[8-9]。已有研究表明,OmpA可增强菌体的致病力,是一个重要的毒力因子[10-11],利用重组表达的OmpA作为免疫原在多个物种中均显著提高了免疫后宿主的抵抗力和存活率[12-15]。本研究选取杀香鱼假单胞菌基因组中存在的3个OmpA类蛋白,通过基因工程手段获得原核表达的重组蛋白,并利用制备的杀香鱼假单胞菌多克隆抗体对重组蛋白进行免疫原性分析,旨在为杀香鱼假单胞菌的外膜蛋白亚单位疫苗的研制提供参考。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
大黄鱼源杀香鱼假单胞菌株ZS1403001由本实验分离保存,大肠杆菌克隆感受态细胞DH5α购自Takara公司,表达感受态细胞BL21(DE3)、BL21(DE3)pLysS购自全式金公司,原核表达载体pET30(a)由华中农业大学兰江风博士惠赠,pEasy-T载体购自全式金公司。
1.1.2 实验动物
制备多克隆抗体所用的SPF级新西兰兔(♀)购自浙江省实验动物中心,体重约1 kg。
1.1.3 试剂与仪器
主要试剂:高保真ExTaq聚合酶、DL2,000 DNA marker、细菌基因组提取试剂盒购自Takara公司,快速内切酶、T4连接酶、Western Blot Kit购自全式金公司,胶回收和质粒小提试剂盒购自OMEGA公司,LB培养基、琼脂糖、His标签蛋白纯化柱购自上海生工生物公司,羊抗兔IgG-HRP购自索莱宝公司。
主要仪器:Applied biosystems 2720型PCR仪,伯乐(Bio Rad)核酸电泳仪、凝胶成像系统、Trans-Blot SD半干转印槽,NanoDrop 2000c核酸分析仪、上海一恒THZ-100B恒温摇床、GHP-9080生化培养箱,华利达HS-800D水浴锅,北京六一DYY-8C蛋白电泳仪。
1.2 引物设计与合成
根据GenBank公布的杀香鱼假单胞菌OmpA蛋白序列EPB94769.1(P1),EPB94930.1(P2),EPB95835.1(P5),在基因组脚手架中找到对应的编码序列,用DNAMAN软件对序列进行分析,选择适当的克隆酶切位点,并通过Primer Premier 5.0软件设计扩增引物。本研究设计的引物和各自携带的酶切位点信息如表1所示(序列下划线部分为酶切位点)。设计好的引物交由上海生工生物公司合成纯化。
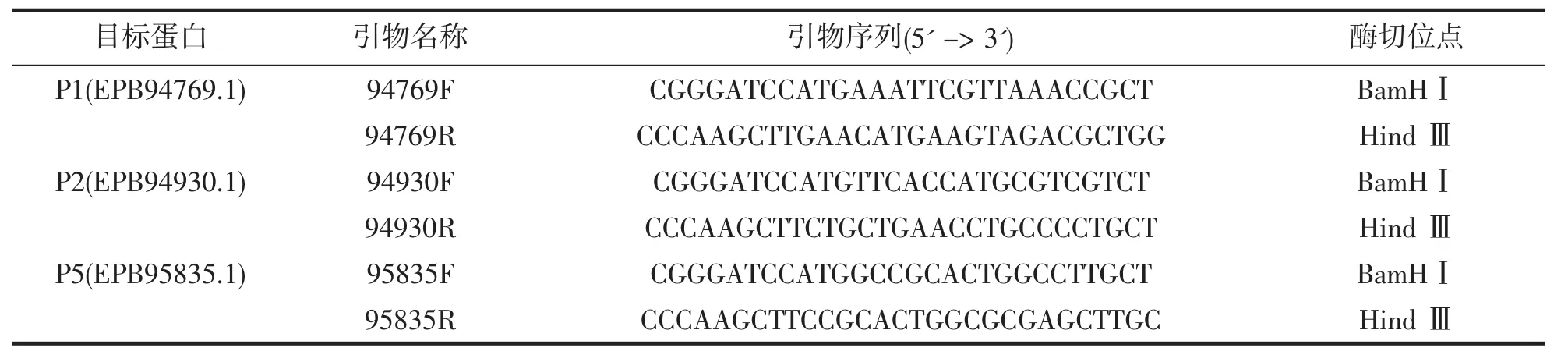
表1 本研究中使用的引物Tab.1 Primers used in this study
1.3 外膜蛋白基因的克隆
利用细菌基因组提取试剂盒对本实验室分离保存的杀香鱼假单胞菌株ZS1403001进行基因组抽提,以此作为外膜蛋白基因克隆的模板。根据表1所列引物特征选取合适的退火温度(Tm),进行PCR扩增,PCR 程序为:95 ℃,5 min;94 ℃,30 s,Tm,40 s,72 ℃,45 s,30 cycles;72 ℃,8 min。PCR 产物经电泳鉴定纯度后进行回收,回收产物与T载体相连、转化DH5α。用抗生素平板作筛选,并用载体引物M13F/R作PCR验证,阳性转化子送生工生物公司测序。测序结果比对无误的克隆冻存于-80℃。
1.4 重组表达载体的构建
上述构建好的T载体克隆经扩大培养后抽提质粒,经NanoDrop2000c测定浓度后,与pET30(a)质粒同时分别作BamHⅠ+HindⅢ双酶切,酶切体系为:质粒1 μg;快切酶buffer 5 μL;快切酶BamHⅠ和HindⅢ各1 μL;加ddH2O至50 μL。酶切温度37℃,时间为30 min。酶切结束后,pET30(a)质粒组加入1 μL CIAP酶继续孵育1 h进行载体去磷酸化。将两组酶切产物经电泳区分条带,回收各自对应的目的带,对回收产物作浓度测定。
将酶切回收产物中片段和载体按照摩尔比 (3~10)∶1混合、加入T4连接酶作连接,连接产物转化DH5α,用卡那霉素平板作筛选,并用片段的F端引物与载体的R端引物进行PCR检测,阳性转化子送上海生工生物公司进行测序验证,序列经比对无误的克隆冻存于-80℃。
1.5 重组蛋白诱导表达及纯化
上述构建好的重组表达质粒转化BL21(DE3)感受态,挑取单克隆在含卡那霉素的LB中培养至对数期,加入 IPTG 至终浓度为 0.4~1 mmol·L-1,转移至 30 ℃恒温摇床,150 r·min-1诱导 5 h,离心收集菌体,加入 1/10 菌液体积的 buffer B 裂解液(8 mo·L-1尿素,100 mmol·L-1NaH2PO4·H2O,10 mmol·L-1Tris·HCl,pH=8.0),常温摇床裂解 1 h,15 000 r·min-1离心 20 min,收集上清,取 20 μL 作 SDS-PAGE 电泳,根据电泳结果调整并选取最佳的IPTG诱导浓度。对于表达量低的重组蛋白,将其质粒重新转化BL21(DE3)pLysS感受态,尝试通过抑制菌株的本底表达量来优化表达。
经优化获得最佳表达的菌株,通过500 mL锥形瓶扩大培养,收集的菌体用适量的Binding buffer(20 mmol·L-1Tris、250 mmol·L-1NaCl,pH=7.8)悬起,加入 1‰体积的溶菌酶,混匀后,经-80 ℃冻融 1 次。超声破碎菌体,离心收集上清,沉淀用buffer B裂解,通过SDS-PAGE分析重组蛋白在细胞中的存在位置。收集对应位置的蛋白液,经0.45 μm滤膜过滤后,用镍柱作蛋白纯化。纯化蛋白经SDS-PAGE检测大小和纯度。
1.6 杀香鱼假单胞菌多克隆抗体的制备
新西兰兔饲养观察1周,确定无异常后,耳静脉采血,制备阴性对照血清。从-80℃保存的菌株ZS1403001取少量划线接种于盐度20的TSA平板,28℃培养48 h,挑取单克隆转移至液体TSB培养基中,28℃,180 r·min-1培养至对数期,测定菌液浓度,加入5‰甲醛灭活24 h,取少量菌液涂板确认灭活后,离心收集菌体,用生理盐水洗涤3次,加入适量的生理盐水调整菌液浓度至1.0×1011CFU·mL-1。
参考前人免疫方案[16-17],稍作修改,具体如下:背部皮下多点注射免疫,首次免疫取0.5 mL 1.0×1010CFU·mL-1的菌体与等体积的弗氏完全佐剂混合后,分5点注射;间隔20 d后,取0.5 mL 1.0×1011CFU·mL-1的菌体与等量弗氏不完全佐剂混合注射;间隔10 d后,同样剂量再次增强免疫1次;三免结束后间隔1周,耳静脉采血,参照前人方法[18]通过ELISA测定血清抗体效价。
1.7 重组蛋白免疫原性的Western Blot检测
上述纯化获得的重组蛋白用Bradford法测量浓度,取等量的重组蛋白P1、P2、P5,经SDS-PAGE电泳后,电转至硝酸纤维素膜上,5%BSA封闭过夜,以制备的新西兰兔抗杀香鱼假单胞菌多克隆抗体作为一抗,羊抗兔IgG-HRP为二抗,孵育完成后,加入配制好的Western Blot显色液显色1 min后,拍照观察,用Clinx图像分析软件(上海勤翔公司)对条带浓度进行对比分析。
2 结果
2.1 外膜蛋白基因克隆与重组表达质粒的构建
以本实验室保存的杀香鱼假单胞菌株ZS1403001的基因组作为模板,通过优化PCR退火温度,获得P1,P2,P5的特异扩增条带,大小依次为 515 bp、728 bp、809 bp(含酶切位点,图 1),与预期大小一致。切取条带回收后连接于T载体,用M13F引物测序,测序结果与NCBI序列比对,均为100%吻合,说明PCR过程无突变产生。将获得的T载体克隆依次命名为P1T,P2T,P5T。
将上述T质粒与pET30(a)载体同时分别用BamHⅠ和HindⅢ作双酶切,酶切结果如图2所示:P1T、P2T、P5T双酶切可见2条带,其中片段条带大小与各自基因序列大小相吻合;pET30(a)载体双酶切可见1条带,相比酶切前电泳图谱有明显位移,说明酶切成功。酶切产物各自连接转化DH5α后,PCR筛选阳性克隆并进一步测序检测,插入片段和位置均无误的克隆依次命名为P1P,P2P,P5P。
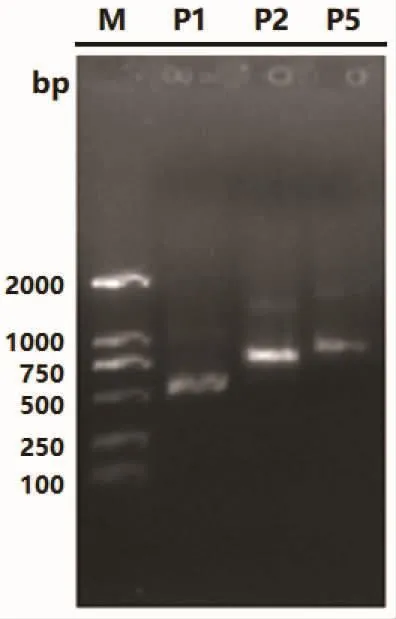
图1 外膜蛋白基因的PCR扩增Fig.1 PCR amplification of the outer membrane protein gene
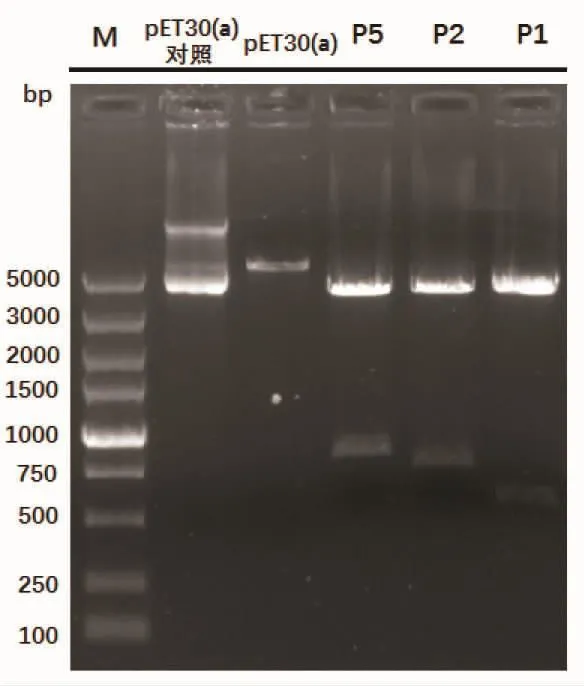
图2 重组质粒与pET30(a)载体双酶切Fig.2 Double enzyme digestion of the recombinant plasmid and pET30(a)vector
2.2 重组蛋白的诱导表达和纯化
重组表达质粒 P1P,P2P,P5P分别转化 BL21(DE3),挑取阳性克隆用试管作小量培养诱导,SDSPAGE结果显示,P5P表达条带显著,P1P、P2P则无明显表达。将P1P、P2P重新转化BL21(DE3)pLysS,经小量诱导,获得显著表达 (图3),3个表达株的最佳IPTG 诱导浓度均为 0.4 mmol·L-1。
小量诱导获得表达的3个菌株扩大培养、诱导后,经检测,表达的蛋白均位于包涵体中。用镍柱对收集的蛋白进行纯化,获得的重组蛋白如图3所示:P1,P2,P5条带所在区间与理论预测的蛋白分子量(25 kD,32 kD,35 kD)一致。
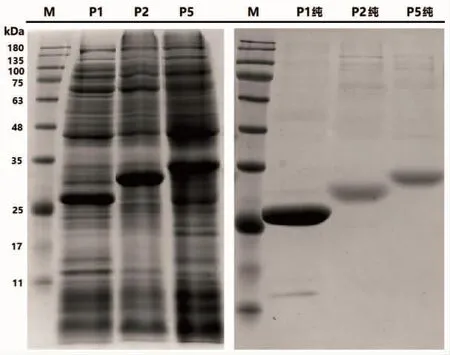
图3 重组蛋白纯化前后电泳图Fig.3 SDS-PAGE analysis of the recombinant protein before and after purification
2.3 杀香鱼假单胞菌多抗的效价检测
以甲醛灭活的杀香鱼假单胞菌为抗原包被ELISA板,新西兰兔免疫前血清为阴性对照,测定三免后收集的血清中抗体的效价。当检测孔的OD450读数与阴性对照孔的读数比值大于2.1时,视为阳性。如图4所示,本实验制备的多抗效价达到1∶6 400以上,满足后续Western Blot检测等要求。
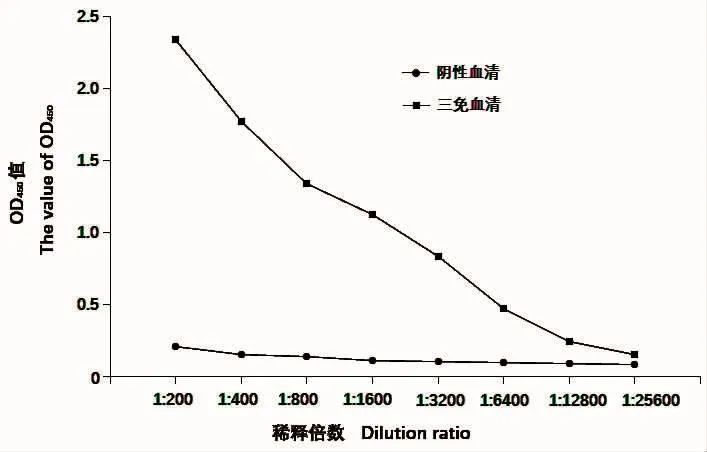
图4 ELISA检测兔血清抗体效价Fig.4 Analysis of the rabbit serum titer by ELISA
2.4 重组蛋白免疫原性分析
等量的重组蛋白P1、P2、P5经PAGE电泳、半干法转膜、抗体孵育、Western Blot显色后,所得结果如图5所示:P1,P2,P5均能与杀香鱼假单胞菌兔抗产生特异结合,但结合强度存在显著差异。用Clinx图像分析软件对3个免疫条带的浓度进行分析,结果以光密度值显示,3个外膜蛋白的免疫原性由强到弱依次为 P5>P2>P1。
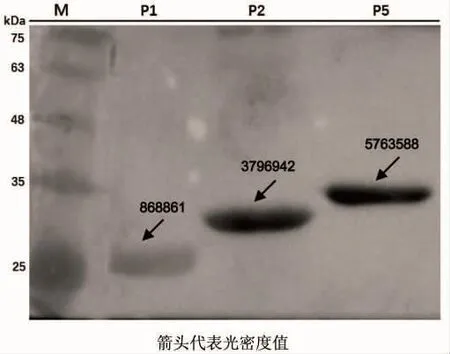
图5 重组蛋白免疫原性的Western Blot检测Fig.5 Immunogenicity analysis of the recombinant protein by Western Blot
3 讨论
杀香鱼假单胞菌作为大黄鱼内脏白点病的致病原,目前已公布基因组草图信息[3],这为通过反向疫苗学设计、筛选亚单位疫苗提供了可能性。外膜蛋白作为病原与宿主互作的关键因子,是极具潜力的候选免疫原之一。郑宗林等[13]以嗜水气单胞菌OmpA重组蛋白免疫斑点叉尾鮰Ictalurus punctatus,获得高达85.71%的相对保护率,且免疫后鱼体血清抗体水平显著提高。LI Hui,et al[23]发现溶藻弧菌和副溶血弧菌的OmpA存在交叉免疫作用并在鲤鱼Cyprinus carpio免疫试验中有着良好的免疫保护率。本研究从已公布的大黄鱼源杀香鱼假单胞菌NB2011基因组中,选取了3个OmpA类外膜蛋白P1、P2、P5,其中P1含有与大肠杆菌OmpA的N端相似的结构域(EMBL:IPR000498),P2、P5则含有与大肠杆菌OmpA的C端相似的结构域(EMBL:IPR006665)[21]。通过克隆及优化表达发现,P5可在BL21(DE3)中被大量诱导,P1和P2在BL21(DE3)中诱导表达量极低,而在抑制了背景表达水平的BL21(DE3)pLysS感受态中则能正常被IPTG诱导,说明P1和P2的表达可能对宿主菌存在一定的毒性。3个重组表达的蛋白经镍柱纯化后均获得了条带单一的重组蛋白,说明本研究设计的克隆引物在重组蛋白中引入了正确的His标签序列。
如何快速、高效的从制备的抗原蛋白中,筛选出具有高保护效应(高免疫原性)的抗原,是亚单位疫苗开发设计的关键。为了降低疫苗筛选工作量,通常可在个体免疫试验前,采用病原的抗体对候选抗原作免疫原性的初步筛选。对于鱼类病原,由于现有的针对鱼类抗体的商品化二抗产品相对稀少,给抗原的筛选增加了难度。VERJAN,et al[19]曾尝试利用兔抗对迟缓爱德华氏菌的抗原进行筛选,获得7个免疫原,进一步研究发现,其中有4个免疫原均能与牙鲆的抗血清发生免疫反应。CHEN Zijun,et al[20]利用小鼠的多克隆抗体对抽提的嗜水气单胞菌外膜蛋白组分作初步筛选,并对筛出的抗原作进一步鱼体免疫试验,成功获得一个保护率达71.4%的候选免疫原。上述研究均佐证了利用哺乳类抗体代替鱼类抗体筛选鱼类病原免疫原的可能性。本研究基于上述基础,设计了通过杀香鱼假单胞菌兔抗体对克隆表达的重组OmpA进行免疫原性的初步分析试验。从初步的检测结果看,P1、P2、P5的重组蛋白均能与杀香鱼假单胞菌的兔抗体发生特异结合,说明3个重组外膜蛋白均带有抗原表位,具备一定的免疫原性;同时,P2、P5与兔抗体的结合强度又显著强于P1,这可能与3个蛋白各自所带的结构域有关:P2和P5带有相似的结构域,与大肠杆菌OmpA的C端同源,P1的结构域则与大肠杆菌OmpA的N端同源。江年等[22]曾对多种革兰氏阴性菌的OmpA结构作生物信息学分析,结果显示,OmpA的N端结构域在假单胞菌中变异性高,不同种的相似度仅为30%左右,这也部分揭示了P1免疫原性相对较弱的一种可能性——可能源于病原在进化上形成的对宿主的免疫逃逸。
综上,本研究为大黄鱼源杀香鱼假单胞菌免疫原的筛选提供了有益的参考,制备的3个外膜蛋白均显示出一定的免疫原性,其中P2、P5免疫原性强,具有进一步鱼体免疫试验的价值。
