氨氮急性攻毒及去毒后棘胸蛙蝌蚪肝脏和尾部皮肤相关功能酶活力的变化特征
2019-05-17张利君申屠琰郑晓静刘哲宇申屠基康王志铮
张利君,申屠琰,郑晓静,刘哲宇,申屠基康,王志铮
(1.浙江海洋大学水产学院,浙江舟山 316022;2.余姚市水产技术推广中心,浙江余姚 315040;3.宁波市海洋与渔业研究院,浙江宁波 315000)
氨氮是水产养殖动物经常面临的环境胁迫因子。据报道,氨氮胁迫会导致水生动物体内生成自由基[1],水环境中任何可测的氨氮质量浓度对水生动物都会产生有害影响[2],水生动物为应对氨毒侵害,往往会采取降低自身产氨量,以保持机体内稳态机制的耐氨策略[3-4],当氨氮胁迫强度持续超过水生动物机体调节阈值时,会造成体内抗氧化系统的破坏,和部分抗氧化物质含量及酶活性的降低,导致机体清除自由基能力的显著下降[5]。因此,研究氨氮急性攻毒及去毒恢复后目标水产养殖动物抗氧化酶活力的变化特征,进而探究目标水产养殖动物的抗氧化保护对策与机制,无疑对指导目标水产养殖动物的安全养殖具有重要现实意义。
棘胸蛙Paa spinosa隶属于两栖纲、无尾目、蛙科、棘蛙属,系我国南方丘陵地区生长的一种特有大型食用蛙,素有“百蛙之王”之美誉,现已成为我国南方部分山区的重要特种养殖对象。研究发现,环境胁迫因子(如水体pH、温度、盐度、氨氮等)变化诱导的生理效应可能经由氧化还原途径实现[6-7],棘胸蛙蝌蚪尾部皮肤和肝脏作为氨氮攻毒的主要靶器官[8],两者抗氧化酶和尾部皮肤ATP酶是应答水温耐受与响应的重要生理靶标[9]。基于此,笔者以棘胸蛙蝌蚪为研究对象,开展了氨氮急性攻毒及去毒恢复期间肝脏SOD、CAT、GSH及尾部皮肤SOD、CAT、ATP酶活力的变化特征研究,试图从抗氧化酶学角度进一步探究蝌蚪的氨毒耐受与响应机制,以期为该蛙蝌蚪的集约化安全养殖提供基础资料。
1 材料与方法
本研究在浙江海洋大学安全实验室内进行。所用供试蝌蚪、实验水源及实验用水配置与日换水方法完全同牛春格等[8]。根据氨氮对棘胸蛙蝌蚪急性攻毒实验结果[8],设置 0 mg·L-1(对照组)、2.45 mg·L-1、4.90 mg·L-1、7.35 mg·L-1、9.80 mg·L-1、12.25 mg·L-1、14.70 mg·L-1、17.15 mg·L-1、19.60 mg·L-1等 9 个氨氮质量浓度梯度,以内径32 cm的白色平底塑料园盆为实验容器单元(实验实际容积为5 L),每个实验梯度均设3个重复,每个实验容器单元内各放供试蝌蚪12 ind,采用静水停饲实验法,以96 h为氨氮胁迫时长,12 d为去毒恢复(实验用水氮质量浓度为 0 mg·L-1)时长,以 24 h、48 h、72 h、96 h和去毒后 6 d、12 d为测定时点,开展氨氮对棘胸蛙蝌蚪尾部ATP、SOD、CAT和肝脏SOD、CAT、GSH酶活力的影响实验。每一测定时点从各实验梯度中任取实验蝌蚪3 ind,于冰盘上解剖取尾部皮肤组织和肝脏后,逐一编号并保存于-80℃超低温冰箱备测。本研究所用酶活力测试试剂盒均购自南京建成生物工程研究所,以岛津UV-1240型紫外可见分光光度计为检测仪,测定步骤及计算方法按所附说明书。采集实验所测数据,借助SPSS 17.0软件,采用LSD多重比较法检验各实验梯度组间的差异显著性(P<0.05为显著水平)。
2 结果
2.1 尾部皮肤ATP酶活力
由图1可见,实验期间蝌蚪尾部皮肤ATP酶活力的变化特征主要表现为:(1)急性攻毒阶段,各测定时点酶活力均有随氨氮攻毒质量浓度增加而呈显著下降的趋势(P<0.05);(2)去毒恢复阶段,随氨氮攻毒质量浓度增加,各测定时点酶活力大体上均呈先升后降的趋势,峰值均出现于氨氮质量浓度17.15 mg·L-1实验组(P<0.05),且其它实验组酶活力则均显著大于对照组(P<0.05)。由此可知,蝌蚪尾部皮肤ATP酶对氨氮极为敏感,原氨氮质量浓度17.15 mg·L-1为去毒后蝌蚪尾部皮肤ATP酶活力获得补偿性提高的高限。
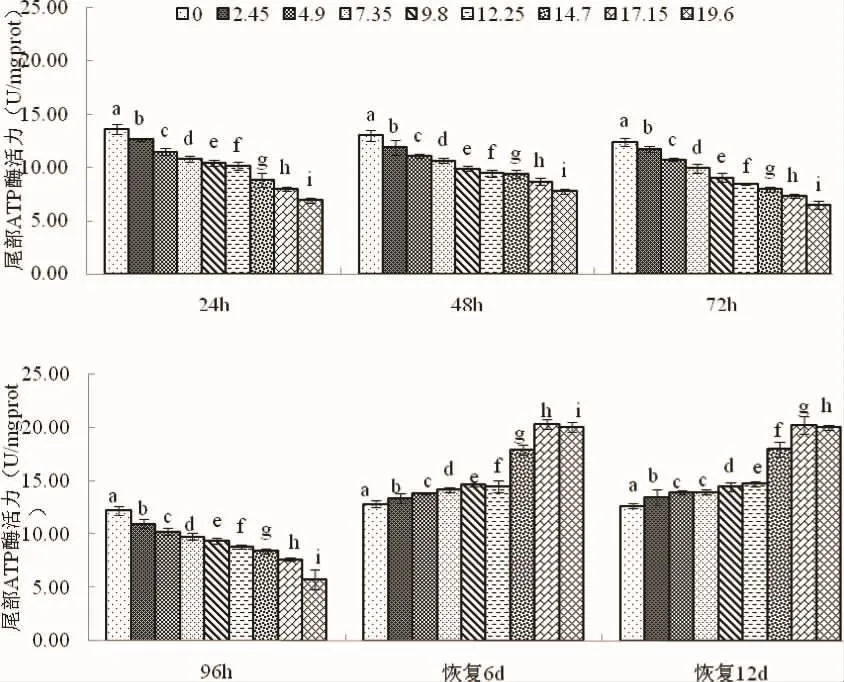
图1 氨氮急性攻毒及去毒后棘胸蛙蝌蚪尾部ATP酶活力的变化特征Fig.1 Characteristics of ATPase activity in the tail of P.spinosa tadpoleafter acute challenge with ammonia and detoxification
2.2 肝脏和尾部皮肤SOD酶活力
由图2可见,实验期间蝌蚪肝脏和尾部皮肤SOD酶活力的变化特征主要表现为:(1)急性攻毒阶段,随氨氮攻毒质量浓度增加,肝脏和尾部皮肤各测定时点酶活力大体上均呈先升后降的趋势,峰值均出现于氨氮质量浓度2.45 mg·L-1实验组 (P<0.05),且其它实验组酶活力则均显著低于对照组P<0.05);(2)去毒恢复阶段,对照组肝脏和尾部皮肤酶活力均显著低于其它实验组(P<0.05),随氨氮攻毒质量浓度增加,肝脏各测定时点酶活力大体上均呈先升后降的趋势,峰值均出现于17.15 mg·L-1实验组(P<0.05),尾部皮肤去毒6d时酶活力大体上呈先升后平趋势,并于17.15 mg·L-1和 19.6 mg·L-1实验组到达峰值(P<0.05),去毒12 d时酶活力大体上均呈先升后降的趋势,于17.15 mg·L-1实验组到达峰值 (P<0.05)。由此可知,肝脏和尾部皮肤SOD酶对氨氮攻毒表露毒性兴奋效应的终点质量浓度均为2.45 mg·L-1,且两者去毒后SOD酶活力获得补偿性提高的原氨氮质量浓度高限均为17.15 mg·L-1,去毒阶段肝脏在SOD酶活力的生理补偿上较尾部皮肤具更强的敏感性。
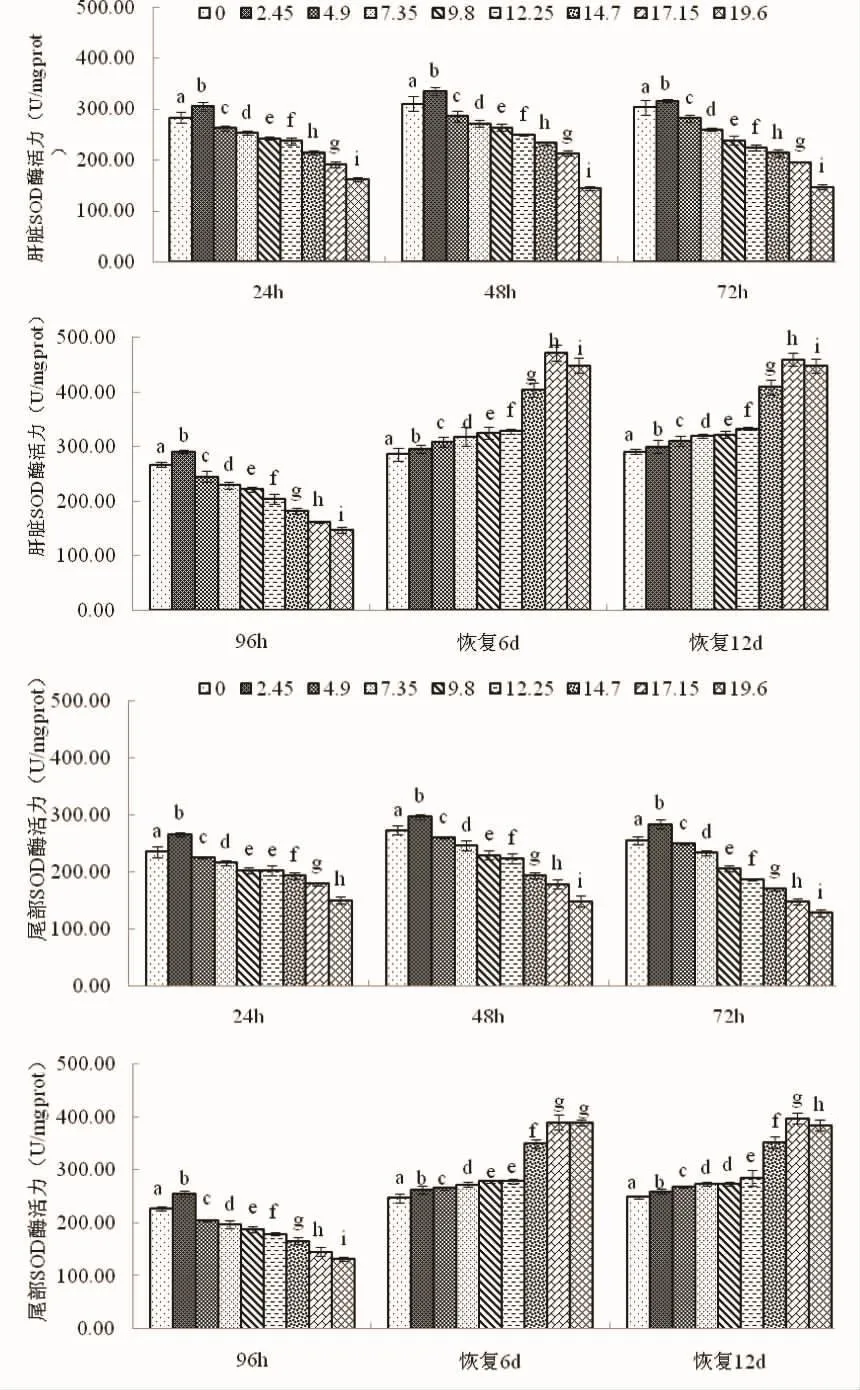
图2 氨氮急性攻毒及去毒后棘胸蛙蝌蚪肝脏和尾部SOD酶活力的变化Fig.2 Changes of SOD activity in the liver and tail of P.spinosa tadpoleafter acute challenge with ammonia nitrogen and detoxification
2.3 肝脏和尾部皮肤CAT酶
由图3可见,实验期间蝌蚪肝脏和尾部皮肤CAT酶活力的变化特征主要表现为:(1)急性攻毒阶段,肝脏和尾部皮肤各测定时点酶活力随氨氮攻毒浓度增加均呈先升后降趋势(P<0.05),峰值均出现于氨氮质量浓度 14.70 mg·L-1实验组 (P<0.05),且17.15 mg·L-1实验组和 19.60 mg·L-1实验组的酶活力均显著低于对照组(P<0.05);(2)去毒恢复阶段,肝脏和尾部皮肤酶活力随氨氮质量浓度的升高亦呈先升后降趋势,峰值均出现于17.15 mg·L-1实验组。由此可知,肝脏和尾部皮肤CAT酶对氨氮攻毒表露毒性兴奋效应的终点质量浓度均为14.70 mg·L-1,且两者去毒后 CAT 酶活力获得补偿性提高的原氨氮质量浓度高限均为 17.15 mg·L-1。

图3 氨氮急性攻毒及去毒后棘胸蛙蝌蚪肝脏和尾部皮肤CAT酶活力的变化Fig.3 Changes of CAT enzyme activity in the liver and tail skin of P.spinosa tadpoleafter acute challenge with ammonia nitrogen and detoxification
2.4 肝脏GSH酶活力
由图4可见,实验期间蝌蚪肝脏GSH酶活力的变化特征主要表现为:(1)急性攻毒阶段,各测定时点酶活力随氨氮攻毒质量浓度的增加呈先升后降趋势(P<0.05),峰值均出现于氨氮质量浓度14.70 mg·L-1实验组,且其它实验组酶活力均显著大于对照组(P<0.05);(2)去毒恢复阶段,酶活力亦随氨氮攻毒质量浓度的增加呈先升后降趋势,且峰值均出现于17.15 mg·L-1实验组(P<0.05)。由此可知,肝脏 GSH 酶对氨氮攻毒表露毒性兴奋效应的终点质量浓度为14.70 mg·L-1,氨氮质量浓度 17.15 mg·L-1为去毒后蝌蚪肝脏GSH酶活力获得补偿性提高的高限。

图4 氨氮急性攻毒及去毒后棘胸蛙蝌蚪肝脏GSH酶活力的变化Fig.4 Changes ofGSH enzyme activity in the liver of P.spinosa tadpole after acute challenge with ammonia nitrogen and detoxification
3 讨论
3.1 关于氨氮急性攻毒下棘胸蛙蝌蚪的抗氧化保护对策
棘胸蛙蝌蚪尾部皮肤ATP酶活力随氨氮急性攻毒质量浓度增加持续下降 (P<0.05)(图 1),与昼均、夜均和日均排氨率均随氨氮攻毒质量浓度增加持续受抑的结果[8],客观反映了氨氮胁迫下棘胸蛙蝌蚪尾部运动与机体排氨速率间的协同关系。抗氧化酶系统作为生物抗氧化应激的第一道防线,在正常生理状况下,可有效清除因污染胁迫产生的自由基,起到保护机体免受氧化损伤的作用[8,10]。其中,SOD 作为最能代表机体抗氧化防御变化特征的指标酶[11],可催化超氧阴离子基团生成H2O2和O2;CAT可还原H2O2以维持细胞和机体的正常生理活动[12],故常作为生物标志物,用以预测和评价水体污染及水生生物中毒程度[13-14];GSH可间接还原过氧化物或直接消除羟自由基,以降低细胞氧化受损水平,保护细胞膜结构和功能的完整性[15-17]。无疑,本研究所涉棘胸蛙蝌蚪尾部皮肤和肝脏抗氧化酶类酶活力随氨氮急性攻毒质量浓度增加均呈先升后降的变动特征,以及两者间同种抗氧化酶走势均基本一致的情形(图2,图3,图4),与昼均、夜均和日均耗氧率随氨氮攻毒质量浓度增加均表露出低毒兴奋效应的结果[8],充分反映了受氨氮胁迫下棘胸蛙蝌蚪尾部皮肤与肝脏在抗氧化酶活力变动上的协同关系,以及机体抗氧化能力与耗氧率间的内在联系。综上,本研究所涉酶活力随氨氮攻毒质量浓度增加引起的变动特征,无疑揭示了氨氮急性攻毒下棘胸蛙蝌蚪以表露低毒兴奋效应为特征,采取通过显著降低机体运动与排泄能耗,以显著增强抗氧化能力的避毒生存策略,从而进一步佐证了氨毒作用下棘胸蛙蝌蚪的呼吸与排泄代谢特征。
3.2 关于氨氮急性攻毒及去毒后棘胸蛙蝌蚪抗氧化酶系统运行机制的探讨
棘胸蛙蝌蚪皮肤密布毛细血管,系机体与外界进行气体交换的主要场所。据报道,蝌蚪约60%的氧依靠皮肤吸收[18]。急性攻毒阶段,蝌蚪尾部皮肤和肝脏SOD酶表露氨毒兴奋效应峰值的氨氮质量浓度为2.45 mg·L-1,而两者 CAT 酶和肝脏 GSH 酶则均为 14.70 mg·L-1的结果(图 2,图 3,图 4),表明 SOD 酶对氨氮急性攻毒较CAT和GSH酶更具敏感性。与此相对性,牛春格等[8]研究发现,受氨氮胁迫下,棘胸蛙蝌蚪夜均、昼均、日均及时段排氨率与对照组均无显著差异的仅为2.45 mg·L-1实验组(P>0.05),夜均、昼均和日均耗氧率对照组均无显著差异的仅为14.70 mg·L-1实验组(P>0.05)。由此可推定,SOD酶为清除体内氨毒自由基的诱导酶,CAT和GSH酶为清除体内氨毒自由基的主导酶,SOD酶所表露的低毒兴奋效应对维系棘胸蛙蝌蚪正常排泄能耗具重要支持作用,CAT和GSH酶活力取得峰值的氨氮质量浓度为棘胸蛙蝌蚪皮肤供氧能力明显受抑(P<0.05)的分水岭。无疑,受氨氮急性攻毒下棘胸蛙蝌蚪CAT和GSH酶活力与耗氧率间的相关性,进一步印证了牛春格等[8]所述14.70 mg·L-1为棘胸蛙蝌蚪耐受氨氮急性胁迫的安全质量浓度上限的可靠性。与此同时,去毒恢复阶段,本研究所涉酶类酶活力随原氨氮急性攻毒质量浓度增加均呈先升后降的变动特征,峰值均出现于原氨氮质量浓度17.15 mg·L-1实验组(P<0.05),且均以对照组为最低(P<0.05)的结果(图 1,图 2,图 3,图 4),指示 17.15 mg·L-1为棘胸蛙蝌蚪耐受氨氮急性胁迫下生理机能尚可恢复的临界。因此,在棘胸蛙蝌蚪培育过程中应加强对养殖水体氨氮质量浓度的监测力度,并通过及时换水以确保棘胸蛙蝌蚪正常生长和变态。
