男性生育异常与染色体多态相关性分析
2019-05-15宋旭梅王贵杰随瑞芝王莉詹福寿
宋旭梅,王贵杰,随瑞芝,王莉,詹福寿
(宁夏医科大学总医院医学实验中心,银川 750001)
染色体多态性是指染色体在形态上发生微小变异,而人群中存在的染色体的这种微小变异多被认为是正常的,主要表现为13号、14号、15号、21号、22号染色体随体增加,1号、9号、16号染色体次缢痕增加,9号间臂倒位,Y染色体异染色质区增加或减少等。研究发现:染色体的多态会影响人类的生殖功能,主要表现为无精子症、少弱精子症等男性不育以及女性的习惯流产、胚胎停止发育等生育异常[1-2]。因此,本研究通过对来我院就诊生育异常的3 102 例男性患者的染色体核型结果进行分析,探讨宁夏地区男性生育异常与染色体多态的相关性,为临床上患者的遗传咨询及优生优育提供可靠的证据。
资料与方法
一、研究对象
选取2016年1月至2018年5月前来我院生殖医学中心就诊的明确诊断为男性生育异常3 102 例患者,年龄分布在18~42岁;临床表型主要为少弱精子症、无精子症或精液正常而男性不育等。纳入标准:(1)明确诊断为男性不育患者;(2)精液检测至少两次,且结果一致。排除标准:女性不孕致不育者。所有患者均签署知情同意书。
二、研究方法
1.细胞培养:无菌条件下选用肝素抗凝管采集外周血2 ml,将0.5 ml接种于外周血淋巴细胞培养基中,上下颠倒混匀后放置于无CO2的37℃培养箱培养。
2.细胞收获及显带:将上述细胞培养3 d后,加入浓度为20 μg/ml的秋水仙素60 μl,转置37℃恒温培养箱,继续培养1 h,然后进行常规的细胞收获、低渗-预固定-固定、56℃滴片、65℃烤片、吉姆萨显带。
3.染色体核型分析:每例患者采用德国ZEISS MetaSystems染色体自动扫描分析系统扫描60个分裂相,人工分析计数20个,至少分析5个核型,必要时行N/C带加以帮助判断。
4.精液分析:采用人工计数方法,参照《WHO人类精液检查与处理实验室手册(第5版)》对患者进行常规精液检测,根据精液结果分为正常组、无精子症及少弱精子症三组,比较三组间染色体多态性检测情况。
三、统计学处理
应用统计学软件SPSS18.0对数据进行统计分析。计数资料用率(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
结 果
一、患者染色体多态性的类型分布特征
在3 102 例男性生育异常患者中检出染色体多态性核型588 例,总检出率为18.95%(588/3 102)。染色体多态性分类及检出占比具体见表 1。
二、染色体多态患者临床表型分布及检出情况
男性生育异常在临床上主要表现为少弱精子症、无精子症及精液正常而不育等。本研究在2 741例明确诊断为男性不育但精液正常的患者中共计检出染色体多态性核型502 例;在259例无精症男性患者中共计检出染色体多态性核型57例;在102例男性少弱精患者中共计检出染色体多态性核型29例。染色体多态性临床表型分布及检出占比具体见表2。

表1 染色体多态性分类及检出占比[n(%)]

表2 染色体多态性临床表型分布及检出占比[n(%)]
三、染色体多态与精液质量关系
无精子症组、少弱精子症组、精液正常组患者染色体多态检出率分别为22.01%、28.43%、18.31%,少弱精子症组显著高于精液正常组、无精子症组(P<0.05),而无精子症组与精液正常组比较,差异无统计学意义(P>0.05)(表3)。
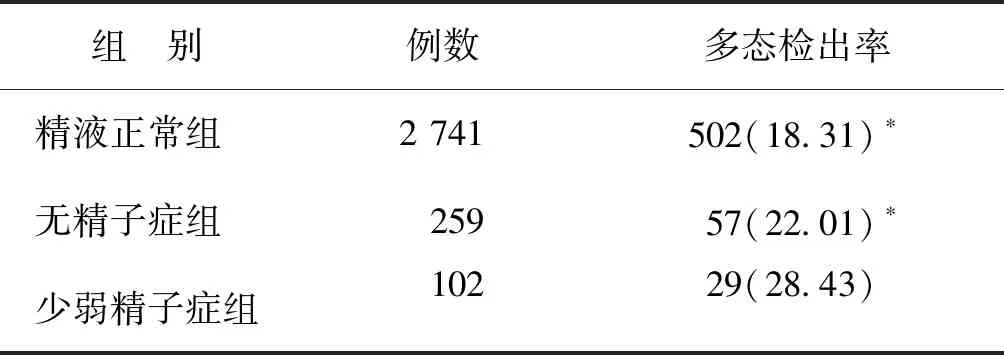
表3 染色体多态与男性精液质量的关系[n(%)]
注:与少弱精子症组比较,*P<0.05
讨 论
近年来,随着经济、环境及人们饮食结构的改变,男性不育的比例呈逐年上升的趋势。而导致男性生育异常的因素很多,其中遗传因素在男性生育异常中占30%~40%[3]。研究表明:男性生育异常主要与精子生成障碍有关,Y染色体微缺失和染色体结构或数目异常对男性生育的影响已得到广泛的认可,但染色体多态性对男性生育异常尤其是少弱精或无精的影响尚存在争议。
染色体结构中异染色质区的微小变异被称为染色体多态,以往观点认为,存在于染色体异染色质区高度重复DNA序列,它不具有转录活性,因而由这些序列组成的染色体多态属正常变异,在人群中没有表型。目前许多研究的观点认为,染色体异染色质区的变异可导致基因在位置上发生改变,甚至干扰减数分裂等过程造成同源染色体在配对上发生困难,产生不平衡配子等,这些改变使精子生成障碍,从而导致男性生育异常[4]。
本研究在3 102例明确诊断为男性生育异常患者中,染色体多态变异共检出了588例,检出率为18.95%(588/3 102),这与国内相关文献报道染色体变异参数(2.2%~33.3%)[5]一致。588例染色体多态男性生育异常患者中,Y染色体长臂异染色质区变异(Yqh+/qh-)最多,共270例,检出率占多态性的45.92%(270/588)。研究表明:Y染色体长臂异染色质区上分布着与男性睾丸发育、精子形成及性别决定等有关的基因,Y染色体异染色质中DNA的高度重复和Y染色体部分遗传物质的丢失可能会导致生精障碍及男性不育[6-8]。本文检出大Y 60例,占多态性核型的10.20%(60/588),检出小Y 210例,占多态性核型的35.71%(210/588)。这与尚秋杰等[9]的相关文报道内容相一致,可见Y染色体长臂异染色质区变异与男性精子生成障碍之间有一定的关联性,不能把该区域变异认为正常变异。
本研究中D/G组(包括13、14、15、21、22号染色体)共222例,检出率占多态性的 37.76%,其中13染色体随体区变异共43例,占7.31%(43/588),14染色体随体区变异共46例,占7.82%(46/588),15染色体随体区变异共34例,占5.78%(34/588),21染色体随体区变异共66例,占11.22%(66/588),22染色体随体区变异共33例,占5.61%(33/588);D组与G组的多态性比例为1.24:1,这与陈竞茜等[10]报道的D、G组变异比例一致。引起染色体D/G组(13、14、15、21、22号)随体区的变异的主要原因是核糖体RNA(rRNA)的增多,核糖体RNA的增多会使染色体在随体区,发生染色体不分离以及联合、重排等变化。这些改变可能会引起精子生成基因缺失或断裂,从而使精子生成减少或无精。本研究中222 例D、G组染色体随体变异,临床上表现为无精子症患者259例检出多态22例,检出率为8.49%(22/259),少弱精子症患者83例检出多态10例,检出率为12.05%(10/83)。可见,D/G组染色体随体区多态性变异与男性少精或无精等生育异常密切相关。
王桂玲等[11]研究表明,精子在质量方面的问题与染色体次缢痕增加之间有一定的关联性。本研究发现1/9/16染色体次缢痕增加共67例,占总多态性的11.39%。染色体异染色质区重复DNA序列的增加是引起染色体次缢痕变异的主要原因,该区域的这种变化可能会对减数分裂的某个过程造成一定的影响,如同源染色体的配对困难,产生非平衡配子等[12],从而导致不育。因此,男性染色体次缢痕增加可能导致男性少精或无精。9号染色体的臂间倒位不会导致遗传物质的增加或缺失,但如果染色体倒位的位置处恰好有精子生成基因的分布,那么这种基因的位置改变极有可能会影响精子的生成。本研究共计检出9号染色体臂间倒位(inv9)29例,检出率占多态性的4.93%,这与郭东花等[13]研究结果一致。已有研究报道,9号染色体次缢痕的DNA序列毗邻松弛素(RLX)基因,若9号染色体内部在位置上发生倒置,会下调毗邻的RLX基因的表达,使RLX发挥的作用减弱,影响了男性精子与女性卵子结合的能力,从而使生殖发生障碍[14-15]。因此,9号染色体臂间倒位可能会引起男性生精障碍,进而引起不育。
此外,本研究根据男性生育异常的临床表型,对明确诊断为少弱精子症和无精子症及精液正常的男性生育异常患者,进行染色体核型分析统计。结果显示:无精子症组、少弱精症组染色体多态的检出率分别为22.01%和28.43%,高于精液正常组(18.31%),与路兴军等[16]研究结果相悖,考虑可能与地区、样本选择和样本量有关。本研究无精子症组、少弱精症组染色体多态的发生率显著高于张佳仕等[17]报道的多态发生率,可能与纳入标准有关。本研究并未对女性生殖异常进行研究。因此在不同地区对生育异常男性患者进行染色体核型检查具有重要的临床意义。
综上所述,染色体多态性与男性生育异常密切相关,临床上对于男性生育异常,尤其是少弱精子症和无精子症患者要例行染色体检查,重视染色体多态性的临床效应,对生育异常的男性患者病因诊断及治疗具有重要临床意义。
