缺血再灌注对小鼠蜕膜化子宫内膜的作用
2019-05-15陈西华曹惠子关硕陆超贺斌徐祥波
陈西华,曹惠子,关硕,陆超,贺斌,徐祥波*
(1.国家卫生健康委科学技术研究所,北京 100081;2.北京大学第三医院生殖医学中心,北京 110191)
月经是女性重要的生理现象。未妊娠的情况下,子宫内膜在雌/孕激素的作用下周期性的发生剥脱,并以出血的方式排出体外。月经异常是妇科疾病常见的症状,包括月经不调、闭经、月经过多、痛经、产后腹痛、恶露不尽等。正常的月经周期对女性的生殖健康与生活质量具有重要意义。
早在1940年,Markee[1]就利用恒河猴对月经现象进行研究,将人子宫内膜外植体移植到恒河猴的眼前房中,观察到月经发生前,蜕膜化子宫内膜中螺旋动脉有节律的舒张和收缩;螺旋动脉剧烈痉挛大约24 h后,子宫内膜组织崩解并伴随出血现象。由此推测,月经是由于子宫内膜螺旋动脉收缩、内膜发生缺血再灌注,此过程造成组织呈缺血缺氧,直接导致子宫内膜细胞坏死与崩解出血。以上是月经发生的经典理论假说。但是,关于缺氧再灌注是否存在、低氧是否直接导致子宫内膜崩解等关键问题,近年不同研究组得出了相互矛盾的结论。1997年,Gannon等[2]利用多普勒超声技术对人类子宫内膜在月经过程中的微血管红细胞流速的变化进行研究,结果未检测到月经前子宫内膜的缺血再灌注过程。2002年Zhang等[3]发现,作为低氧的重要反应因子HIF1A与HIF2A仅在少部分人围月经期子宫内膜标本的基质细胞中存在,且发现在低氧培养条件下,与子宫内膜崩解紧密相关的金属基质蛋白酶proMMP-1、proMMP-3和MT1-MMP的表达以及MMP-2的活性受到抑制。而在我们的前期研究中,利用低氧探针确认了小鼠月经样模型中孕酮撤退后子宫内膜存在低氧[4]。
本研究以小鼠月经样模型为基础,利用血管夹持手术的方法,研究缺血再灌注与月经发生的关系。
材料和方法
一、研究对象
1.实验动物:SPFII级雄性与雌性13周龄NIH小鼠(国家卫生健康委科学技术研究所实验动物中心提供)。小鼠在可控的条件下给予充足的水和食物饲养,光照6:00~18:00,温度(21±1℃)。所有的实验步骤均获得国家卫生健康委科学技术研究所动物伦理委员会审查批准。
2.药品与试剂:花生油(鲁花牌5S一级压榨)、多聚甲醛(国药集团)、组织包埋用石蜡(Leica,德国)、苏木素-伊红(HE)染色试剂(北京中杉金桥)。
二、研究方法
1.小鼠模型的建立:将雌鼠与输精管结扎雄鼠进行交配,次日中午12:00见栓记为0.5 d;3.5 d,在小鼠子宫腔内注射15 μl花生油,以诱导子宫内膜发生蜕膜化;5.5 d蜕膜化诱导完成[5-6](图1)。
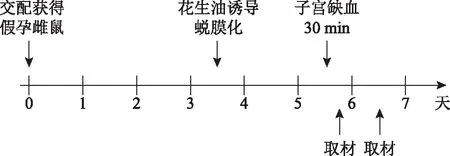
图1 小鼠模型的建立方法与实验流程示意图
2.分组处理:模型小鼠随机分为3组:对照组(n=8)、假手术组(n=8)与缺血再灌注组(n=10)。对照组的小鼠不作任何处理;假手术组的小鼠进行开腹手术但不进行子宫缺血再灌注手术;缺血再灌注组子宫实行缺血再灌注手术。
小鼠蜕膜化子宫缺血再灌注手术方法:小鼠腹腔开口,将右侧子宫角上下两端的主血管用止血夹夹住。血管夹持前蜕膜化的子宫呈粉红色,血管夹持后1 min内变为暗红色(图2)。确定血管夹好后开始计时,30 min后小心取下止血夹。止血夹取下后,子宫在1 min之内由暗红色恢复为最初的粉红色。随后,将器官复位并仔细缝合。左侧子宫角不做子宫缺血再灌注手术。手术完成时间记为处理后0 h。在处理后6 h与24 h小鼠处死取材。期间观察小鼠阴道出血情况并记录。
3.小鼠子宫大体形态与组织形态学观察:小鼠子宫取材后,对子宫大体进行拍照。随后子宫立即用4%多聚甲醛固定约24 h。固定好的小鼠子宫制成常规石蜡切片,进行常规HE染色并观察组织形态学变化。
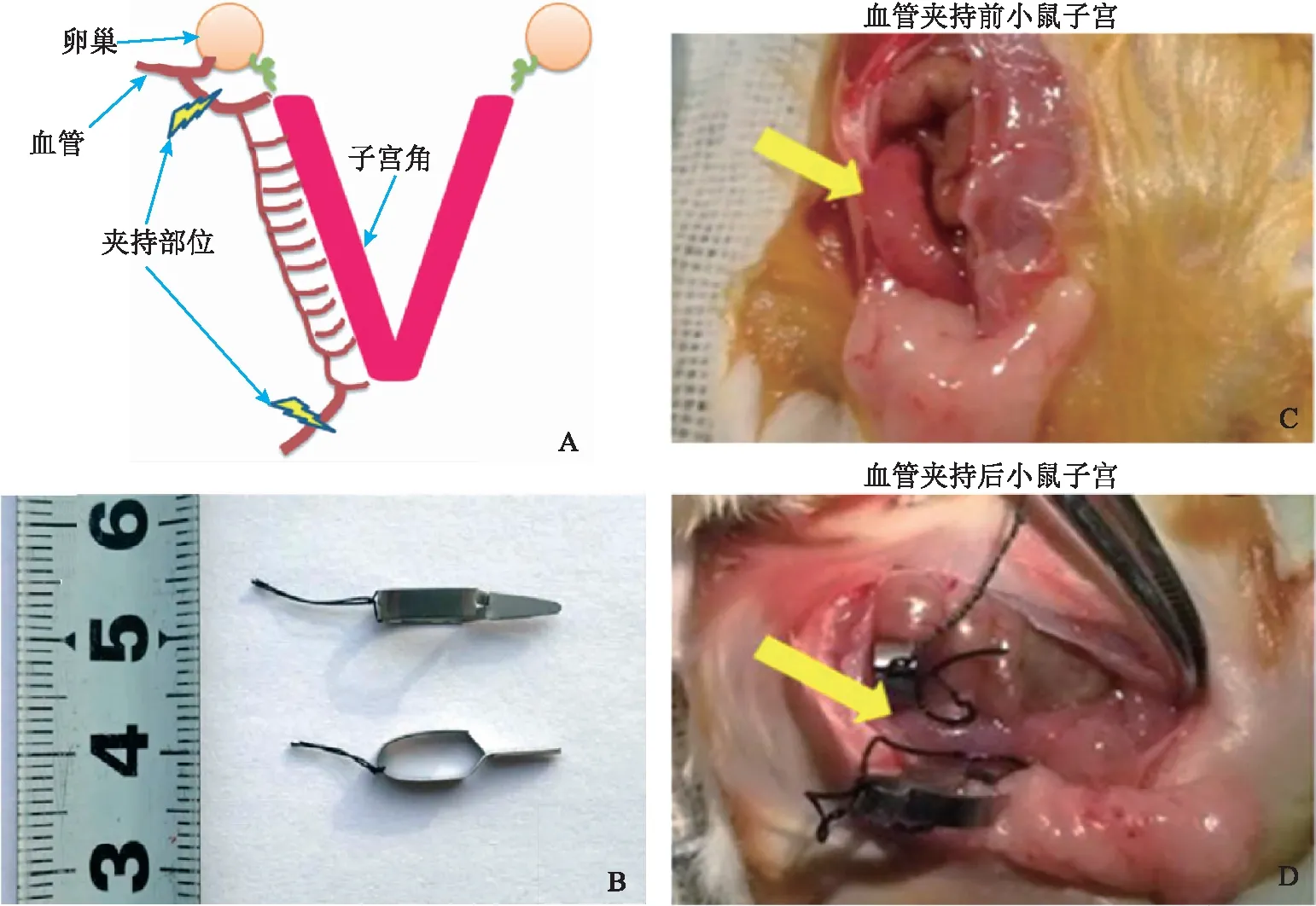
A:缺血再灌注手术示意图:用止血夹夹持子宫上、下两端的主血管;B:小鼠用止血夹;C、D:血管夹持前、后小鼠子宫。黄色箭头指示子宫图2 小鼠蜕膜化子宫缺血再灌注手术操作
结 果
一、阴道出血观察
缺血再灌注组手术完成时间记为处理后0 h,并适用于其他处理组。处理后0~24 h,对照组模型小鼠未观察到阴道出血现象,假手术组绝大多数模型小鼠也未见出血;缺血再灌注组,少数小鼠(2/10)在处理后8 h时观察到阴道出血现象,处理后12 h约一半的小鼠(6/10)出现阴道出血现象,处理后24 h大多数小鼠(8/10)观察到了阴道出血现象(表1)。

表1 各分组中阴道出血的小鼠数量与处理后24 h子宫内膜崩解的小鼠数量统计 [n(%)]
二、小鼠子宫内膜崩解数量统计
对各分组小鼠在处理后24 h子宫内膜崩解的数量进行统计。对照组小鼠均未发生崩解出血;假手术组仅1例小鼠的子宫发生崩解出血;缺血再灌注组,绝大多数小鼠子宫内膜发生了完全崩解。该组中发生崩解的小鼠,其子宫角夹持侧与未夹持侧均发生了相同程度的崩解(表1)。
三、大体形态与组织形态学观察
处理后24 h小鼠全部处死取材。此时,所有对照组与绝大部分假手术组的小鼠子宫呈淡红色,缺血再灌注组绝大部分小鼠子宫呈暗红色(图3)。
将取材子宫制作常规石蜡切片并HE染色,进行组织形态学观察。对照组与假手术组小鼠的子宫内膜完好,蜕膜化的子宫内膜基质细胞体积增大,细胞核增大,子宫腔上皮完好,未观察到组织内大量红细胞渗出现象。缺血再灌注组小鼠的蜕膜化细胞边界消失,细胞核固缩,子宫腔上皮消失,组织裸露与空腔内,观察到大量红细胞渗出现象,此为子宫内膜崩解出血现象(图3)。
进一步观察分析小鼠模型缺血再灌注组,血管夹持侧与未夹持侧子宫形态的变化。在处理后6 h,血管未夹持侧的子宫内膜完好,未观察到明显的血管扩张或蜕膜化子宫内膜基质细胞崩解现象。而相比之下,血管夹持侧的子宫内膜在子宫系膜对侧靠近子宫腔上皮下方区域,出现明显的血管扩张现象,大量红细胞渗出进入基质细胞。而该区域的子宫内膜基质细胞出现了早期的崩解坏死现象。到了处理后24 h,无论夹持侧或未夹持侧,绝大部分小鼠的子宫内膜均观察到完全崩解的现象,崩解程度没有显著差异。而假手术组在处理后6 h与24 h均未观察到明显的红细胞渗出现象(图4)。

A、B:对照组;C、D:假手术组;E、F:缺血再灌注组图3 小鼠月经样模型处理后24 h大体形态与组织形态学观察(HE染色 ×200)
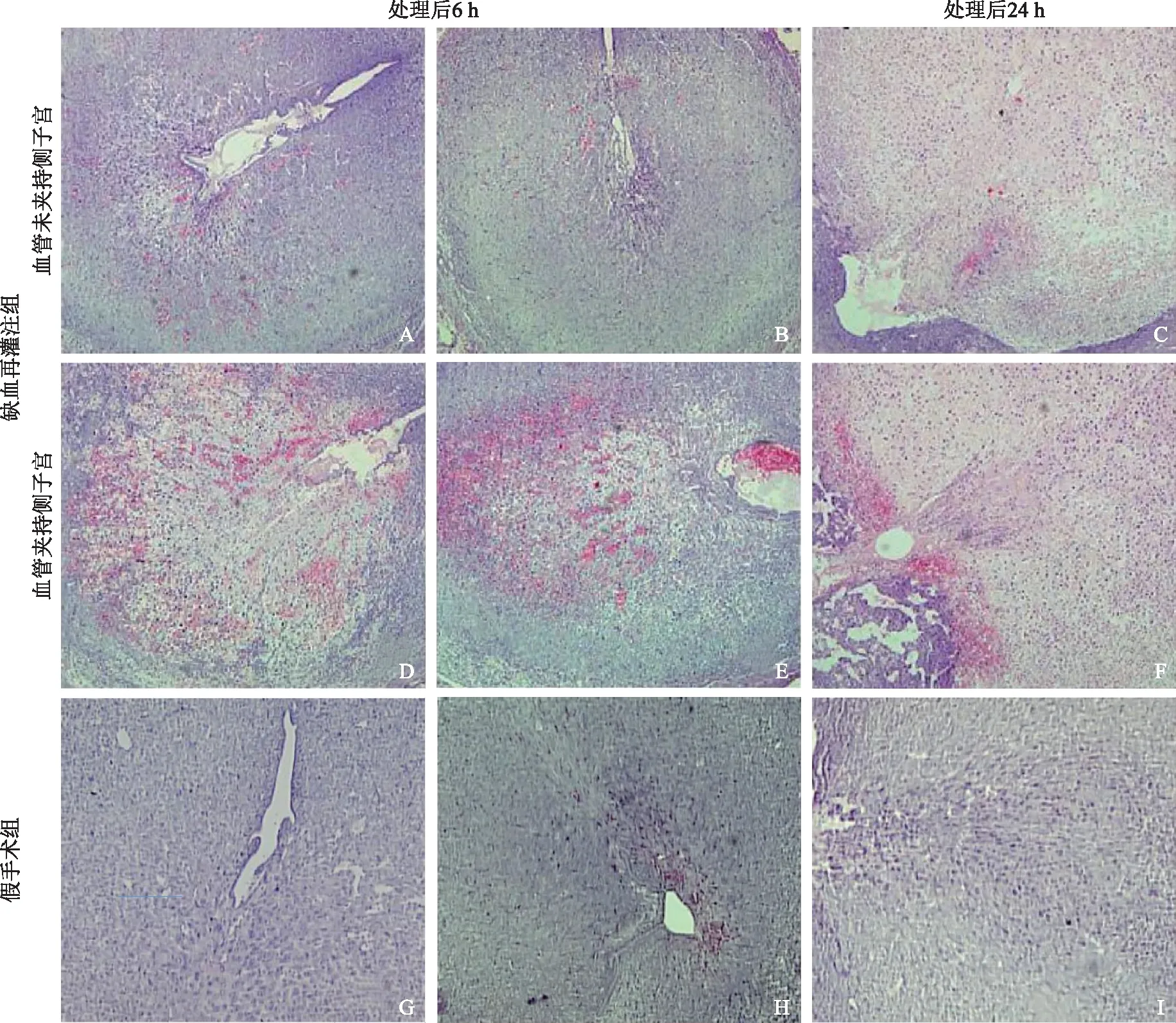
A~F:缺血再灌注组,其中A~C示血管未夹持侧,D~F示血管夹持侧,A、B、D、E示缺血再灌注后6 h,C、F示缺血再灌注后24 h;G~I:假手术组,其中G、H示假手术后6 h,I示假手术后24 h图4 小鼠模型缺血再灌注组与假手术组在处理后6 h与24 h子宫组织形态学观察(HE染色 ×200)
讨 论
月经发生的经典理论假说认为,子宫内膜螺旋动脉缺血缺氧,引发了子宫内膜的崩解[1]。但是近几年,缺氧在月经发生中的作用存在不少争议,不同研究组在体内、体外或在体模型的研究结果得出相反的结论[2-4,7-9]。
本研究采用了小鼠月经样模型对缺血再灌注在月经发生中的作用进行研究。在最早的小鼠月经样模型中,已明确月经发生需要三个不可或缺的基本要素:(1)必要的激素准备;(2)子宫内膜发生蜕膜化;(3)蜕膜化后的孕酮撤退[10-11]。本研究将蜕膜化的小鼠子宫,利用手术方法引发小鼠单侧子宫角缺血再灌注,进而观察子宫内膜发生的变化。结果显示,在缺血再灌注后6 h,子宫腔上皮下方区域的组织形态已发生显著变化,血管扩张、红细胞渗出,该区域的子宫内膜已开始发生崩解出血现象;在小鼠子宫缺血再灌注24 h后,子宫内膜发生了完全的崩解出血现象。而对照组中,没有小鼠发生子宫内膜的崩解出血,假手术组仅1只小鼠发生崩解出血现象。可以确定,缺血再灌注在没有孕酮撤退的情况下,即可引发子宫内膜崩解。另一方面,缺血再灌注手术仅在模型小鼠的一侧子宫角实施,但在处理后24 h发生崩解出血的小鼠的双侧子宫角均发生了完全的崩解,表明缺血再灌注虽然是子宫内膜崩解出血的始动因素,但并不是导致最终崩解的直接原因。仅开腹假手术也能够在一定程度上引发子宫内膜崩解。由此推测,缺血再灌注可能启动了某种信号,使子宫内膜在不依赖孕酮撤退的条件下诱发了子宫内膜崩解。
缺血再灌注手术和假手术,对于小鼠子宫及小鼠机体均会造成强烈的刺激,强烈的刺激下会导致机体发生应激反应。较早前研究中已知,应激反应能够干扰子宫正常的生殖生理现象,例如闭经、不孕、子宫内膜容受性异常等,甚至引发早产或流产[12]。以往的研究结果提示,应激反应可能是造成月经失调的主要因素[13-15]。此外,某些环境因素与下丘脑闭经现象存在一定联系[16]。较早前,对393名女性学生的研究中发现应激能够引发经前综合征、月经过少、闭经与月经过多[17]。因此,缺血再灌注引发的应激反应可能在子宫内膜崩解的信号通路中起重要作用。
综上所述,本研究结果明确了缺血再灌注能够导致子宫内膜崩解,而缺血再灌注引发的应激反应可能在月经发生中扮演了重要的角色。但其中的分子机制仍需要更多深入研究进一步阐明。
