香芹酚对耐甲氧西林金黄色葡萄球菌(USA300)抑菌机制的研究
2019-05-15甘盈盈袁中伟张天翼谷可欣申瀚君周能华尹立子
甘盈盈,袁中伟,张天翼,谷可欣,李 超,申瀚君,周能华,尹立子
(四川农业大学动物医学院,成都 611130)
金黄色葡萄球菌(Staphylococcus aureus)是一种极其常见的致病菌,数量大,分布广,水、空气、尘土中都可找到它的踪影。金黄色葡萄球菌可以引起局部化脓性感染、全身炎症反应综合征和败血症等多种疾病,临床体征较为严重[1]。耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)由金黄色葡萄球菌演变而来,毒力和致病力显著增强,并且具有多重耐药的特点,临床治疗的难度更大[2]。USA300 是一种具有高度致病性和全球流行性的社区获得性耐甲氧西林金黄色葡萄球菌,它对红霉素、左氧氟沙星、莫匹罗星和四环素等抗菌药物的耐药性增强。它主要引起皮肤和软组织感染,还会造成严重的危及生命的疾病,如坏死性肺炎、骨髓炎、和脓毒性关节炎[3-4]。长期以来,万古霉素是抗MRSA 最有效的药物,由于万古霉素的使用量渐增,导致MRSA 对其抵御能力增强,陆续出现多种耐药菌株[5]。因此,为避免临床上抗MRSA 陷入一种无药可施的境地,开发新的抗MRSA 药物迫在眉睫。
香芹酚,又称香荆芥酚,是一种单萜酚类化合物。香芹酚广泛分布于芳香植物中,是麝香草、牛至草、亚加菊等芳香植物挥发油的主要化学成分[6-9]。香芹酚既具有分子小、极性低和毒性低等特点[10],又具有抗菌、抗氧化和抗癌等生物活性[11-12],因而具有很大的开发价值。香芹酚的抗菌活性较好,对金黄色葡萄球菌、绿脓杆菌等均有较好的抑制效果[11],然而目前关于香芹酚对金黄色葡萄球菌的抑菌机理尚不完全明确。因此本文以MRSA 的标准菌株USA300 为试验菌株,考察香芹酚对MRSA 的抑菌机制,为香芹酚开发为新型天然抑菌药提供理论依据。
1 材料和方法
1.1 试验材料
MRSA 标准菌株:USA300(ATCC BAA-1717),购自美国标准菌种库;香芹酚(纯度>98%,上海麦克林生物科技有限公司)用DMSO(分析纯,索莱宝生物科技有限公司)配制成母液备用;pH 7.0 的磷酸缓冲盐粉剂,购自索莱宝生物科技有限公司,按使用说明配制成2 L 的PBS 磷酸缓冲溶液备用;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒,购自南京建成生物工程研究所;BCA 蛋白浓度测定试剂盒,购自上海碧云天生物技术有限公司;LB 肉汤和LB 营养琼脂,购自北京奥博星生物技术有限责任公司;TSB 液体培养基和BHI 液体培养基,购自青岛海博生物科技有限公司。
1.2 香芹酚对USA300 抑菌活性和生长曲线的测定
通过肉汤稀释法和菌落计数法测定香芹酚在37 ℃下作用于USA300 24 h 的最低抑菌浓度(minimum inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration,MBC)[13-14]。试验设立负对照组。试验重复3 次,当试验结果完全一致或者相差一个质量/体积浓度梯度时才被接受[15]。
将USA300 菌悬液置于37 ℃,150 r/min 的摇床中培养至OD600nm=0.3,混匀,均分于6 个50 mL的锥形瓶中,分别加入香芹酚,使其香芹酚的质量/体积浓度依次为0、32、64、128、256 和512 μg/mL;将其置于37 ℃、150 r/min 的摇床中培养,分别于0、1、2、4、6、8、16 和24 h 测定肉汤的OD600nm,采用Prism 7.0 绘制生长曲线。
1.3 香芹酚对USA300 细胞膜的影响
参考F.Bendali、张冠楠[16-17]等的试验方法,将生长繁殖至对数期(OD600nm=1.8)的USA300 菌悬液4 500 r/min、4 ℃离心10 min,弃去上清液,收集下层的细菌沉淀,用5%葡萄糖溶液悬浮分散成107cfu/mL的菌悬液,混匀,均分于2 个250 mL 的锥形瓶中;加入香芹酚,使其质量/体积浓度分别为0 和512 μg/mL,混匀,置于4 ℃恒温培养箱中静置培养。于0、1、2、4、6 和8 h 取出菌悬液,4 500 r/min、4 ℃离心10 min,测定上清液的电导率。试验设立负对照组。试验重复3 次,计算平均值。
1.4 香芹酚对USA300 DNA 外渗量的影响
取培养至对数生长期(OD600nm=1.8)的USA300菌悬液,4 500 r/min 离心10 min,弃去上清液,收集下层的细菌沉淀,用PBS 磷酸缓冲溶液重新完全分散成107cfu/mL 的菌悬液,混匀,均分于2 个250 mL的锥形瓶中;加入香芹酚,使其质量/体积浓度分别为0 和512 μg/mL,混匀,置于37 ℃的恒温培养箱中静置培养。于0、1、2、4、6 和8 h 取出菌悬液,4 500 r/min 离心10 min,收集上清液,用微量分光光度计NanoDrop One(Thermo,America)测定上清液中DNA 含量[18]。试验设立负对照组。试验重复3次,计算平均值。
1.5 香芹酚对USA300 可溶性蛋白质含量的影响
制备生长繁殖至对数期(OD600nm=1.8)的USA 300 菌悬液,混匀,均分于2 个200 mL 的锥形瓶中,加入香芹酚,使其香芹酚的质量/体积浓度分别为0 和512 μg/mL,混匀,置于37 ℃,150 r/min 的摇床中培养。于2、6、10 和16 h 取出菌悬液,用新鲜的LB 肉汤稀释至OD600nm=0.6,并定容至50 mL,4 500 r/min 离心10 min,弃去上清液,收集下层的细菌沉淀。用1 mL 的PBS 磷酸缓冲液将细菌沉淀重新完全分散,进行超声破碎,混匀,得到超声破碎液;向超声破碎液中加入5×上样缓冲溶液(超声破碎液体积:5×上样缓冲溶液体积=4∶1),混匀,在沸水浴中煮沸5 min,4 500 r/min 离心10 min,取上清液进行SDS-PAGE 试验[19];按照BCA 蛋白浓度测定试剂盒的试验方法检测超声破碎液中可溶性蛋白质的含量。试验设立负对照组。试验重复3 次,计算平均值。
1.6 香芹酚对USA300 乳酸脱氢酶含量的影响
制备生长繁殖至对数期(OD600nm=1.8)的USA300菌悬液,混匀,均分于2 个200 mL 的锥形瓶中,加入香芹酚,使其香芹酚的质量/体积浓度分别为0和512 μg/mL,置于37 ℃,150 r/min 的摇床中培养。于0、2、4、6 和8 h 取出菌悬液,用新鲜的LB肉汤稀释至OD600nm=0.6,并定容至50 mL,4 500 r/min离心10 min,弃去上清液,收集下层的细菌沉淀,用1 mL 的PBS 磷酸缓冲液重新完全分散,超声破碎后4 500 r/min 离心10 min,用LDH 试剂盒测定上清液中LDH 的含量[20]。试验设立负对照组。试验重复3 次,计算平均值。
1.7 电镜观察香芹酚对USA300 形态结构的影响
制备生长繁殖至对数期(OD600nm=1.8)的USA300菌悬液,混匀,均分至2 个100 mL 的锥形瓶中,加入香芹酚,使其香芹酚质量/体积浓度为0 和512 μg/mL,置于37 ℃,150 r/min 的摇床中培养。于1、10 和16 h 时取出菌悬液,4 500 r/min 离心10 min,收集下层细菌沉淀,用PBS 磷酸缓冲液清洗3 次,弃去上清液,得到菌体沉淀[21],并制成扫描电镜、透射电镜样品[22-24],于S-3400N 扫描电子显微镜(日立,日本)和H-600IV 型透射电镜(日立,日本)下观察细菌表观形态与结构的变化。试验设立负对照组。试验重复3 次。
1.8 亚抑菌浓度下的香芹酚对USA300 生物被膜形成能力的影响
制备香芹酚质量/体积浓度依次为0、16、32、64和128 μg/mL 的BHI 液体培养基(各50 mL),各接种0.5 mL USA300 菌悬液,置于37 ℃,150 r/min 的摇床中培养至OD600nm=0.6。向96 孔板中加入上述菌悬液10 μL,再对应加入含相同质量/体积浓度香芹酚的3%蔗糖BHI 液体培养基290 μL,混匀(混合液中香芹酚保持最初的质量/体积浓度),置于厌氧条件、37 ℃的培养箱中静置培养18 h。清除96 孔板中所有液体后,每孔加入100 μL10%的甲醛溶液,常温静置培养18 h;移除所有液体,加入100 μL 质量浓度为1 mg/g 的结晶紫溶液,常温静置30 min;清除所有液体,用双蒸水冲洗,晾干,加入200 μL 33%的乙酸溶液,混匀,用酶标仪(Thermo,America)测量OD490nm,以此反映USA300 菌株生物被膜的形成能力[25]。试验设立负对照组。试验重复3 次,计算平均值。
1.9 统计学分析
采用Prism 7.0 对试验数据进行差异显著性分析(t 检验),结果用“平均值±标准误”表示,P<0.05为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1 抑菌活性及生长曲线的测定
香芹酚具有良好抑菌活性,MIC 是128~256 μg/mL,MBC 是512 μg/mL。香芹酚对USA300 生长曲线的影响结果如图1所示,香芹酚浓度为128、256 和512 μg/mL 时,对USA300 的生长有着明显抑制作用;香芹酚浓度为32 和64 μg/mL 时,对USA300 的生长没有显著的影响。

图1 香芹酚对USA300 生长的影响Figure 1 The effect of carvacrol on the growth of USA300
2.2 香芹酚对USA300 细胞膜通透性的影响。
当细胞膜被药物破坏时,其渗透性增加,无机盐外漏,导致菌悬液的电导率增加[26],因此本试验通过考察香芹酚作用于USA300 菌悬液后电导率的变化,研究香芹酚对细胞膜通透性的影响。由图2可知,香芹酚作用显著、迅速;与0 h 相比,香芹酚作用1 h 后,菌悬液电导率增长5.57%±0.40%(P<0.01);香芹酚作用8 h 后,菌悬液电导率增长4.22%±0.71%(P<0.01)。对照组的电导率在0~8 h 里无显著变化。相同培养时间下,给药组与对照组组间差异极显著。

图2 512 μg/mL 的香芹酚对USA300 菌悬液电导率的影响Figure 2 The effect of carvacrol at 512 μg/mL on the conductivity of USA300 bacterial suspension
2.3 香芹酚对USA300 DNA 外渗量的影响
本试验测定了香芹酚作用于USA300 后DNA的外渗量,以此验证香芹酚对USA300 细胞膜渗透性的影响。如图3,与0 h 相比,加入香芹酚1 h 后,USA300 的DNA 外渗量增加(16.27±1.86)μg/mL(P<0.01);加入香芹酚8 h 后,USA300 DNA 外渗量增加(21.80±2.00)μg/mL(P<0.01)。相同培养时间下,给药组与对照组组间差异极显著。该试验结果表明香芹酚可以显著影响USA300 的DNA 外渗量。
2.4 香芹酚对USA300 可溶性蛋白含量的影响
BCA 蛋白浓度测定试剂盒测定结果显示,与相同培养时间的对照组相比,香芹酚作用于USA300菌体10 h 和16 h 后,可溶性蛋白含量分别增加61.13%±7.63%(P<0.01)和85.76%±1.84%(P<0.01)。SDS-PAGE 结果和BCA 蛋白浓度测定试剂盒测定结果共同表明了香芹酚可以刺激USA300 可溶性蛋白含量增加。如图4,SDS-PAGE 蛋白谱带结果显示,香芹酚可以影响USA300 可溶性蛋白含量。
2.5 香芹酚对USA300 乳酸脱氢酶的影响
LDH 乳酸脱氢酶试剂盒测定结果如图5所示,香芹酚作用于USA300 1、2、4、6 和8 h 后,与相同培养时间的对照组相比,乳酸脱氢酶的含量分别增加了40.49%±2.77%(P<0.01)、20.13%±2.28%(P<0.01)、19.10%±2.82%(P<0.01)、13.59%±1.35%(P<0.01)和11.65%±2.85%(P<0.05)。此试验结果表明香芹酚可以刺激USA300 的LDH 含量增加。

图3 512 μg/mL 香芹酚对USA300DNA 外渗量的影响Figure 3 The effect of carvacrol at 512 μg/mL on DNA exosmosis amount of USA300
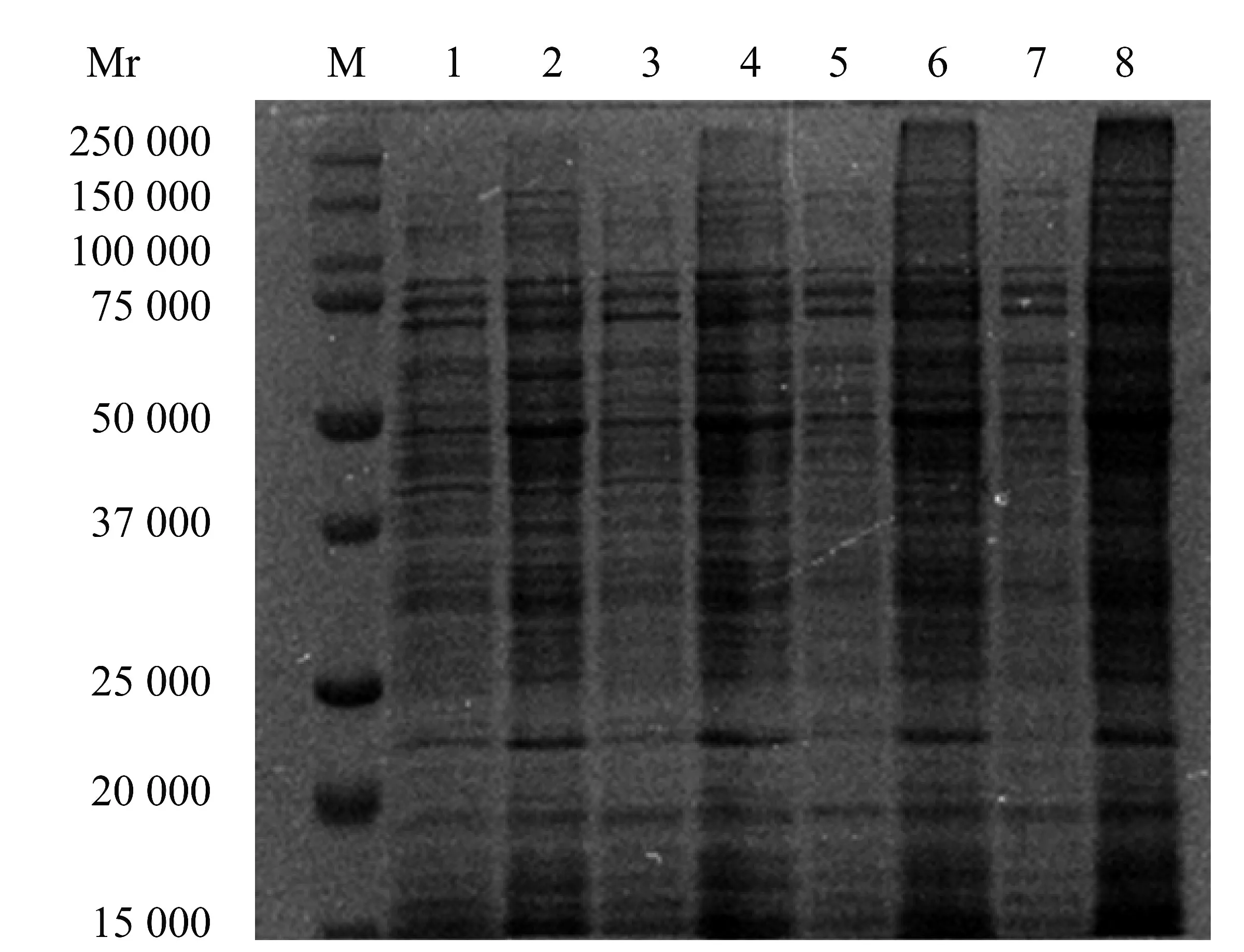
图4 512 μg/mL 香芹酚对USA300 可溶性蛋白质含量的影响Figure 4 The effect of 512 μg/mL carvacrol on the soluble protein content of USA300

图5 512 μg/mL 香芹酚对USA300 的LDH 含量的影响Figure 5 The effect of carvacrol at 512 μg/mL on LDH content of USA300
2.6 香芹酚对USA300 形态结构的影响
扫描电镜图像显示,对照组(图6A1)的USA300表面光滑,具有正常的表观形态;512 μg/mL 香芹酚作用于USA300 1 h 后,菌体表面褶皱,菌体萎缩变形(图6A2)。透射电镜图像显示,对照组10 h(图6B1)和对照组16 h(图6C1)菌体表观正常、结构清晰并具有完整的细胞壁;512 μg/mL 香芹酚作用于USA300 10 h(图6B2)后,蛋白质异常沉淀,内容物固缩,出现空泡化的现象;作用16 h 后(图6C2),菌体细胞壁结构被破坏,质壁分离,出现细胞壁溶解、脱落的现象。
2.7 香芹酚对USA300 生物被膜形成能力的影响
低于MIC 的药物浓度称为亚抑菌浓度。由图7可知,加入亚抑菌浓度的香芹酚后,USA300 生物膜的形成比对照组显著减少。香芹酚质量/体积浓度为16、32、64 和128 μg/mL 时,形成的生物被膜比对照组分别减少27.55%±2.33%(P <0.01)、35.28%±3.67%(P<0.01)、68.86%±0.53%(P<0.01)和77.47%±1.74%(P<0.01)。该试验结果表明,香芹酚能抑制USA300 生物被膜的形成。
3 讨论与结论
随着抗菌药物的大量使用,细菌耐药性呈上升趋势,MRSA 现已成为临床上十分常见的致病菌[27-28]。MIC、MBC 和生长曲线试验结果显示香芹酚对USA300 具有较好的抑菌作用,表明香芹酚具有开发为抗MRSA 的天然抑菌药的潜在价值。

图6 512 μg/mL 香芹酚不同作用时间对USA300 菌体细胞形态结构的影响Figure 6 Effect of different treating time of carvacrol at 512 μg/mL on the morphology and structure of USA300 cells

图7 不同质量/体积浓度的香芹酚对USA300 的生物被膜形成能力的的影响Figure 7 The effect of carvacrol with different mass concentrations on biofilm formation ability of USA300
细胞膜是保护细菌的天然屏障。许多抗菌药物可以通过改变或损伤细胞膜的结构使细菌生长受到抑制乃至死亡,从而达到抑菌、杀菌的目的[29-30]。本研究中电导率试验表明,香芹酚作用迅速、明显,与对照组相比,加入香芹酚1 h 后,菌悬液电导率显著上升,说明香芹酚可以迅速影响USA300 菌株的细胞膜通透性。DNA 是一种高分子聚合物,细菌正常生长情况下,DNA 几乎不会通过细胞膜外渗而出。DNA 外渗量测定结果表明,香芹酚作用于USA300 菌株1 h 内,DNA 外渗量显著增加,说明香芹酚可以在短时间内破坏细胞膜的结构,再次验证电导率的试验结果。
蛋白质是生命中至关重要的物质基础,可分为可溶性蛋白和非可溶性蛋白两大类。可溶性蛋白是细菌重要的渗透压调节物质,它可以提高细菌的保水能力,保证细菌的生命活动正常进行[31]。SDSPAGE 试验结果和BCA 蛋白浓度测定结果显示,香芹酚作用于USA300 菌体后,菌体的可溶性蛋白含量显著增加,分析原因可能是香芹酚诱导了USA300 抗性蛋白及其相关蛋白的增加,菌体通过此生命活动来抵抗香芹酚的伤害,暗示了干扰蛋白质代谢可能不是香芹酚的抑菌机制。LDH 是一种重要的可溶性蛋白,它对于金黄色葡萄球菌保持致病力、逃避宿主的先天性免疫是极其重要的[32]。LDH含量测定试验结果表明,香芹酚作用于USA300 后,菌体内LDH 含量明显增多,其原因可能是香芹酚诱导了USA300 生物酶的表达,菌体以此来抵抗香芹酚的损伤和维持自身的生长代谢,暗示影响酶的活性可能不是香芹酚发挥抑菌作用主要途径,再次验证了SDS-PAGE 试验的试验结果。
扫描电镜和透射电镜在抑菌机制的研究中被广泛应用。本试验的图像表明,香芹酚可以直接损伤菌体的细胞壁,影响其结构的完整性。细胞壁可以维持细菌正常的形态结构,当香芹酚损伤细胞壁后,菌体形态发生改变,出现形变萎缩的现象。
细菌生物被膜既具有天然屏障的作用[33],又可以改变被膜内微环境[34],因此极大地增加了细菌对抗生素的耐药性。生物被膜试验结果显示,亚抑菌浓度下,香芹酚抑制生物被膜形成的能力与香芹酚浓度呈正相关,且都不影响细菌的正常生长。此试验结果表明,亚抑菌浓度下,香芹酚可以有效抑制MRSA 生物被膜的形成,降低耐药性的产生,进一步说明香芹酚具有开发为抗MRSA 感染药物的潜力。
综上所述,香芹酚具有良好的抗MRSA 活性,其抑菌机制主要是通过破坏USA300 的细胞壁、改变细胞膜的通透性来抑制USA300 的生长繁殖,并且其在亚抑菌浓度下能有效抑制生物被膜的形成。其他抑菌机制还需要进一步研究。
