醋蛋液水解物的类蛋白反应修饰及其对胆酸结合能力的影响
2019-05-14郑玥曾庆梅
郑玥 曾庆梅


摘要[目的]探讨类蛋白反应在醋蛋液水解过程中对其胆酸结合能力的影响。[方法]采用胃蛋白酶水解醋蛋液,制备水解度为43.61%,胆酸结合能力为64.01%的醋蛋液水解物,并以游离氨基减少量为试验指标,利用响应面法优化胃蛋白酶催化的类蛋白反应修饰条件,得到不同修饰程度的产物,测定其结合胆酸的能力。[结果]修饰产物的胆酸结合能力均提高,并且结合能力最高的修饰产物的结合能力达到102.1%,该修饰产物通过乙醇∶水(7∶3)或乙醇∶水(3∶7)比例的溶剂进行离心分级后,上清液(沉淀)部分的胆酸结合能力高于(低于)修饰产物,并通过对该修饰产物和上清液部分、沉淀部分的进一步酶水解处理的结果显示,酶水解会导致它们的结合能力降低,但是仍然高于最初的醋蛋液水解物。[结论]类蛋白反应可以提高醋蛋液水解物的胆酸结合能力和对蛋白酶抵抗的能力。
关键词类蛋白反应;醋蛋液水解物;胃蛋白酶;溶剂萃取;蛋白酶抵抗
中图分类号TS201.2文献标识码A
文章编号0517-6611(2019)01-0154-04
doi:10.3969/j.issn.0517-6611.2019.01.047
开放科学(资源服务)标识码(OSID):
大量科学理论证明食物蛋白水解物与胆酸结合可以阻止胆酸重吸收,从而降低内源性胆固醇浓度[1-3]。胆酸结合能力可能与水解物和肽暴露出的疏水性氨基酸残基有关系[4]。同时,许多研究发现蛋白水解物比蛋白质本身有着更大的结合潜力[5-6]。醋蛋液是一种民间广为流传的饮品,它有很多药理作用,比如免疫系统调节、消化功能提升、减轻人体内胆固醇水平、降血压和抗氧化等作用。许多人从醋蛋液中分离出ACE抑制肽和抗氧化肽[7-8]。但是目前还没有从醋蛋液中分离出可以结合胆酸的肽。
类蛋白反应在食品科学领域是一种很重要的反应,其反应机制具有多样性和争议性。在同一个反应系统中可能含有多个反应机制,主要包括水解、聚集、转肽作用和物理聚集。主导类蛋白反应机制是由反应系统的特定条件(反应底物、酶和其他条件)决定的。类蛋白反应可以有效地去除蛋白水解物的苦味[9],通过引进许多重要的氨基酸进入蛋白水解物的肽分子解决氨基酸组成失衡问题[10-11]。
类蛋白反应利用某些分子的氨基酸序列改变,即新的肽分子的产生和氨基酸序列的重组,改善生物活性肽提高其生理活性。Qian等[12]通过测定胆酸结合能力来研究类蛋白
反应的作用,发现类蛋白反应可以提高胆酸结合能力。Howard等[13]报道蛋白水解物通过结合胆酸由胆固醇转化为胆酸。鸡肉水解物的类蛋白反应修饰物由于肽聚集比原水解物捆绑更多的胆酸[14]。因此,利用胃蛋白酶制备醋蛋液水解物,再利用胃蛋白酶催化的类蛋白反应对水解物进行修饰,评价其胆酸结合能力和探究进一步酶水解对其结合能力的影响。
1材料與方法
1.1材料与试剂
胃蛋白酶,碱性蛋白酶,胰蛋白酶,上海源叶生物科技公司;其他试剂均为分析纯。
1.2仪器与设备AG135电子水平(梅特勒-托利多仪器上海有限公司);BSG-26电热恒温水浴锅(上海一恒科学仪器有限公司)。
1.3试验方法
1.3.1醋蛋液水解物的制备。
鸡蛋用水洗净后,95%酒精消毒,晾干后按照1∶3(W/V)的比例放于米醋中,浸泡48h后,鸡蛋被戳破搅拌获得混合液。最后,混合液被冻成粉,便于后续分析。醋蛋粉(5g)溶解于50mL去离子水中,用1.0mol/LHCl调节pH至2.0,加入胃蛋白酶于37℃下水解1~7h,在100℃水浴中保持10min后终止反应。待冷却到室温后,5000r/min离心15min,取上清液测定其水解度和胆酸结合能力。具有最大结合能力的水解物被大量制备,冻干,用于类蛋白反应的底物。
1.3.2醋蛋液水解物的类蛋白反应修饰。
用胃蛋白酶对醋蛋液水解产物进行类蛋白反应修饰。采用中心组合试验,通过测定反应体系的游离氨基量变化,利用响应面法对底物质量浓度、酶添加量、反应温度等3个反应条件进行优化(表1),以选择适宜的修饰反应条件。反应结束后,修饰产物在沸水浴灭酶15min,冷却后冻干,20℃储存备用。在优选的条件下,改变反应时间(1,3,5,7和9h)制备5个修饰产物,测定游离氨基含量及其胆酸结合能力。具有最大结合能力的修饰产物被大量制备,冻干,以备后续的溶剂萃取和进一步酶解。
1.3.3修饰产物的溶剂萃取和分离。
利用不同的介质对最大结合能力的修饰产物进行分离,10000r/min离心30min,分离出上清液和沉淀,测定其游离氨基含量和胆酸结合能力,分别冻干,用于进一步研究。
1.3.4修饰产物和上清液、沉淀部分的进一步酶解。对最大结合能力的修饰产物和离心分级产物(上清液部分和沉淀部分)分别采用胃蛋白酶、碱性蛋白酶和胰蛋白酶进行酶水解处理,并对其产物的游离氨基含量和胆酸结合能力进行分析测定。
1.3.5游离氨基含量、醋蛋液水解度(DH)和胆酸结合能力测定。
样品游离氨基含量通过邻苯二甲醛(OPA)法测定[15-16],醋蛋液水解度通过Adler-Nissen提出的公式计算[17],胆酸结合能力根据Kahlon和Chow提出的方法来测定[18],使用消胆胺作为胆酸结合能力的阳性对照药物。
2结果与分析
2.1醋蛋液水解物的制备
胃蛋白酶在人体胃环境中保持稳定,我们希望醋蛋液类蛋白修饰产物稳定存在于胃中,所以胃蛋白酶被选择作为该研究中水解和聚集作用的催化剂[12]。醋蛋液相对于消胆胺(结合能力100%)来说具有43.21%的胆酸结合能力。由图1可以看出,当水解时间在0~5h,制备的醋蛋液水解物的水解度从21.24%上升到43.61%,胆酸结合能力从43.21%提高到64.01%。但是,更长的水解时间不能显著影响其结合能力。水解度为43.61%时,水解物的胆酸结合能力最大,为64.01%,因此选择此醋蛋液水解物作为进一步修饰反应的底物。
Sun等[19]用碱性蛋白酶水解酪蛋白6h后得到水解度为10.9%,IC50为52.6μg/mL的水解物,Zhang等[20]用碱性蛋白酶水解大豆蛋白,获得的大豆蛋白水解物水解度为14.0%,螯合钙离子能力为41.0mg/g肽。Wei等[21]报道称酪蛋白被水解4h时,水解物表现出最大的ACE抑制活性(42.9%)。Lin等[22]发现海瓜子的可食用肌肉部分在消化酶水解后有更强的胆酸结合能力。该研究结果与以上结论较为相近,说明在一定范围内,某些蛋白质的胆酸结合能力和其水解度呈正相关。
2.2醋蛋液水解物的类蛋白反应修饰与产物的胆酸结合能力通过中心组合试验,利用响应面法对底物浓度、酶添加量、反应温度等3个反应条件进行优化(表1),共计20次试验,以选择适宜的修饰反应条件。采用Design-Expert8.0.6软件设计试验条件,对其结果进行多元线性回归拟合,得到底物浓度(X1)、酶添加量(X2)和反应温度(X3)的回归方程模型:
Y=+101.76+6.58X1+2.60X2+5.25X3-1.75X1X2-3.50X1X3-7.50X2X3-4.06X12-10.42X22-5.83X32
P<0.0001,失拟项P=0.0771>0.05,说明该模型失拟不显著,方程能够反应游离氨基变化量与各因素之间的关系;R2=0.9536,R2Adj=0.9118,即该模型能解释91.18%,有4.78%的变异不能用该模型解释,说明该模型与实际拟合较好,影响因素与响应值之间的关系显著,因此能用此模型对游离氨基变化量进行分析和预测(图2)。A、C、BC、A2、B2、C2对应的P值小于0.01,影响极显著,说明这几个因素对游离氨基变化量的影响大,由F值的大小可知,3個因素对游离氨基变化量的影响顺序为底物浓度>反应温度>酶添加量。
根据所得的模型,进一步确定各因素最佳条件,得优化的提取条件:底物浓度为42.07%,酶添加量为2.47kU/gpeptides,反应温度为32.54℃,预测的结果为104.721μmol/gpeptides。为了便于操作,将以上参数修正为:底物浓度为42.1%,酶添加量为2.5kU/gpeptides,反应温度为32.5℃,2组平行试验的结果分别为103.5和102.8μmol/gpeptides,平均值为103.15μmol/gpeptides,低于计算值104.721μmol/gpeptides(P>0.05),表明采用该模型得到的预测值与试验真实值相符度高,得到的条件参数可靠。
利用这些反应条件,对醋蛋液水解物进行修饰,根据反应时间不同(1、3、5、7和9h)制备5个不同修饰程度的修饰产物(产物1~5),它们的胆酸结合能力、游离氨基变化量列于表2,结果表明,在类蛋白反应初始阶段,游离氨基减少量增加,反应时间5h,游离氨基减少量最大,为103.7μmol/gpeptides,游离氨基含量下降最多,这可能是因为酶解导致的游离氨基酸的共价修饰,导致酰胺结合和肽的聚集[12]。反应时间超过5h后,游离氨基减少量不再增加,随着反应时间的延长,水解程度不断增强[23]。这些修饰产物的胆酸结合能力从61.3%增加到102.1%(相对于消胆胺),均比原始的醋蛋液水解物(52.7%)要高,表明类蛋白反应可以增强醋蛋液水解物的单算结合能力。因此,将反应时间为5h的修饰产物,即修饰产物5用于进一步的溶剂萃取和酶解。
2.3修饰产物的溶剂萃取
Qian等[12]报道许多水解物中的肽在类蛋白反应期间聚集形成沉淀,疏水性肽键可能在反应中发挥很大的作用。修饰产物5在加入不同溶剂后进行离心分级分离,分离后分别得到上清液和沉淀2个部分。由表3可知,乙醇-水溶剂(7∶3,V/V)可以有效地分离修饰产物5的活性部分,获得的上清液相比醋蛋液水解物有着较高的胆酸结合能力,而沉淀的胆酸结合能力弱于醋蛋液水解物,结果表明低极性溶剂可以丰富疏水性肽组分。相反,乙醇-水(3∶7,V/V)有较高的极性,所以低极性肽组分在沉淀部分被发现而展现出较高的结合能力。说明疏水性肽组分存在于低极性溶剂中,可能是增加胆酸结合能力的主要原因。疏水性氨基酸因为其两亲性结构通过疏水作用结合胆酸[24]。Brownsell等[25]报道蛋白水解物在通过类蛋白修饰后,其疏水性氨基酸组成增加,从而影响其胆酸结合能力。
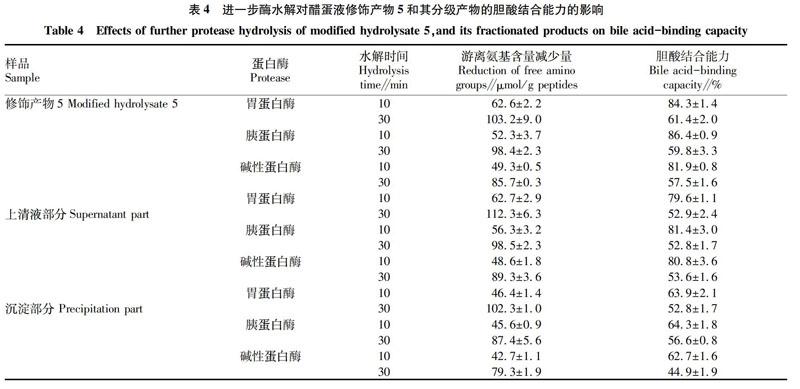
2.4修饰产物和分级产物进一步酶解与胆酸结合能力的变化
由表4可知,修饰产物5和它的分级产物相对于其对应的底物都有更高的游离氨基含量,表明它们均被3种酶进一步的水解。但是,进一步酶解的最终产物的胆酸结合能力低于修饰产物5(76.4%)或者分级产物(上清液106.4%,沉淀70.3%)。可见,每一个样品的胆酸结合能力都被降低,且对胃蛋白酶、碱性蛋白酶和胰蛋白酶的水解敏感。整体来说,目前的研究表明类蛋白修饰不仅能够提高醋蛋液水解物的胆酸结合能力,而且能够提高其对蛋白酶的抵抗能力。在3种酶的水解之后,相比于溶剂萃取后的产物,修饰产物5具有更强的胆酸结合能力,表明醋蛋液修饰产物不能通过溶剂萃取提高其对蛋白酶抵抗的能力。
3结论
通过对胃蛋白酶水解制备的醋蛋液水解物进行类蛋白反应修饰,胆酸结合能力从52.7%提高到102.1%,以游离氨基含量减少量为指标,响应面法得到的类蛋白修饰反应条件为:底物浓度42.1%、酶添加量2.5kU/gpeptides、反应温度25℃和反应时间5h。利用体积比为7∶3的乙醇-水溶剂对修饰产物进行离心分级处理,表明上清液的胆酸结合能力明显高于修饰产物,但是沉淀部分则低于修饰产物。修饰产物及离心分级产物的进一步酶水解处理,表明类蛋白修饰不仅能够提高醋蛋液水解物的胆酸结合能力,而且能够提高其对蛋白酶的抵抗能力。
參考文献
[1]ALHAJOA,IRSHADI,KANEKANIANAD.HypocholesterolemicandangiotensinIconvertingenzymeinhibitingactivityoftrypsinhydrolysedbovinecasein[J].Journalofnutritionalhealth&foodengineering,2016,5(3):177.
[2]NAGAOKAS,FUTAMURAY,MIWAK,etal.Identificationofnovelhypocholesterolemicpeptidesderivedfrombovinemilkbeta-lactoglobulin[J].Biochemicalandbiophysicalresearchcommunications,2001,281(1):11-17.
[3]SHIRATAS,ODAK,ONODERAMASUOKAN,etal.HypocholesterolemiceffectofindigestiblefractionofChlorellaregularisincholesterolfedrats[J].Journalofnutritionalscienceandvitaminology,2001,47(6):373-377.
[4]KONGODIAMOUKALAJU,ZHANGH,IRAKOZEPC.Invitrobindingcapacityofbileacidsbydefattedcornproteinhydrolysate[J].Internationaljournalofmolecularsciences,2011,12(2):1066-1080.
[6]MULLALLYMM,MEISELH,FITZGERALDRJ.Angiotensin-I-convertingenzymeinhibitoryactivitiesofgastricandpancreaticproteinasedigestsofwheyproteins[J].Internationaldairyjournal,1997,7(5):299-303.
[6]PIHLANTOLEPPLA,ROKKAT,KORHONENH.AngiotensinIconvertingenzymeinhibitorypeptidesderivedfrombovinemilkproteins[J].Internationaldairyjournal,1998,8(4):325-331.
[7]杨锋,陈锦屏,吴莉莉.醋蛋多肽血管紧张素转化酶抑制活性的稳定性研究[J].食品工业科技,2012,33(11):151-153,156.
[8]杨锋,陈锦屏,林心怡.美拉德反应对醋蛋多肽抗氧化活性的影响[J].食品科学,2013,34(3):137-140.
[9]STEVENSONDE,OFMANDJ,MORGANKR,etal.Proteasecatalyzedcondensationofpeptidesasapotentialmeanstoreducethebittertasteofhydrophobicpeptidesfoundinproteinhydrolysates[J].Enzymeµbialtechnology,1998,22(2):100-110.
[10]ASHLEYDV,TEMLERR,BARCLAYD,etal.Aminoacidenrichedplasteins:Asourceoflimitingaminoacidsfortheweanlingrat[J].Journalofnutrition,1983,113(1):21-27.
[11]YAMASHITAM,ARAIS,AMANOY,etal.Anovelonestepprocessforenzymaticincorporationofaminoacidsintoproteins:Applicationtosoyproteinandflourforenhancingtheirmethioninelevels[J].Agriculturalandbiologicalchemistry,1979,43(5):1065-1068.
[12]QIANF,WANGY,WENZJ,etal.Plasteinreactionenhancedbile-acidbindingcapacityofsoybeanproteinhydrolysatesandwheyproteinhydrolysates[J].Journaloffoodscience&technology,2018,55(3):1021-1027.
[13]HOWARDA,UDENIGWECC.Mechanismsandprospectsoffoodproteinhydrolysatesandpeptideinducedhypolipidaemia[J].Food&function,2013,4(1):41-50.
[14]UDENIGWECC,MOHANA,WUSH.Peptideaggregationduringplasteinreactionenhancedbileacidbindingcapacityofenzymaticchickenmeathydrolysates[J].Journaloffoodbiochemistry,2015,39(3):344-348.
[15]CHURCHFC,SWAISGOODHE,PORTERDH,etal.Spectrophotometricassayusingophthaldialdehydefordeterminationofproteolysisinmilkandisolatedmilkproteins[J].Journalofdairyscience,1983,66(6):1219-1227.
[16]SPELLMAND,MCEVOYE,OCUINNG,etal.Proteinaseandexopeptidasehydrolysisofwheyprotein:ComparisonoftheTNBS,OPAandpHstatmethodsforquantificationofdegreeofhydrolysis[J].Internationaldairyjournal,2003,13(6):447-453.
[17]ADLERNISSENJ.Determinationofthedegreeofhydrolysisoffoodproteinhydrolysatesbytrinitrobenzenesulfonicacid[J].Journalofagriculturalandfoodchemistry,1979,27(6):1256-1262.
[18]SAIGAA,TANABES,NISHIMURAT.Antioxidantactivityofpeptidesobtainedfromporcinemyofibrillarproteinsbyproteasetreatment[J].Journalofagriculturalandfoodchemistry,2003,51(12):3661-3667.
[19]SUNH,LITJ,ZHAOXH.AceInhibitionandenzymaticresistanceinvitroofacaseinhydrolysatesubjectedtoplasteinreactioninthepresenceofextrinsicprolineandethanolormethanolwaterfractionation[J].Internationaljournaloffoodproperties,2014,17(2):386-398.
[20]ZHANGY,ZHAOXH.InvitroangiotensinI-convertingenzymeinhibitionofcaseinhydrolysateresponsibleforplasteinreactioninethanol-watermedium,solventfractionation,andproteasedigestion[J].Internationaljournaloffoodproperties,2014,17(7):1577-1590.
[21]WEIX,LITJ,ZHAOXH.CoupledneutrasecatalyzedplasteinreactionmediatedtheACE-Inhibitoryactivityinvitroofcaseinhydrolysatespreparedbyalcalase[J].Internationaljournaloffoodproperties,2013,16(2):429-443.
[22]LINYH,TSAIJS,CHENGW.Purificationandidentificationofhypocholesterolemicpeptidesfromfreshwaterclamhydrolysatewithinvitrogastrointestinaldigestion[J].Journaloffoodbiochemistry,2017,41(4):12385.
[23]UDENIGWECC,WUSH,DRUMMONDK,etal.Revisitingtheprospectsofplastein:Thermalandsimulatedgastricstabilityinrelationtotheantioxidativecapacityofcaseinplastein[J].Journalofagriculturalandfoodchemistry,2014,62(1):130-135.
[24]HIGAKIN,SATOK,SUDAH,etal.Evidencefortheexistenceofasoybeanresistantproteinthatcapturesbileacidandstimulatesitsfecalexcretion[J].JournaloftheagriculturalchemicalsocietyofJapan,2006,70(12):2844-2852.
[25]BROWNSELLVL,WILLIAMSRJH,ANDREWSAT.Applicationoftheplasteinreactiontomycoprotein:II.Plasteinproperties[J].Foodchemistry,2001,72(3):337-346.
