层间阳离子对蒙脱石凝胶性能的影响
2019-05-14
(中国地质大学(北京)材料科学与工程学院, 北京100083)
蒙脱石是含少量碱金属和碱土金属的层状水铝硅酸盐矿物,其晶体呈典型的2∶1层状黏土矿物结构,即由2层硅氧四面体和1层铝氧八面体组成。在晶体构造层间含水及一些交换阳离子[1]。蒙脱石颗粒细小,约0.2~2 μm[2]。
蒙脱石具有典型的阳离子交换能力。当它们吸收水分后可以膨胀并超过原体积的几倍[3]。蒙脱石凝胶是通过蒙脱石深加工制备的、可以在水溶液中形成假塑性流体的黏稠性胶体,其独特的层状硅酸盐结构使其具有高度的亲水性,可以在水溶液中高度分散形成空间网状结构,自由水变成束缚水,自身的黏度提升,因此具有优良的触变性、流变性、悬浮性、吸附性等性能[4]。
蒙脱石的用途非常广泛,如造纸、橡胶、化妆品的填充剂,油墨、油性和水性涂料的流变助剂,动物饲料防霉剂, 石油脱色剂,石油裂化催化剂载体,地质、石油、页岩气钻探用泥浆助剂,冶金用粘合剂以及医药制剂等[5],因此被人们称之为万能土。
已有的对蒙脱石凝胶性能的研究中, 大多集中于对蒙脱石的复合改性或如何改进凝胶制备工艺。 例如, 孙红娟等[6]发现层间阳离子的半径越小、 电荷数越大, 其离子水化能就越大, 蒙脱石的膨胀容随水化能的增大而增大; 郏梦子等[7]发现了制得高黏度无机凝胶的原料配比; Bailey等[8]通过添加少量二氧化硅颗粒显著改变了悬浊液系统中的能流变性。 Choo等[9]研究了溶液pH对蒙脱石悬浮液的影响。
本文中以不同产地的4种蒙脱石样品为原料, 以锂、 钠、 镁、 铝、 铁不同电荷数的金属阳离子置换蒙脱石层间的钙离子, 分别获得锂基、 钠基、 钙基、 镁基、 铝基和铁基蒙脱石; 研究层间金属阳离子的种类和电荷数对蒙脱石结构、 形貌、 Zeta电位、 分散状态的影响, 探讨其对凝胶性能的影响规律。
1 实验
1.1 试剂与原料
实验试剂有:碳酸钠,北京化工厂;碳酸锂,西陇化工股份有限公司;五水碱式碳酸镁,国药集团化学试剂有限公司;氯化铝,北京化工厂;氯化铁,北京益利精细化学品有限公司。试剂均为分析纯。
蒙脱石原矿样品(记为Mt)产地如表1所示。蒙脱石原料样品的XRD图谱如图1所示。蒙脱石的矿物组分、层间距d(001)值、类型、每100 g蒙脱石的阳离子交换量等参数如表2所示。综上可知4个Mt样品均为钙基蒙脱石,所含杂质主要为石英、方石英、钠长石、方解石4种,蒙脱石含量均在90%以上。

表1 蒙脱石原矿样品产地
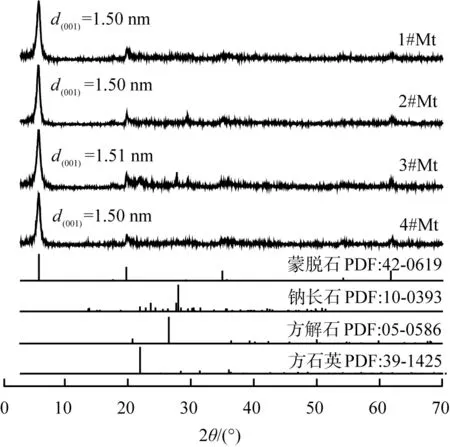
图1 蒙脱石原料样品的XRD图谱Fig.1 XRD patterns of Mt raw material samples
1.2 不同层间阳离子蒙脱石的制备
将60 ℃烘干24 h后的Mt加入蒸馏水中, 水化分散8 h, 充分搅拌10 min后去除杂质, 按照Mt中CEC含量的1.5倍分别加入不同金属阳离子以置换Ca2+, 制备出含不同层间阳离子的Mt样品: 1#Mt-M、 2#Mt-M、3#Mt-M和4#Mt-M。 其中, M分别为Li+、 Na+、 Ca2+、 Mg2+、 Al3+、 Fe3+。
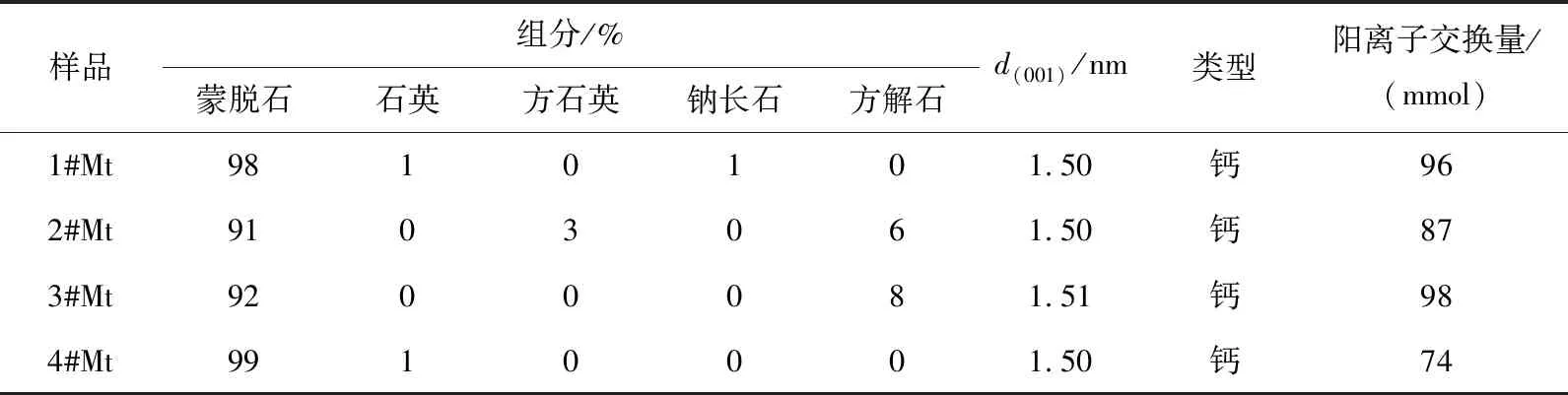
表2 蒙脱石原料样品参数
1.3 不同层间阳离子蒙脱石的表征
1)XRD表征。采用布鲁克科学仪器香港有限公司的D8 Advance X射线衍射仪对各样品进行表征。Cu靶、步宽0.02 °、电压60 kV,X射线波长λ为0.154 nm,扫描范围为3~70 °。
2)SEM表征。采用日本电子公司的JSM-6 700F扫描电镜对各样品进行表征。电压20 kV,测试前样品作喷金处理。
3)Zeta电位表征。称取样品各0.01 g,分别加入10 mL蒸馏水,超声振荡10 min,得到测试样品。采用英国马尔文仪器有限公司的Zetasizer Nano ZS90纳米粒度和Zeta电位仪测试各样品。样品温度为25 ℃,样品池可抛弃折叠毛细管样品池 (DTS1070)。
4)黏度表征。按《GB/T 5005—2010钻井液材料规范》[10]制备不同层间阳离子的蒙脱石测试样品。采用上海精天电子仪器有限公司的NDJ-8S数显旋转黏度计测试各样品。
5)显微镜表征。取黏度测试中的样品各10 mL,各用滴管取一滴在载玻片上,盖上盖玻片,制成显微样品。采用日本奥林巴斯有限公司的偏光显微镜BX51-1对各样品进行表征。
2 结果与分析
2.1 不同层间阳离子蒙脱石的XRD图谱
不同层间阳离子的Mt样品的层间距d(001)值如表3所示。
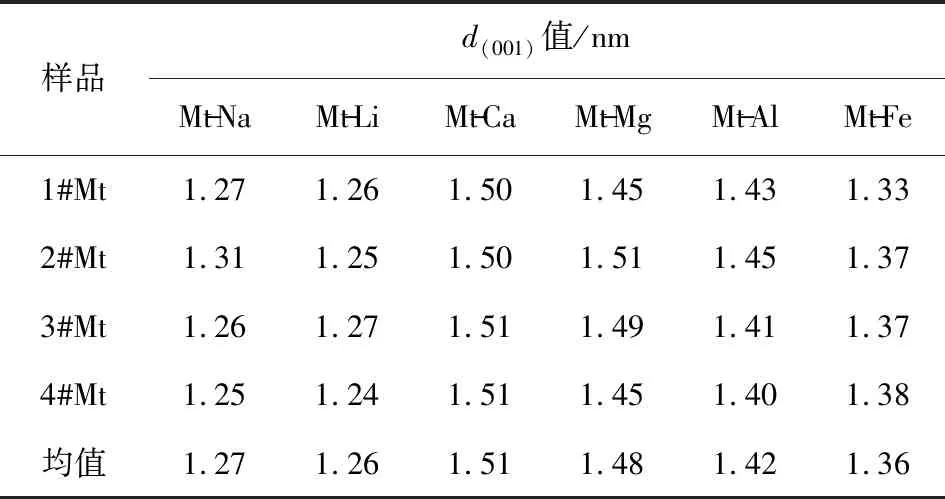
表3 不同层间阳离子的Mt样品的层间距
含不同层间阳离子的Mt样品的XRD图谱如图2所示。由图2可以看出,层间阳离子影响蒙脱石的层间距d(001)值, 从而改变了其结构。 其中, 层间为1价阳离子的Mt-Li、Mt-Na的层间距最小;层间为2价阳离子的Mt-Ca、Mt-Mg的层间距最大;层间为3价阳离子的Mt-Fe、Mt-Al的层间距居中。由此可知,蒙脱石的层间距随层间阳离子电荷数的增加呈先增加后降低的趋势。
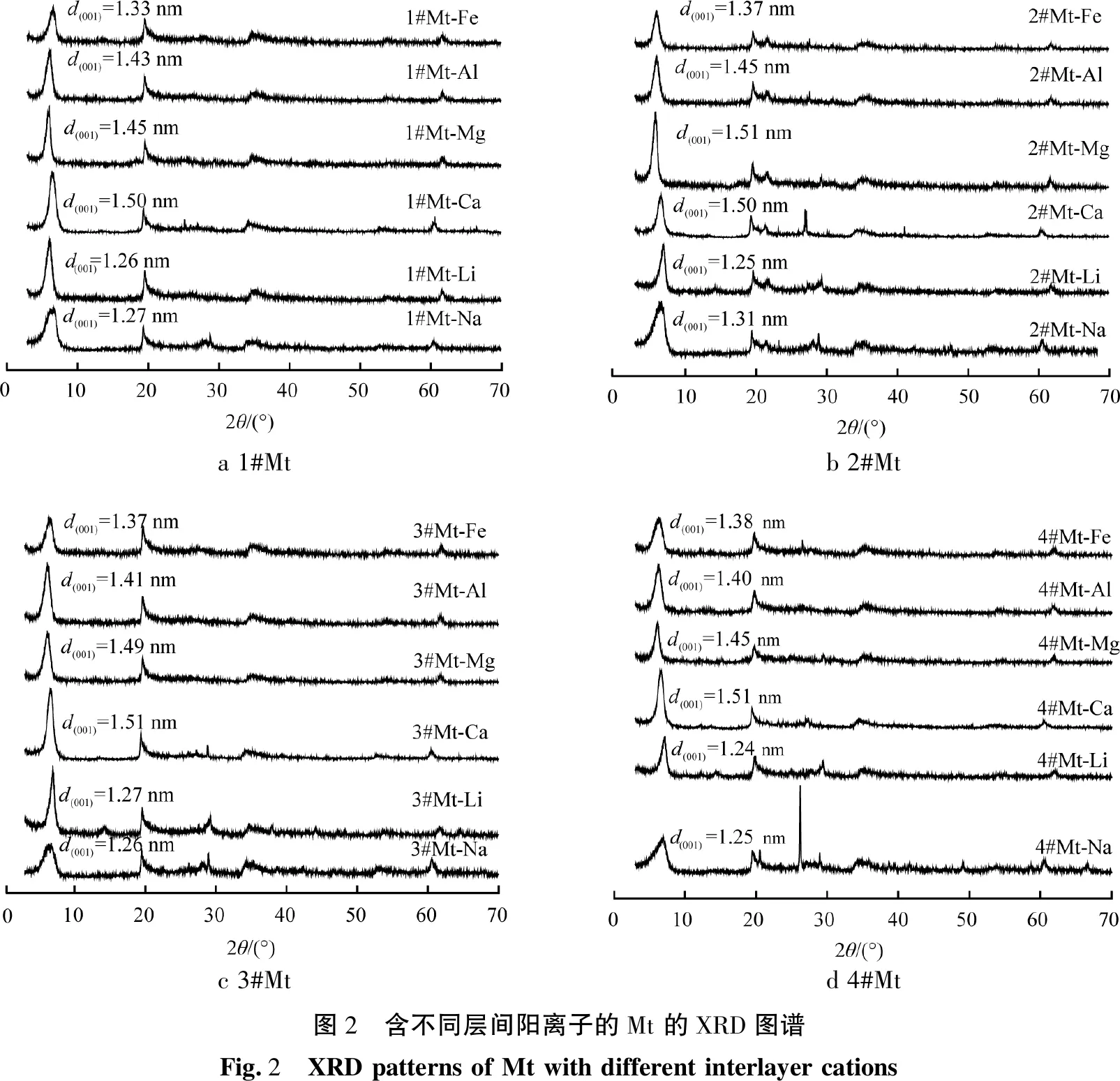
a 1#Mtb 2#Mtc 3#Mtd 4#Mt图2 含不同层间阳离子的Mt 的XRD图谱Fig.2 XRD patterns of Mt with different interlayer cations
层间金属阳离子的半径小、价态高,其离子水化能就越大,金属离子的水合半径越大,蒙脱石的层间距就越大。6种阳离子的离子半径、水合离子半径如表4所示[11-12]。

表4 6种阳离子的离子半径和水合离子半径
由表4可知,6种层间金属阳离子水合离子半径从大到小的顺序为
Al3+>Fe3+>Mg2+>Ca2+>Li+>Na+,
(1)
因此6种层间阳离子蒙脱石的层间距大小顺序应为
d(001)-Al>d(001)-Fe>d(001)-Mg>d(001)-Ca>d(001)-Li>d(001)-Na,
(2)
而实验结果则为
d(001)-Ca>d(001)-Mg>d(001)-Al>d(001)-Fe>d(001)-Na>d(001)-Li。
(3)
从以下2个方面分析式(3)产生的原因:
1)不同价态层间阳离子的比较。选取2价离子(Mg2+、Ca2+)和3价离子(Al3+、Fe3+)进行比较。他们的水合离子半径数值相近,但3价离子Al3+、Fe3+的半径明显小于2价Mg2+、Ca2+的半径,表明Al3+、Fe3+的静电引力作用远大于Mg2+、Ca2+,导致层间距出现d(001)-M2+>d(001)-M3+。
2)相同价态层间阳离子的比较。相同价态的2种阳离子的水化离子半径差异不大,但同价态2种离子的半径差异却很明显,Li+、Mg2+的离子半径均较Na+、Ca2+小很多,故Li+、Mg2+对片层的静电引力作用远大于Na+、Ca2+。所以在相同价态且水和离子半径相差不大时,静电引力影响了层间距,故有了d(001)-Na>d(001)-Li和d(001)-Ca>d(001)-Mg的结果。而Al3+和Fe3+的离子半径相当,2种离子对片层的静电引力相当,此时取决于水和离子半径的贡献,因而d(001)-Al>d(001)-Fe。
综上所述,高价态且离子半径小的层间阳离子对水合离子半径有大的贡献,水合离子半径与层间距正相关;同时,价态数高、半径小的阳离子对蒙脱石片层的静电引力大,对片层的束缚作用力强,水化膨胀能力差,蒙脱石的层间距小,因此,蒙脱石的层间距与层间阳离子的价态数负相关,与离子半径正相关。蒙脱石的层间距是水化离子半径和静电引力这2种因素共同作用的结果。
2.2 不同层间阳离子蒙脱石的SEM图像
不同层间阳离子的Mt的SEM图像如图3所示,反映了不同层间阳离子对蒙脱石形貌的影响。
由图3可知,不同层间阳离子的Mt颗粒片层的分散程度有别。图3a、3b中的1价层间阳离子的Mt片层堆积较为松散,有很多Mt片剥离,且片层未完全沿同一方向堆积;图3c、3d中的2价层间阳离子的Mt片层堆积稍微紧密,有一些Mt片剥离,且Mt片层大部分沿同一方向堆积;图3e、3f中的3价层间阳离子的Mt片层堆积很紧密,几乎只有Mt颗粒的剥离,且蒙脱石片层堆积方向一致。Mt片层堆积由松散到紧密排序为
Li+>Na+>Mg2+>Ca2+>Al3+>Fe3+。
(4)
该结果与静电吸引力分析一致,层间阳离子电荷数越大,静电吸引力越强,蒙脱石片层堆积越紧密,越难以剥离分散。
2.3 不同层间阳离子蒙脱石的Zeta电位
测试4类样品的表面电性,不同层间阳离子Mt的Zeta电位如表5所示。

a Na+b Li+c Ca2+d Mg2+e Al3+e Fe3+图3 不同层间阳离子的Mt的SEM图像Fig.3 SEM images of Mt with deferent interlayer cations

表5 不同层间阳离子蒙脱石的Zeta电位
由表5可知,层间阳离子对Mt的Zeta电位有明显的影响。Mt-Na、Mt-Li和Mt-Fe具有较大的电位绝对值,均较Mt-Ca有明显提升;Mt-Al的Zeta电位绝对值处于中间;Mt-Mg、Mt-Ca的Zeta电位绝对值的Zeta电位绝对值相当,均较小。对应悬浮液的稳定性顺序为
Mt-Li>Mt-Na>Mt-Fe>Mt-Al>Mt-Mg>Mt-Ca。
(5)
2.4 不同层间阳离子蒙脱石的黏度
不同层间离子Mt的黏度如表6所示。黏度反映了其溶液的凝胶性能。

表6 不同层间阳离子蒙脱石的黏度
由表6可以看出, 6种层间金属阳离子对4种不同Mt样品的悬浮液黏度有明显的影响。 层间金属阳离子电荷数越大, 黏度越小; 同样电荷数时, 金属阳离子的半径越小黏度越大, 悬浮液黏度大小顺序为:
Mt-Li>Mt-Na>Mt-Mg>Mt-Ca>Mt-Al>Mt-Fe,
(6)
其中: Mt-Na、 Mt-Li的黏度最大,平均黏度分别42.54、 165.3 mPa·s; 2价的Mt-Ca和Mt-Mg、 3价的Mt-Al和Mt-Fe黏度却非常小, 仅为1.2~1.5 mPa·s。
层间金属阳离子电荷数越小,其与蒙脱石片层静电吸引力越小,蒙脱石片层在水中更易于剥离成纳米片,形成“卡房式”的网格结构,黏度值增大;相同电荷数的金属阳离子其水合能力越强,蒙脱石在水中膨胀性能越好,越容易使蒙脱石片层剥离,致使黏度越大;Zeta电位绝对值越大,蒙脱石悬浮液越稳定,悬浮液的凝胶性能越好。由此可知,层间金属阳离子的电荷数和金属离子的水合半径是影响蒙脱石的凝胶性能的2大主要因素。
2.5 不同层间阳离子蒙脱石的SEM图像
不同层间阳离子蒙脱石悬浮液的SEM图像如图4所示,反映了Mt颗粒在水中的大小和分散状态。

a Na+b Li+c Ca2+d Mg2+e Al3+f Fe3+图4 不同层间阳离子的Mt悬浮液的SEM图像Fig.4 SEM images of Mt suspension with different interlayer cations
由图4可知层间阳离子同样影响蒙脱石在水中的分散性能。 Mt-Li、 Mt-Na的悬浮液中蒙脱石的粒径明显小于其他4种, 每个细小颗粒松散地均匀分散在水中; Mt-Mg、 Mt-Al和Mt-Fe悬浮液中的粒径均远大于Mt-Li和Mt-Na, 这3种蒙脱石相对易于聚集; Mt-Mg、 Mt-Al和Mt-Fe的悬浮液中蒙脱石颗粒边缘的清晰程度顺次降低, 表明颗粒紧密程度逐渐降低, 分散性逐渐升高; Mt-Ca虽比Mt-Mg、 Mt-Al和Mt-Fe颗粒小, 但颗粒界面清晰、 独立, 悬浮性差。
3 结果与讨论
蒙脱石晶格内广泛存在着异价类质同像置换,形成层间负电荷,边缘断键形成正电荷。当蒙脱石分散在水中后,水渗透到片层之间,促使蒙脱石层膨胀、剥离并形成纳米片,分散的蒙脱石片的端面和平面通过静电作用形成“卡房式”三维空间结构,形成凝胶体系[13]。图5为不同层间阳离子的Mt在水中的分散过程。
由图5a可知,1价层间阳离子与蒙脱石片的静电吸引力较小,在水中的蒙脱石水化后迅速膨胀,且膨胀倍率高,片层易发生剥离;在片层剥离后,由于1价层间阳离子的蒙脱石具有较大的Zeta电位,颗粒之间不易团聚,蒙脱石片具有较好的分散性,同时蒙脱石片层面与端面之间具有较大的静电吸引力,使蒙脱石片易搭接成“卡房式”结构,形成凝胶,因此1价层间阳离子的蒙脱石具有较大的黏度和较好的凝胶性能。
由图5b可知,2价层间阳离子与蒙脱石片的静电吸引力略大,蒙脱石颗粒水化膨胀能力差,只能低倍率膨胀,剥离困难。同时,由于2价层间阳离子的蒙脱石具有较小的Zeta电位,蒙脱石颗粒间容易发生团聚,难以均匀分散和形成“卡房式”结构,因此2价层间阳离子的蒙脱石黏度很小,凝胶性能差。
由图5c可知,3价层间阳离子与蒙脱石片的静电吸引力较大,蒙脱石颗粒水化膨胀能力很差,蒙脱石片剥离程度很低,在水中几乎以蒙脱石颗粒形态存在;虽然3价层间阳离子的蒙脱石的Zeta电位较2价层间阳离子的蒙脱石值高,但由于该蒙脱石难以剥离成纳米片,无法形成“卡房式”结构,因此3价阳离子的蒙脱石黏度仍很小,凝胶性能差。
综上所述,蒙脱石悬浮液中的层间阳离子电荷越强,颗粒间静电吸引力越强,滑动层厚度越小,颗粒分散性越差[14]。蒙脱石的Zeta电位是蒙脱石颗粒表面的负电荷与阳离子共同作用的结果,Zeta电位的绝对值越大,说明蒙脱石分散性越好。

a 1价(Li+、Na+)b 2价(Mg2+、Ca2+)c 3价(Al3+、Fe3+)图5 不同层间阳离子的Mt在水中的分散过程Fig.5 Dispersion process of monovalent interlayer cations of Mt in water
4 结论
以4种不同产地的蒙脱石原矿为原料,制备了不同价态6种金属层间阳离子的蒙脱石及其悬浮液,发现层间阳离子对蒙脱石的结构、形貌、Zeta电位、分散状态和凝胶性能都会产生影响,各影响因素之间也有相互作用。主要结论有:
1)蒙脱石原料产地对蒙脱石的凝胶性能的影响不大;
2)层间阳离子价态数越小,水合离子半径越大,Zeta电位值越大,蒙脱石悬浮液的分散性越好、黏度越大,凝胶性能越好。
3)对于同价态的阳离子,水合离子半径越大,凝胶性能越好。
