柠檬黄与玉米醇溶蛋白的相互作用研究
2019-05-13饶震红王明安陈蓁蓁
饶震红, 王明安, 陈蓁蓁, 张 莉*
(1. 中国农业大学 理学院, 北京 100083; 2. 山东师范大学 化学化工与材料科学学院, 山东 济南 250014)
1 引 言
玉米醇溶蛋白(Zein)是玉米中含量最高的储藏蛋白,其氨基酸序列中超过50%是疏水性氨基酸残基,溶剂乙醇的含量及pH高低影响着玉米醇溶蛋白的性能[1]。研究表明玉米醇溶蛋白在醇的水溶液中可以自组装成微球形成纳米结构[2],微球结构是包埋的理想形态,因此玉米醇溶蛋白是传递物质的良好载体[3]。作为天然疏水两亲性高分子材料,玉米醇溶蛋白在药物缓释材料的应用以及利用包埋技术保护物质生物活性方面的研究成为当今的热点。Joye研究了玉米醇溶蛋白封装白藜芦醇的可能性[4];Gao研究了基于玉米醇溶蛋白和丙二醇海藻酸钠的二元配合物槲皮素的传递作用[5]。

生物大分子二级结构因结合而发生的变化会导致蛋白质整体性质的改变[15],为此本文利用荧光光谱、紫外光谱、ATR-FTIR傅里叶红外光谱和核磁共振氢谱探究柠檬黄与两亲性玉米醇溶蛋白的相互作用,分析柠檬黄的加入对玉米醇溶蛋白构象的影响,为玉米醇溶蛋白扩展应用范围及柠檬黄合成色素的合理使用提供借鉴资料。
2 实 验
2.1 仪器与试剂
LS55型荧光光度计、Lambda 650紫外-可见分光光度计(PerkinElmer公司);IS10傅里叶红外光谱仪(Thermo公司);Avance DPX 300 核磁共振波谱仪(Bruker公司);AB104-N分析天平(Mettler公司)。
玉米醇溶蛋白(北京百灵威科技有限公司,含量98%)用85%的乙醇超声溶解,配成5.3×10-2g/mL的储备液;柠檬黄(阿拉丁试剂有限公司)结构式见图1,用纯净水配成1.0×10-3mol/L的储备液,于阴凉暗处存放,用时分别逐级稀释到所需浓度。实验用水为纯净水。

图1 柠檬黄的化学结构
2.2 实验方法
2.2.1 荧光光谱分析
在若干只10 mL比色管中,均加入1.00 mL玉米醇溶蛋白溶液和不同浓度的柠檬黄溶液,用85%乙醇溶液稀释定容,混合均匀后,于不同温度下放置1 h,固定激发波长λex=280 nm,狭缝宽度5.0/5.0 nm,发射波长在280~410 nm范围,扫描荧光光谱。设置激发波长范围200~300 nm,发射波长范围260~380 nm,狭缝宽度5.0/5.0 nm,激发波长每递增5 nm扫描一次,得到玉米醇溶蛋白和柠檬黄与玉米蛋白结合后的三维荧光谱。
2.2.2 紫外差谱分析
室温下,若干支10 mL比色管中加入固定量的玉米醇溶蛋白溶液,再分别加入不同浓度的柠檬黄溶液,定容混合均匀,并放置1 h后,在270~320 nm范围内,以85%乙醇溶液为空白溶液,扫描各溶液的紫外光谱。记录吸收强度及最大吸收波长的变化,计算吸收强度的差值。
2.2.3 ATR-FTIR傅里叶红外分析及自去卷积计算
利用Thermo公司 IS10所带的衰减全反射ATR附件测定溶液的红外光谱,扫描范围4 000~400 cm-1,扫描次数64,数据间隔0.482 cm-1,分辨率4 cm-1。将一定浓度的玉米醇溶蛋白溶液与柠檬黄溶液按2∶1混合均匀,放置达到平衡后直接置于ATR附件上面,使用OMNIC 9软件进行红外光谱扫描。再用Peakfi V4软件对酰胺Ⅰ带区域进行去卷积计算。
2.2.4 核磁共振氢谱分析
配制一定浓度的柠檬黄溶液和一定浓度的柠檬黄与玉米醇溶蛋白相互作用达到平衡的溶液,分别放于核磁管中进行氢谱分析。核共振频率300 MHz,zg30脉冲序列,扫描次数6,弛豫时间2 s,谱宽7 183 Hz,脉冲宽度(P1)10.70 μs。
3 结果与讨论
3.1 柠檬黄与玉米醇溶蛋白相互作用的荧光光谱
玉米醇溶蛋白溶液与不同浓度的柠檬黄溶液混合后,所得荧光光谱如图2所示。结果表明随着柠檬黄浓度的增加,玉米醇溶蛋白在305.5 nm处的荧光强度逐渐降低,存在明显的荧光猝灭现象,最大发射波长微弱蓝移。
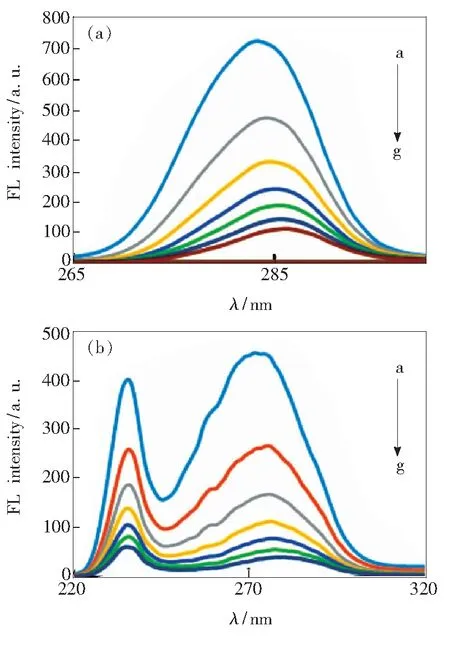
从同步荧光光谱同样观察到荧光猝灭现象,如图3所示,固定玉米醇溶蛋白的浓度,随着柠檬黄浓度的增加,玉米醇溶蛋白的荧光强度逐渐减弱。Δλ=60 nm时表现为玉米醇溶蛋白中色氨酸残基的光谱特征,Δλ=15 nm时表现为玉米醇溶蛋白中酪氨酸残基的光谱特征[16],酪氨酸和色氨酸的峰位均发生了不同程度的红移。说明柠檬黄的加入使得氨基酸残基微环境的疏水性降低,对玉米醇溶蛋白的构象产生了显著的影响。
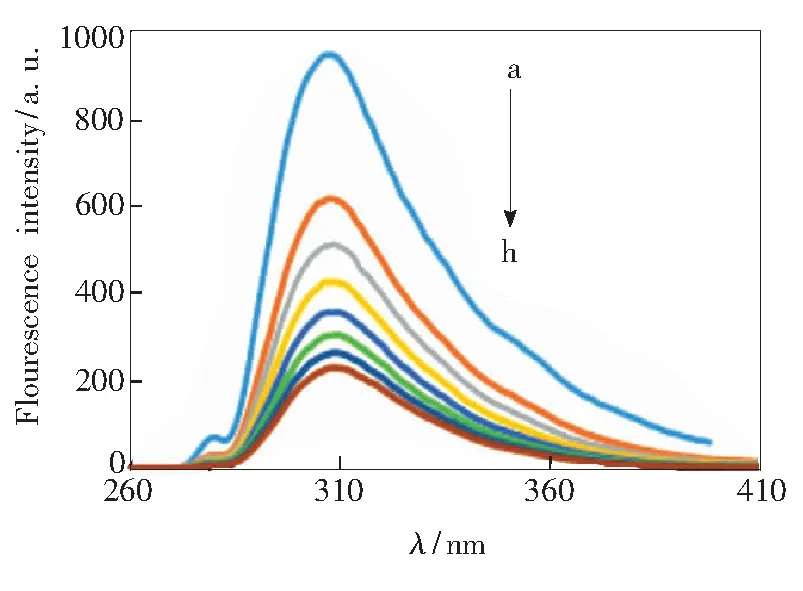
图2 不同浓度的柠檬黄与玉米醇溶蛋白的荧光光谱(T=299 K)
Fig.2 Fluorescence spectra of zein with different concentrations of tartrazine(T=299 K)
c(Zein)=4.7×10-4g/mL ;c(Tartrazine)(a~g): 0,2.0×10-5,4.0×10-5,6.0×10-5,8.0×10-5,1.0×10-4,1.2×10-4mol/L。
图3 柠檬黄与玉米醇溶蛋白的同步荧光光谱。 (a)Δλ=15 nm;(b)Δλ=60 nm。
Fig.3 Synchronous fluorescence spectrum of tartrazine-zeinsystem. (a) Δλ=15 nm. (b) Δλ=60 nm.
三维荧光光谱能够同时完整地表达出荧光强度随激发和发射波长变化的信息。从玉米醇溶蛋白加入柠檬黄前后变化的三维等高线图谱(图4)可以观察到等高线特征谱中的2个峰Peak A和Peak B的荧光强度值随着柠檬黄的加入明显降低,在相同的条件下,峰A降低了49%,峰B降低了29%。Peak A是蛋白质典型的荧光峰,Peak B主要体现了蛋白质肽链的结构特征。从表1的特征参数可知加入柠檬黄后,玉米醇溶蛋白Peak A斯托克斯位移发生红移,Peak B 斯托克斯位移几乎未变。

图4 玉米醇溶蛋白与柠檬黄混合液三维荧光光谱等高线图。(a)c(Zein)=1.1×10-4g/mL,c(Tartrazine)=0 mol/L; (b)c(Zein)=1.1×10-4g/mL,c(Tartrazine)=3.0×10-5mol/L。
Fig.4 Three-dimensional fluorescence contour diagram of tartrazine-zein. (a)c(Zein)=1.1×10-4g/mL,c(Tartrazine)=0 mol/L. (b)c(Zein)=1.1×10-4g/mL,c(Tartrazine)=3.0×10-5mol/L.

表1 三维荧光特征参数
3.2 柠檬黄对玉米醇溶蛋白紫外差示光谱分析
柠檬黄在紫外区有吸收,因而采用变化后与变化前的紫外吸收光谱差来考察柠檬黄对玉米蛋白构象的影响,如图5所示。在选择的实验条件下,玉米醇溶蛋白在 278 nm有特征吸收峰,主要由玉米醇溶蛋白分子中酪氨酸和色氨酸残基上芳杂环π-π*跃迁引起。随着柠檬黄浓度的增加,玉米醇溶蛋白在278 nm处的吸收峰值逐渐降低,呈现减色效应,最大吸收波长没有变化。说明柠檬黄与玉米醇溶蛋白发生了作用,由于柠檬黄结构中存在较大空间位阻,以及羧酸钠盐和磺酸盐的存在,不影响共轭程度,却改变了吸光系数。
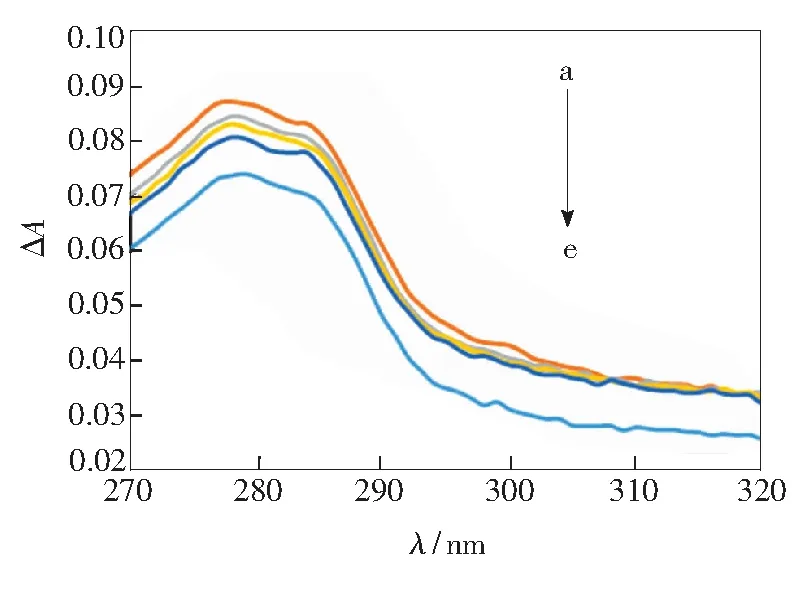
c(Zein)=1.05×10-4g/mL ;c(Tartrazine) (a~e):5.1×10-6,1.0×10-5,2.0×10-5,3.0×10-5,0 mol/L
图5 玉米醇溶蛋白与柠檬黄作用的紫外差谱
Fig.5 UV difference spectra of zein-tartrazine
3.3 傅立叶红外光谱分析及自去卷积计算


图6 玉米醇溶蛋白(a)及柠檬黄与玉米醇溶蛋白结合(b)的ATR-FTIR谱
Fig.6 ATR-FTIR spectra of zein(a) and tartrazine bound to zein(b)
红外谱图中的酰胺Ⅰ带(1 700~1 600 cm-1)是研究蛋白质二级结构最有价值的区域。这一区域多种谱峰重叠,形成一个宽的强吸收峰。将红外谱图进行基线校准,经SavitskGolay函数做5点平滑处理。选取酰胺Ⅰ带区域,用Peakfi V4软件得到傅立叶自去卷积曲线,在二阶导数谱图基础上用高斯曲线进行多次拟合,使得残差最小,得到完全可分辨的各子峰图谱,结果如图7所示。根据分开峰的位置,确定子峰的归属,每一种子峰对应着蛋白质中一种二级结构,通过计算子峰的积分面积,求出各种二级结构的相对百分含量[17-18],面积百分比见表2。
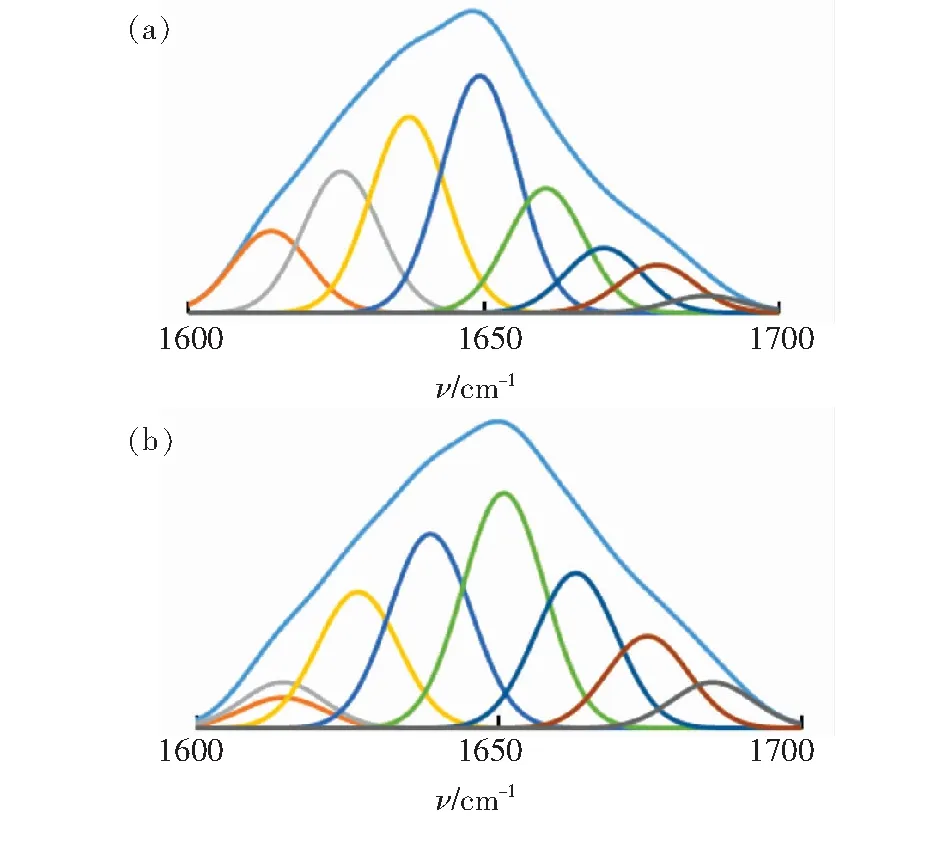
图7 酰胺Ⅰ带傅里叶去卷积曲线与二阶导数曲线的拟合。(a)玉米醇溶蛋白;(b)玉米醇溶蛋白-柠檬黄。
Fig.7 Fitting of Fourier I-band Fourier deconvolution curve with second derivative curve. (a) Zein. (b) Zein-Tartrazine.

表2 酰胺Ⅰ带子峰的位置、相对面积和归属
从表2中的数据可知,玉米醇溶蛋白与柠檬黄结合后α螺旋结构从13.7%增加为25.1%,增加了83.2%,β-折叠从46%减小为43.5%,降低了5.4%;无规卷曲消失,β-转角从14.24%增加为31.4%,增加了121%。α螺旋结构含量增加很多,说明分子间存在比较大的疏水作用,导致蛋白质多肽链结构收缩。柠檬黄与玉米蛋白结合红外光谱中指纹区吸收强度明显降低,也是α螺旋结构显著变化引起的。β-转角的特定构象一定程度上取决于与它组成的氨基酸,因为脯氨酸具有换装结构和固定的角,它在一定程度上迫使β-转角形成,而在玉米蛋白中脯氨酸的含量较大,使得柠檬黄与玉米蛋白结合β-转角改变很大,无规则卷曲消失,推测是柠檬黄的加入对脯氨酸结构的影响。通过核磁共振氢谱氢原子化学位移的变化,也可以观察到这种现象。
3.4 核磁共振光谱分析
核磁共振氢谱可以提供原子水平上结构信息的变化。图8是柠檬黄与玉米醇溶蛋白结合前后的核磁共振谱图。柠檬黄可以完全溶解于水,是极性的;微量的也可以溶于乙醇。当以DMSO为溶剂时,柠檬黄和玉米醇溶蛋白都处于低极性环境,3个质子峰从结合前的δ7.97,7.70,7.41到1 h后相应地变为δ7.94、7.66,7.37,略微地向高磁场移动,说明柠檬黄与玉米醇溶蛋白功能区的芳香族氨基酸发生了π-π相互作用,作用程度比较弱,而且4 h后化学位移没有变动。当以重水为溶剂时,重水促进微量玉米醇溶蛋白的溶解,在极性环境下,1 h后,3个质子峰从与玉米醇溶蛋白结合前δ7.81,7.73,7.43相应地变为δ8.04,7.82,7.63,化学位移有了明显的低场位移,4 h后,化学位移未再变化。说明在以重水为溶剂的极性环境下,柠檬黄与玉米醇溶蛋白的芳香族氨基酸发生了强烈的π-π相互作用,向低场移动明显。这种变化与溶剂的极性有关,与作用时间的长短无关。
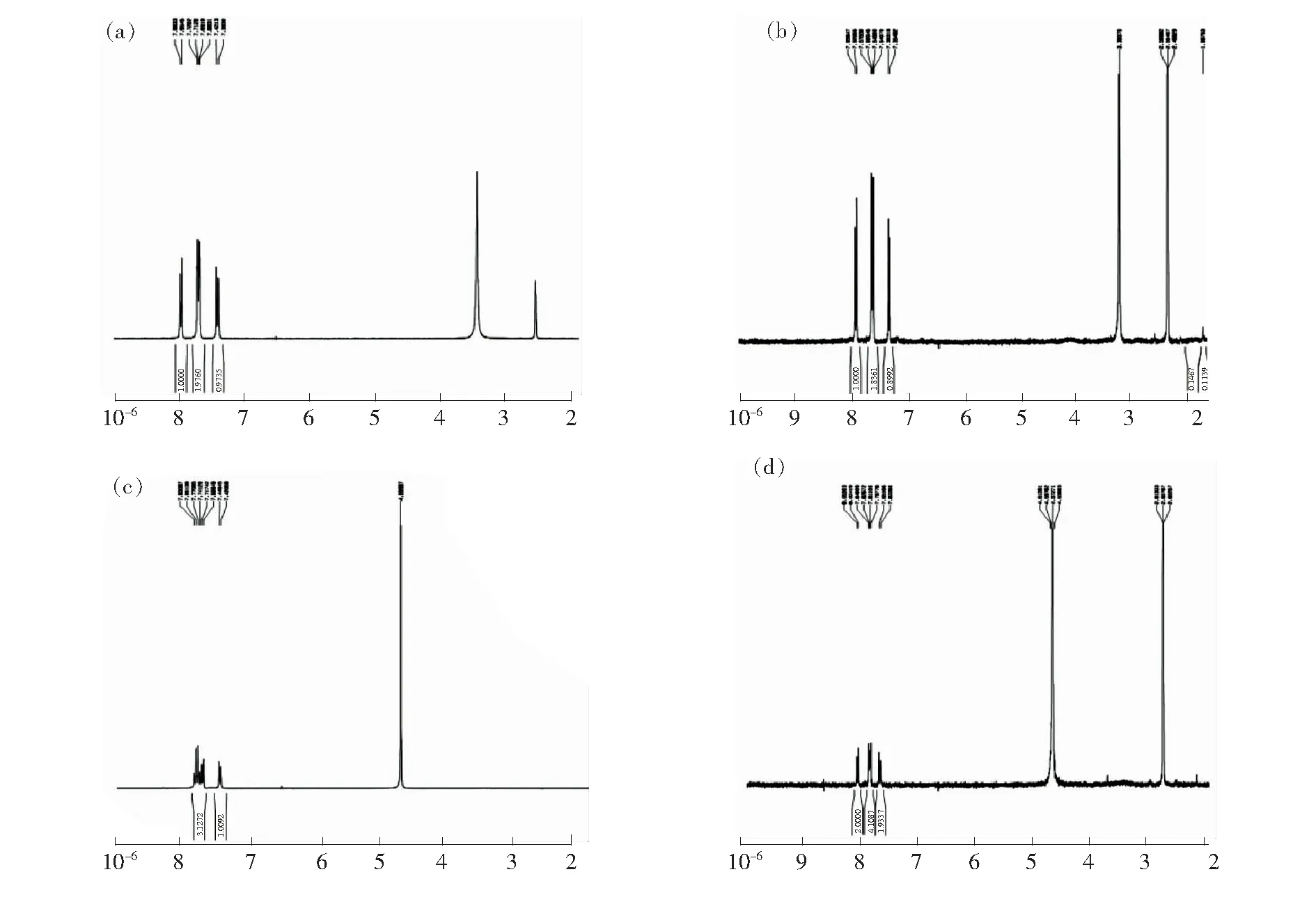
图8 柠檬黄与玉米醇溶蛋白结合前后的核磁共振氢谱。(a)柠檬黄,溶剂DMSO;(b)柠檬黄-玉米醇溶蛋白,溶剂DMSO;(c)柠檬黄,溶剂D2O;(d)柠檬黄-玉米醇溶蛋白,溶剂D2O。
Fig.8 Nuclear magnetic resonance (1H-NMR) spectra before and after the combination of tartrazine and zein. (a) Tartrazine, solvent DMSO. (b) Tartrazine-zein, solvent DMSO. (c) Tartrazine, solvent D2O. (d) Tartrazine-zein, solvent D2O.
3.5 柠檬黄与玉米蛋白相互作用力判断
通过Stern-Volmer方程定量描述荧光猝灭作用的机制[19],F0/F=1+KSV[Q]=1+kqτ0[Q],其中F0和F分别为无猝灭剂和有猝灭剂时玉米醇溶蛋白的荧光强度,[Q]为柠檬黄的浓度,KSV为动态猝灭常数,kq为双分子猝灭过程速率常数,τ0是无猝灭剂时玉米蛋白的荧光寿命,数值为10-8s。根据Stern-Volmer方程,猝灭剂浓度对荧光强度比拟合应得到直线方程,由于柠檬黄与玉米醇溶蛋白结合得到的曲线严重地向Y轴弯曲,产生荧光内滤效应,因此利用Fcorr=Fobs×e(Aex+Aem)/2对荧光强度进行修正[20]。根据不同温度下玉米醇溶蛋白荧光猝灭光谱,绘制F0/F-[Q]的关系图,进而求得猝灭常数KSV和速率常数kq,结果见表3。由表中的数据可知,柠檬黄与玉米醇溶蛋白结合的KSV随温度的升高先增大后减小,但kq均大于2.0×1010L·mol-1·s-1,荧光猝灭性质复杂。
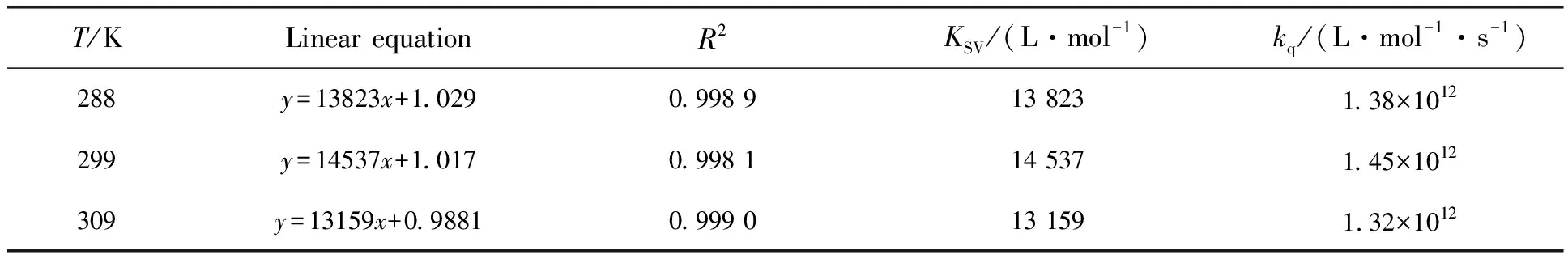
表3 在不同温度下玉米醇溶蛋白与柠檬黄结合的线性方程与猝灭常数
柠檬黄与玉米醇溶蛋白的结合常数和结合位点数可以通过lg[(F0-F)/F]=nlg[Q]+lgKa进行计算。lg[(F0-F)/F]与lg[Q]呈线性关系,通过线性拟合得到斜率和截距,进而可以求得在不同温度下柠檬黄与玉米醇溶蛋白的结合常数和结合位点数,结果见表4。从数据可以看到,柠檬黄与玉米醇溶蛋白的结合位点数约为1.0,结合常数随温度的升高而增大,具有动态猝灭的特征,结合红外光谱和核磁共振氢谱及Stern-Volmer方程计算结果,推断柠檬黄与玉米醇溶蛋白的结合符合静态与动态同时存在的混合猝灭机制[21],机制的存在形式与温度关系很大。在低温时Ka值为103,比高温104低一个数量级,说明柠檬黄与玉米醇溶蛋白的亲和力在低温时较弱。

表4 不同温度下柠檬黄与玉米醇溶蛋白的结合常数Ka和结合位点数n
柠檬黄与玉米醇溶蛋白的结合力可以通过Van’t Hoff 公式计算反应的焓变ΔH和熵变ΔS,根据符号进行作用力类型的判断[22]。当ΔH>0,ΔS>0时为疏水作用力;当ΔH<0,ΔS<0为氢键和范德华力;当ΔH<0,ΔS>0时为静电作用力。
lnK=-ΔH/RT+ ΔS/R,
(1)
ΔG=ΔH-TΔS=-RTlnK,
(2)
式中:R为气体摩尔常数,K为结合常数,计算结果列入表5。从表5可知,柠檬黄与玉米醇溶蛋白在3个不同的温度下,反应的ΔG均小于0,表明柠檬黄与玉米醇溶蛋白之间的结合是自发反应。ΔH>0,ΔS>0,说明柠檬黄与玉米蛋白之间主要是疏水作用力,与1H NMR观察到的强烈的芳环间π-π相互作用吻合。
表5 柠檬黄与玉米醇溶蛋白结合的热力学参数
Tab.5 Thermodynamic parameters for the binding of tartrazine to zein

T/KΔH/(kJ·mol-1)ΔS/(J·mol-1·K-1)ΔG/(kJ·mol-1)28875.7331.9-19.9299331.9-23.6309331.9-26.9
4 结 论
通过荧光光谱、紫外光谱、红外光谱及核磁共振氢谱对柠檬黄与玉米醇溶蛋白的结合特点进行了探讨。结果表明,柠檬黄与玉米醇溶蛋白的结合比较复杂,虽然物质间的结合是自发的,而且结合常数较大,但柠檬黄溶液本身是极性溶剂,在低极性的环境中,对玉米醇溶蛋白的构象有一定程度的影响,α螺旋结构的改变量很大,β转角的改变也非常突出,是静态与动态同时存在的混合猝灭机制,分子间主要以疏水作用力结合。当玉米醇溶蛋白溶于重水处于极性环境中时,加入柠檬黄,核磁共振氢谱中质子的化学位移改变很大,说明在极性环境下玉米醇溶蛋白疏水域暴露,与柠檬黄结合,其构象变化。作为理想载体应能够通过特定的途径将承载的外源物质转入既定目标,而且要有良好的物理化学稳定性,在传递过程中维持物质本性的存在,具有多孔网状结构,与承载物质没有明显的非特异性吸附。因此,玉米醇溶蛋白不是柠檬黄理想的搭载体,对于柠檬黄的输送与包埋都会产生不利影响。
