Mn2+对DNS法测定右旋糖酐发酵液中果糖含量的影响
2019-05-13问清江孙晓宇
慕 娟,问清江,孙晓宇,丁 浩
( 陕西省微生物研究所, 陕西 西安 710043)
右旋糖酐(Dextran)是一种由若干葡萄糖聚合而成的高分子聚合物,也称葡聚糖,是一种非常重要的多糖,可用于医药、食品、轻工等多领域,例如血浆代用品,乳化剂和增稠剂,高黏度胶水,炸药,钻井添加剂,土壤改良剂等[1~2]。目前右旋糖酐主要是微生物发酵生产,肠膜状明串珠菌(Leuconstoc mesenteriodes)以蔗糖为原料,产生右旋糖酐蔗糖酶(Dextransucrase, EC2.4.5.1),该酶以蔗糖为底物,切断D-葡萄糖基与果糖基的糖苷键,形成D-葡萄糖基与酶的复合物,释放出果糖,最后将葡糖糖基单元主要以α-1,6糖苷键连接形成右旋糖酐,产生果糖[3~6]。因此,右旋糖酐发酵液中的主要代谢产物有右旋糖酐、果糖和右旋糖酐蔗糖酶。在右旋糖酐发酵检测中,由于右旋糖酐是高黏度的多糖,必须通过乙醇沉淀,烘干得出其含量,而果糖是一种还原糖,易于检测,再者右旋糖酐蔗糖酶酶活检测也是通过酶作用所产生的果糖来衡量的,因此果糖作为右旋糖酐发酵的主要检测指标。3,5-二硝基水杨酸(DNS)分光光度法测定还原糖,操作简便快速、试剂消耗少、重现性好、准确度易达到检测要求,因此果糖的测定采用3,5-二硝基水杨酸试剂法(DNS)[7~8]。
在研究金属离子对右旋糖酐发酵影响中发现,按照常规DNS 测定还原糖法检测,Mn2+对发酵液中的果糖和右旋糖酐两种代谢产物的影响结果不同,前者随发酵液中Mn2+浓度的增加一直增加,而后者则相反,出现异常现象。随后在研究金属离子对右旋糖酐蔗糖酶作用的影响时,不同Mn2+浓度的酶反应体系作用结果检测时,偶然发现,对照管的光吸收值随Mn2+浓度的增加而增加,说明Mn2+也在检测过程中发生反应。本文主要通过Mn2+对右旋糖酐发酵过程中果糖和右旋糖酐蔗糖酶的检测的影响及Mn2+和DNS的定量发应等进行探索研究,改进DNS法测定右旋糖酐发酵液中果糖含量,为还原糖测定样品中含有氧化还原性其他物质时的检测提供参考,如果检测样品中含有待测还原糖外的其它具有还原性的物质时,在DNS测定还原糖时,一定要考虑其产生的氧化还原反应,消除其对检测结果的影响。
1 实验部分
1.1 试剂、材料与仪器
1.1.1 试剂与材料 果糖(D -(-)- fructose)(Sigma 公司);3,5-二硝基水杨酸(DNS)(化学纯,上海科丰化学试剂有限公司);苯酚(重蒸酚,北京鼎国生物技术有限责任公司);蔗糖、磷酸氢二钠、磷酸二氢钾、氢氧化钠、酒石酸钾钠、无水亚硫酸钠、氯化锰、乙酸钠、冰醋酸、(分析纯,广东光华科技股份有限公司);蛋白胨(北京奥博星生物技术有限责任公司);白砂糖(市售一级);菌株:Leuconstoc mesenteriodes -1226(Lm-1226)(中国药品生物制品检定所)。
1.1.2 仪器 722分光光度计(上海精密科学仪器有限公司);SPX-150BIII生化培养、GH-500型隔水式培养箱、101型电热鼓风干燥箱、HH-4A电热恒温水浴锅(北京科伟永兴仪器有限公司)。
1.1.3 DNS试剂 称取10.0 g DNS于600 mL蒸馏水中,逐渐加入10.0 g氢氧化钠,加热(50℃水浴)搅拌至溶解,依次加入200 g酒石酸钾钠,2.0 g苯酚和5.0 g无水亚硫酸钠,待全部溶解并澄清后,冷却至室温,用水定容至1 000 mL,过滤,贮存于棕色试剂瓶中,于暗处放置7 d后使用。
1.1.4 1 mg·mL-1果糖标准溶液 准确称取0.1000 g Sigma果糖(105 ℃干燥衡重),用蒸馏水溶解并定容至100 mL。
1.1.5 1 mg·mL-1Mn2+标准溶液 准确称取0.3076 g 分析纯硫酸锰(105 ℃干燥衡重),用蒸馏水溶解并定容至100 mL。
1.1.6培养基(g·L-1) 白砂糖120 g,蛋白胨 1.7 g ,磷酸氢二钠1.4 g,pH7.0。
1.2 实验方法
1.2.1 Lm-1226产右旋糖酐的发酵 以不同Mn2+将硫酸锰分别加入到培养基中,肠膜状明串珠菌Lm-1226种子液以10%的接种量接入到培养基中,25 ℃,静止培养28 h;取样检测果糖、右旋糖酐蔗糖酶,并将75%乙醇按135 mL·100 mL-1加入到发酵液中,充分搅拌均匀,放置,收集沉淀,沉淀用75%乙醇洗涤3次,烘干称重测出右旋糖酐量。
1.2.2 Mn2+对右旋糖酐蔗糖酶作用的影响 右旋糖酐发酵液进行一定的稀释,10 000 r·min-1离心15 min,收集上清液为提取液为右旋糖酐蔗糖酶酶液,在适当稀释的酶液中加入不同浓度的Mn2+,以蔗糖为底物,右旋糖酐蔗糖酶在Mn2+浓度不同反应体系中作用,测定酶活力,以确定Mn2+对右旋糖酐蔗糖酶作用的影响。
1.2.3 果糖、右旋糖酐蔗糖酶活力的测定
1.2.3.1 果糖标准曲线制作
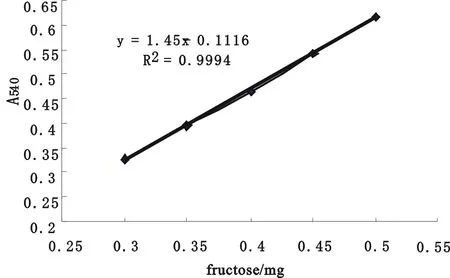
图1 果糖标准曲线
采用DNS法测定还原糖方法,分别量取0.3、0.35、0.4、0.45、0.5 mL果糖标准溶液(1 mg·mL-1),用蒸馏水补齐1 mL,再加入2 mL DNS,沸水浴2 min,流水冷却后加蒸馏水至10 mL,在540 nm测定光吸收值,绘制果糖标准曲线,得出回归方程用于果糖和酶活测定。
1.2.3.2 果糖测定 发酵液等样品稀释一定倍数,取样品1 mL加入2 mL DNS煮沸2 min显色,然后冷水浴冷却至室温,定容至10 mL;蒸馏水为对照,取蒸馏水1 mL ,其余同样品;540 nm测定吸光值,根据回归方程得出样品中的果糖含量果糖含量计算公式:
果糖(mg·mL-1)=[(Ae-A0) +0.1014]/1.302×Df
式中:Ae——样品的吸光值
A0—蒸馏水空白的吸光值
Df—样品的稀释倍数
1.2.3.3 改进的果糖测定
发酵液等样品稀释一定倍数,取样品1 mL加入2 mL DNS煮沸2 min显色,然后冷水浴冷却至室温,定容至10 mL;发酵液相对应的发酵培养基为对照,发酵培养基与相对应的发酵液稀释相同倍数,取样品1 mL ,其余同样发酵液样品;540 nm测定吸光值,根据回归方程得出发酵液样品中的果糖含量。
果糖含量计算公式:
果糖(mg·mL-1)=[(Ae-A0) +0.1014]/1.302×Df
式中:Ae——样品的吸光值
A0—培养基空白的吸光值
Df—样品的稀释倍数
1.2.3.4 右旋糖酐蔗糖酶活力测定
将酶液用pH5.4的0.2 M醋酸缓冲液适当稀释后,取0.5 mL的酶液加入到0.5 mL10%的蔗糖溶液中,30℃准确反应1 h,加入2 mLDNS终止反应,沸水浴2 min显色,然后流水冷却至室温,定容至10 mL;空白对照的酶液和DNS加入顺序颠倒,其余同样品测定。以蒸馏水为对照测定540 nm的吸光值,样品和空白对照的吸光值之差根据回归方程得出反应液中的果糖量,从而确定酶活。酶活力单位定义:在上述条件下,每分钟催化蔗糖产生1 μmol果糖所需要的酶量定义为1个酶活力单位(IU)。
酶活力计算公式:
E={[(Ae-A0) +0.1014]/1.302×Df×1 000}/(WM×t×V)
式中:E——样品酶活力(IU·mL-1)
Ae——酶液反应的吸光值
A0—灭活酶液空白的吸光值
Df—样品酶液的稀释倍数
WM——果糖分子量
t——酶反应时间(min)
V——发应的酶液体积(mL)
1.2.4 Mn2+与DNS试剂的作用 分别量取0.3、0.35、0.4、0.45、0.5 mL Mn2+标准溶液(1 mg·mL-1),用蒸馏水补齐1 mL,再加入2 mL DNS,沸水浴2 min,流水冷却后加蒸馏水至10 mL,在540 nm测定光吸收值。
2 结果与讨论
2.1 Mn2+对右旋糖酐发酵液中果糖检测的影响
DNS法测定样品中的还原糖一般是按照1.2.3.1和1.2.3.2的方法进行的,如此对含有不同Mn2+浓度的培养基经Lm-1226培养发酵后的右旋糖酐发酵液进行了果糖测定,同时用乙醇沉淀法提取了发酵液中的右旋糖酐进行了定量检测(见表1)。结果表明:果糖含量随Mn2+浓度的增加而增加,而右旋糖酐则相反。Leuconstoc mesenteriodes -1226发酵产右旋糖酐的机理是,蔗糖中的葡萄糖基以α-1,6糖苷键连接形成右旋糖酐,释放果糖,因此二者随Mn2+浓度变化的趋势应该一致,但结果出现异常,需要进一步研究。
2.2 Mn2+对右旋糖酐蔗糖酶活力检测的影响
右旋糖酐蔗糖酶在不同Mn2+浓度的发应体系中作用结果见表2,在1.25~7.5 mmol·L Mn2+浓度范围内,右旋糖酐蔗糖酶作用开始随着Mn2+浓度的增加而增强,5.0 mmol·L-1时作用最强,随后增强作用逐渐降低,说明Mn2+对右旋糖酐蔗糖酶具有较强地激活作用,最适Mn2+浓度为5.0 mmol·L-1。但是还可以看出,灭活酶液空白的吸光值A0随着Mn2+浓度的增加一直在增大,那么就有可能是Mn2+与DNS试剂发生反应而造成这一结果。2.1中果糖与右旋糖酐随Mn2+浓度变化而变化的异常现象也可能由于Mn2+与DNS试剂产生发应而影响了果糖的测定结果。
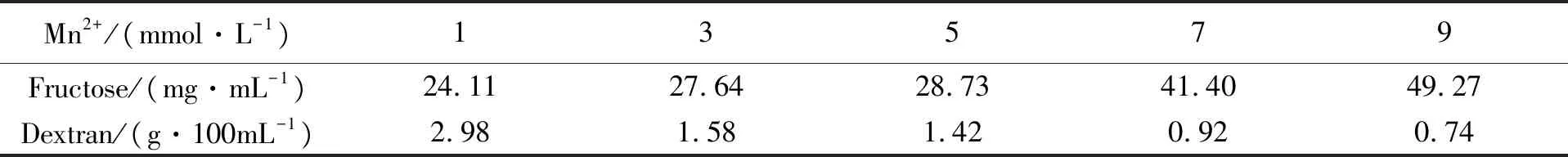
表1 Mn2+对右旋糖酐发酵液检测的影响

表2 Mn2+对右旋糖酐蔗糖酶活力检测的影响
注:检测样品稀释200倍。
2.3 Mn2+与DNS试剂的反应
按照DNS测定还原糖的方法对不同浓度的Mn2+进行反应并测定结果(见表3),随着Mn2+浓度的增加吸收值A540也在增加,和果糖与DNS发应的变化趋势一致,说明Mn2+的确与DNS发生发应。原因在于,Mn2+在碱性介质中很容易被氧化,DNS试剂,除了具有氧化性外,还含有氢氧化钠而呈碱性。虽然相同量相对应吸光值有差,Mn2+的均低于果糖,原因可能在于Mn2+的还原性弱于果糖或者与DNS的反应弱于果糖的反应。因此在使用DNS测定果糖等还原糖样品时,需要考虑其是否含有类似于Mn2+等的还原性其他物质存在,若有就必须改进方法消除影响。

表3 Mn2+、果糖与DNS试剂的反应
2.4 改进方法对右旋糖酐发酵液检测
从2.1中可看出Mn2+对Lm-1226发酵产右旋糖酐无促进作用,且随Mn2+的增加,抑制作用增强,因此将Mn2+浓度降低进行其对Lm-1226发酵产右旋糖酐影响实验,按照1.2.1、1.2.3.1、1.2.3.3及1.2.3.4对发酵液中的右旋糖酐、果糖和右旋糖酐蔗糖酶进行检测,Mn2+对Lm-1226发酵产右旋糖酐的影响见表4。果糖和右旋糖酐均随着培养基中Mn2+浓度的增加而降低,说明Mn2+对Lm-1226发酵产右旋糖酐具有抑制作用,且浓度越大抑制性越强。发酵液中右旋糖酐蔗糖酶的活力随Mn2+浓度的增加,开始上升,随后降低。考虑到Mn2+本身和DNS发生应,因此将未经Lm-1226培养基作为相应Mn2+浓度发酵液检测的空白对照,从而消除了Mn2+对果糖检测结果的影响,使得果糖和右旋糖酐的变化显示应有的一致性。但是从检测数据的绝对值来看,果糖和右旋糖酐的含量对应性存在问题。1 kg蔗糖完全被转化后产生0.526 kg果糖和0.474右旋糖酐,因此发酵液中果糖的含量应大于右旋糖酐。但是表4数据倒挂,果糖含量低于右旋糖酐,说明原因可能还在于果糖的检测。根本原因仍在于Mn2+的性质所致,在Mn2+的盐溶液中加碱时,可以析出胶状白色Mn(OH)2沉淀,在空气中不稳定,易被氧化成棕色的Mn(OH)4或MnO(OH)2。
MnSO4+ 2NaHO = Mn(OH)2↓ + Na2SO4
2Mn(OH)2+ O2= 2MnO(OH)2↓
DNS试剂含有氢氧化钠和氧化剂,Mn2+和DNS一定发生氧化还原反应,但是到底是什么样的反应,仅仅通过540 nm的光吸收值是难以清楚的,因此还需要进一步的工作,继续探索Mn2+对DNS测定还原糖的影响。
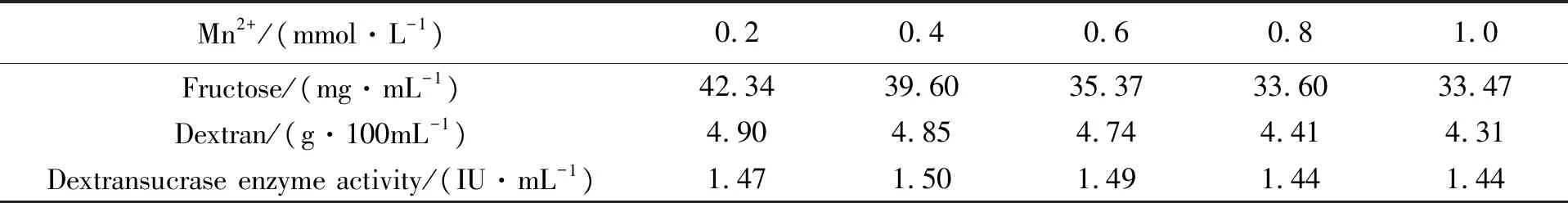
表4 Mn2+对Lm-1226发酵产右旋糖酐的影响液
3 结论
在Mn2+对肠膜状明串珠菌发酵产右旋糖酐的影响研究中出现的果糖和右旋糖酐两种代谢产物随Mn2+浓度变化的不一致性而发现问题;随后通过Mn2+对右旋糖酐蔗糖酶作用的影响研究中找处了DNS测定果糖是产生问题的原因;然后通过Mn2+与DNS的发应进一步证实,Mn2+本身的氧化还原型性导致其与DNS试剂产生反应,在测定果糖时要考虑到Mn2+对检测结果的影响;最后通过检测时以含有Mn2+的培养基作为相对应发酵液的空白对照,检测结果表明,克服了果糖和右旋糖酐两种代谢产物随Mn2+浓度变化的不一致性的问题,但是从Mn2m-1226发酵产右旋糖酐的转化机理的角度来看,检测结果中的果糖含量和右旋糖酐产出量出现了倒挂现象,说明仅仅通过改变检测空白来消除Mn2+对果糖检测的影响还远远不够,毕竟没有搞清楚在发酵液中的果糖与DNS发应的同时Mn2y与DNS到底发生了什么样的发应,还需要进一步的工作。总之,Mn2+对DNS法测定右旋糖酐发酵液中的果糖含量有影响,需要在利用DNS法测定样品中的还原糖时,一定要考虑是否含有具有氧化还原性的其他成分,若有就需要改进方法,消除其对检测结果的影响。
