扶脾化瘤饮诱导胃癌小鼠细胞凋亡和相关凋亡基因表达的机制研究*
2019-05-11范引科宋延平
杨 洁,范引科, 宋延平,李 晔
陕西省中医药研究院(西安 710003)
材料与方法
1 受试动物 KM小鼠,SPF级,雄性,18g~22g, 购自西安交通大学实验动物中心。实验动物质量许可证号:SCXK(陕)2012-003。
2 药物及瘤株 扶脾化瘤饮, 陕西省中医医院制剂中心,生产批号:20170608。小鼠胃癌(MFC)瘤株,购自第四军医大学实验动物中心。
3 试剂与仪器 实验试剂: 7-AAD(美国Sigma );AnnexinV-FITC 细胞凋亡检测试剂盒,小鼠免疫组化Bcl-2试剂盒,小鼠免疫组化Bax试剂盒(武汉博士德生物工程有限公司);胎牛血清(浙江天杭生物科技有限公司);RPMI1640细胞培养液 (Gibco公司); 胰蛋白酶(Amresco);实验仪器:超净工作台SW-CJ-IF(苏州净化设备有限公司);CO2恒温培养箱(美国SHELDON公司);恒温水浴箱(上海仪表厂);高速离心机(金坛市科技仪器有限公司);冰箱(海尔集团公司);显微镜(重庆光学仪器厂);细胞计数板(西安舟鼎国公司);流式细胞仪(美国BECKMAN公司生产,型号:Epcis XL)。
4 实验方法
4.1 胃癌(MFC)荷瘤小鼠动物模型的建立:细胞复苏、培养,将冻存的人胃癌MFC细胞放入35 ℃水浴内进行复苏。细胞复苏后,以2×106个/ml 密度接种于细胞培养瓶,加入含10%胎牛血清的RPMI1640 培养基,在37 ℃,5% CO2培养箱中培养。待长满细胞将培养瓶从CO2培养箱中取出,弃废液,加入PBS清洗杂质3次,用胰酶消化约20 s,显微镜下观察,待细胞变成透明圆状时,加入RPMI1640 培养液停止消化,并用巴氏吸管吹打细胞,然后将其转入离心管,置于离心机中离心3000 r/min,5 min,去除上清液收集细胞,备用。
取备用细胞,调整悬液浓度为1×107个/ml,以0.2 ml/只接种于小鼠右侧腋下,接种后观察接种部位是否出现肿瘤结节及结节是否进一步增大。
4.2 实验分组与给药:将成瘤的小鼠40只分为模型对照组、扶脾化瘤饮高剂量组、中剂量组及低剂量组,每组10只,接种次日开始给药,每天灌胃给药1次,连续给药14 d。扶脾化瘤饮高、中、低剂量组给药剂量分别为 6.0、3.0、1.5 g/kg,模型组给予等体积纯净水,自由饮食。实验前后每天观察小鼠的活动、精神、饮食等情况。
4.3 标本制备:停药次日称重后脱颈处死小鼠,分离出肿瘤组织,称重计算各组小鼠实体瘤抑制率,将部分组织制作细胞悬液用作流式检测外,其余部分保存于福尔马林中,制备石蜡切片。
5 观察指标
脱贫攻坚,资金是关键。赣州市财政部门紧扣脱贫攻坚任务,发挥政府投入主体和主导作用,为全市脱贫攻坚提供了有力的资金保障。
5.1 流式细胞检测细胞凋亡:将部分已剥离肿瘤组织,研磨过滤,用PBS清洗3次后离心重悬,制成瘤细胞悬液,调整细胞浓度为5×105个/ml ,加入Annexin V 结合液400 μl 重悬细胞; 加入AnnexinV-FITC 染色液,轻轻混匀后于4℃ 孵育15 min; 加入7-ADD染色液,混匀,于4 ℃ 孵育5 min。然后加入300 μl Binding Buffer,转入流式管用流式细胞仪进行分析。
5.2 免疫组化法检测Bcl-2、Bax的表达:将石蜡切片常规脱蜡后,内源性过氧化物酶50 μl,37 ℃,10 min;PBS洗3 min,3次;常规微波处理20 min;蒸馏水漂洗;PBS浸洗5 min,3次;正常动物血清50 μl,37 ℃,10 min;一抗50 μl,置湿盒,4 ℃过夜;次日湿盒移入37 ℃孵箱,1~1.5 h;PBS洗5 min,3次;二抗50 μl,37 ℃,30 min;PBS洗3 min,3次;链霉菌抗生物素蛋白-过氧化物酶50 μl,37 ℃,20 min;PBS洗5 min,3次;DAB显色液100 μl,光镜下观察,控制显色时间(3~8 min);流水充分洗涤,终止显色反应;Bcl-2、Bax作苏木素复染5 min左右;脱水、透明、封片。阳性对照:已知阳性切片。阴性对照:用PBS缓冲液代替一抗。
5.3 图像分析与指标评价:显微镜下观察照相,使用专业图像分析软件(BI-2000成都泰盟图像分析系统)进行图像的分析以及处理。根据分布范围的不同以及颜色的深浅来确定各目标的蛋白量。目标选定区的阳性细胞数目越多代表其阳性面积越大;染色颜色越深,阳性信号越强,其积分光密度(IOD )值越高,最后以IOD值进行统计分析。每张切片选取3个视野,取其平均积分光密度值。
6 统计学方法 采用SPSS 16.0软件处理数据,组间使用t检验,P<0.05表示差异有统计学意义。
结 果
1 扶脾化瘤饮对MFC胃癌小鼠瘤重的影响 见表1。与模型对照组比较,扶脾化瘤饮高剂量组的瘤重有明显降低(P<0.01),中剂量组的瘤重也有所降低(P<0.05),小剂量组的瘤重差异无统计学意义(P>0.05)。
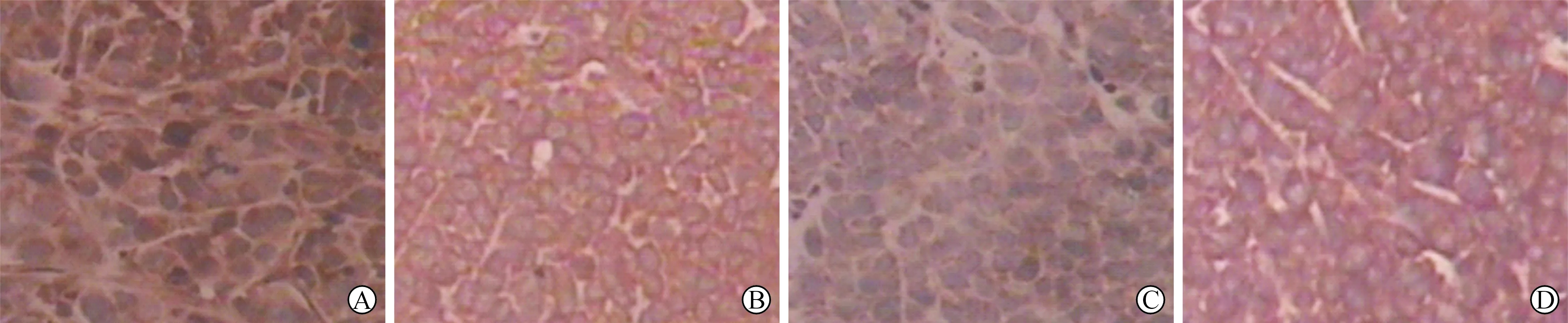
2 扶脾化瘤饮对MFC胃癌小鼠瘤细胞凋亡的影响 见表2。与模型对照组相比较,随着扶脾化瘤饮药物浓度的升高,小鼠细胞凋亡率显著增高,初步说明扶脾化瘤饮可能会诱导小鼠胃癌MFC细胞发生凋亡(图1)。
3 扶脾化瘤饮对MFC胃癌小鼠瘤细胞凋亡基因Bcl-2、Bax表达的影响 见表3。扶脾化瘤饮对Bax、Bcl-2表达的影响:与模型组相比,扶脾化瘤饮高剂量组、中剂量组Bcl-2表达均有显著下降(P<0.05),Bax表达有显著增高(P<0.01,P<0.05)。

表1 扶脾化瘤饮对荷人胃癌(MFC)小鼠 实体瘤的抑制作用
注:与模型组比较,△P<0.01,*P<0.05
4 免疫组化染色 Bcl-2、Bax蛋白阳性染色均位于细胞浆, 呈清晰棕黄色弥漫性分布(图2)。

表2 扶脾化瘤饮对胃癌小鼠(MFC)细胞凋亡的影响(%)
注:与模型组比较, △P<0.01,*P<0.05

A.模型对照组 B.扶脾化瘤饮低剂量组 C.扶脾化瘤饮中剂量组 D.扶脾化瘤饮高剂量组

图1 扶脾化瘤饮对MFC细胞凋亡的影响
注:与模型组比较,△P<0.01,*P<0.05
A. Bcl-2阳性表达高剂量组 B. Bax阳性表达高剂量组 C.Bcl-2阳性表达模型组 D. Bax阳性表达模型组
图2扶脾化瘤饮对凋亡基因Bcl-2、Bax表达的影响(免疫组化染色,×100)
讨 论
通常细胞凋亡有3条通路:死亡受体通路、内质网通路和线粒体通路。其中Bcl-2、Bax在细胞凋亡线粒体途径中均具有重要意义。Bcl-2家族是目前最受重视的与细胞凋亡关系密切的一类基因,同属该家族的抑制凋亡蛋白Bcl-2和促凋亡蛋白Bax可形成一个凋亡调节系统,Bcl-2通过与Bax竞争结合形成异源二聚体来抑制细胞凋亡,二者比例在一定程度上决定了细胞是否发生凋亡。Bax低表达和Bcl-2高表达均可使得Bcl-2/Bax 比值升高,细胞凋亡的敏感性降低,凋亡减少, 为肿瘤细胞的快速增长, 减慢细胞的丢失提供优势条件[3-4]。本实验发现,扶脾化瘤饮灌胃给药的MFC小鼠胃癌细胞中Bcl-2 蛋白表达减少,Bax蛋白增多,提示可能通过上调Bax下调Bcl-2 蛋白的表达,进而诱导胃癌细胞凋亡的发生。
细胞凋亡是多蛋白相互作用、多基因参与调控过程,目前研究发现参与调控肿瘤细胞凋亡基因主要有caspase家族、p53、Bcl-2家族等[5]。多种抗癌药物通过诱导肿瘤细胞发生凋亡,抑制瘤细胞的增殖作为治疗肿瘤的一种重要手段。扶脾化瘤饮可能是通过激活体内的多种细胞因子共同参与细胞凋亡过程,机体自身调节作用进而形成,最终引起靶细胞的凋亡。
通过大量临床观察总结,机体的正气不足伴随着肿瘤的发生、发展及预后的全过程,扶脾化瘤饮以益气扶正、化痰散结为法,最终达到治疗的目的。中医药是肿瘤治疗领域的一大特色[6-10],深入研究中药诱导肿瘤细胞凋亡的作用机制,有助于为中药抗肿瘤研究提供更客观、更科学的方法。随着社会经济、文化的发展,生活水平和生活质量的逐步提高,传统中医学的思考模式和治疗模式越来越注重心理因素和社会因素层面的考量,对生存的概念,随着医学模式及生物社会心理医学模式的发展和转变,除了进行手术、放疗、化疗等治疗方案以外,更强调提高患者术后及病情控制后的生存质量。这与中医学临床实践强调整体观念,注重人文关怀,注重患者主观满意度的倾向与现代医学的模式不谋而合,因此中药控制治疗癌症具有重要的研究意义。
