UBE2I 在KRAS 突变型结肠癌中表达及其对KRAS突变型结肠癌细胞增殖的影响
2019-05-10石婉婷邹荣军刘昭诗文加玲任江南赖人旭
石婉婷 邹荣军 刘昭诗 文加玲 任江南 赖人旭
1中山大学附属第五医院消化内科内镜中心(广东珠海519000);2中山大学附属孙逸仙纪念医院心血管外科(广州510120);3中山大学附属第六医院广东省胃肠疾病研究所(广州510655)
结肠癌是消化道最常见恶性肿瘤之一,是世界癌症死亡的第三大原因,即时诊断及术后转移率高达40%~50%[1]。而KRAS 是调控结肠癌细胞增殖及组织血管生成等过程的重要原癌基因[2]。正常的KRAS 基因参与肿瘤抑增殖、促凋亡等进程;一旦发生突变,则反向促进增殖、耐药及恶性侵袭等[2-3]。此外,KRAS 突变还是结肠癌患者化疗药物不敏感及预后不良的独立风险因素;特别是在外显子3、4 区域突变[3]。小泛素样修饰蛋白-E2 连接酶(small ubiquitin-like modifier E2 ligase,UBE2I)是机体重要的泛素化结合酶,具有结合三磷酸腺苷及发挥泛素化蛋白转移酶活力的功能,主要调控泛素依赖性蛋白分解代谢过程[4]。
最近的研究发现UBE2I 通过小泛素(small ubiquitin-like modifier,SUMO)化修饰运动蛋白Ⅱ相关蛋白(KAP1)可调控肿瘤细胞Ras 基因的驱动与转化,提示与肿瘤细胞的增殖侵袭密切相关[5]。在结肠癌研究领域,LIU 等[5]研究显示UBE2I 通过SUMO 化修饰转κB 及NFE2 转座子区调控元件,激活c-myc 表达而参与结肠癌肝转移及肿瘤耐药形成等调控。MOSCHOS 等[6]研究发现,UBE2I 在癌组织中的表达水平明显增高,SUMO 化修饰底物显著增加,且与结肠癌的Duke 分级正相关。然而,具体的调控机制尚未阐明。本研究拟观察UBE2I在KRAS 突变型结肠癌中的表达及对增殖克隆的影响,以期为KRAS 突变型结肠癌的治疗提供新的靶点。
1 材料与方法
1.1 主要材料 人结肠癌细胞株HCT116、DLD1、RKO、HCT8[广东省胃肠病研究所惠赠;突变分型参照通用软件度量国际联盟(COSMIC)标准(https://cancer.sanger.ac.uk/cosmic)[7];胎牛血清(Gibco 公司);RPMI 1640(Thermo 公司);TRIzol试剂(Life technologies 公司);质粒(Vigenebio 公司);RNA反转录试剂盒(TOYOBO 公司);GoTaq®q-PCR试剂盒(Promega 公司);一抗UBE2I、甘油醛-3-磷酸脱氢酶(GAPDH)兔抗人多克隆抗体(Abcam 公司);二抗羊抗兔多克隆抗体(碧云天公司);细胞计数试剂盒(CCK8)试剂盒(Sigma 公司);ABI PRISM 7500 PCR 仪(Applied Biosystems 公司);连续多功能酶标仪(Thermo 公司)。
1.2 一般资料 下载癌症基因组图谱(TCGA)数据库中标准化后的结肠癌样本表达谱及其对应的临床特征。该数据为结肠癌组织基于Illumina Hiseq 2000 RNA 测序平台分析的测序数据(https://xenabrowser.net/datapages/)[8]。去 除 未 明 确KRAS突变结果及测序数据与临床特征信息不匹配的样本后,最终,纳入86 例样本的癌组织及癌旁组织(距癌灶<2 cm 的邻近组织,病理证实无癌细胞)的测序表达值用于后续分析,其中KRAS 野生型37 例,KRAS 突变型49 例。
1.3 细胞培养 细胞株在37 ℃、5%CO2恒温孵箱中分别用含10%胎牛血清、1%青链霉素的RPMI 1640 完全培养液中培养。
1.4 细胞转染 基于短发夹RNA(shRNA)介导的方法沉默UBE2I,构建含pLent-U6-GFP-Puro 的UBE2I 沉默质粒(ShUBE2I)及空载质粒(ShNC)。通过嘌呤霉素进一步筛选转染稳定细胞,并通过实时荧光定量聚合酶链反应(Real time PCR,RTPCR)及Western Blot 在mRNA 及蛋白水平进一步验证沉默效率。
1.5 RT-PCR 提取细胞总RNA,参照RNA 反转录试剂盒的说明书进行反转录,依照GoTaq®q-PCR试剂盒的说明书在ABI PRISM 7500PCR 仪上进行Real-time PCR 扩增反应。反应条件如下:模板预变性95 ℃(20 s);PCR 反应95 ℃(5 s)、60 ℃(20 s)共40 个 循 环,以2-ΔΔCt法计算UBE2I 的 相对表达量。引物由生工生物(上海)股份有限公司合成。UBE2I 上游引物:5′-AGGCCAGCCATCACAATCAA-3′,下游引物:5′-TGTGCTCGGACCCTTTTCTC-3′。GAPDH 上游引物:5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物:5′-TGGTGAAGACGCCAGTGGA-3′。
1.6 Western Blot 收集细胞,裂解后离心,收集上清,15%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDSPAGE)电泳分离,转移至硝酸纤维素(NC)膜,加入一抗(UBE2I 抗体1∶1 000;GAPDH 抗体1∶3 000),4 ℃过夜,加入二抗,37 ℃缓摇2 h,增强型化学发光剂(ECL)显色成像。
1.7 CCK8及克隆平板实验 取对数生长期细胞,以未处理组为对照组,以2.5 × 103个/孔的浓度接种至96 孔板,分别取第1、2、3、4、5 天换液,每孔加10 μL CCK8 试剂,孵育2 h 后,用酶标仪测波长450 nm 处的光密度(OD450)值,作为细胞活力。同样地,将对数生长期的细胞以500 个/孔的浓度接种至4 孔板,37 ℃、5% CO2条件下培养10 d,待出现肉眼可见的克隆时,甲醇固定,0.005%结晶紫染色20 min,磷酸盐缓冲液清洗2~3 遍,显微镜下计数直径超过150 mm 的克隆群落。
1.8 统计学方法 采用SPSS 20.0 统计软件进行分析。细胞实验结果均进行3 次重复,数据采用均数±标准差表示。组间和组内数据比较采用t检验或方差分析;基因表达水平(高/低)与临床特征关联比较采用χ2检验或Fisher 精确概率检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 UBE2I 在KRAS 突变型结肠癌组织中的表达 UBE2I在KRAS突变型癌组织、KRAS突变型癌旁组织和KRAS 野生型癌组织在TCGA 中表达量分别为(11.47±0.24)、(10.76±0.15)、(10.50±0.05)。3者比较,差异有统计学意义(F=93.95,P<0.01);其中,与KRAS 突变型癌组织比较,KRAS 突变型癌旁组织和KRAS 野生型癌组织的UBE2I 表达量明显下调(均P<0.01)。细胞系RT-PCR 结果显示,KRAS 野生型HCT8 细胞、RKO 细胞和突变型HCT116 细胞、DLD1 细胞的UBE21 mRNA 表达量分别为(1.02±0.10)、(1.24±0.13)、(2.34±0.19)、(1.94 ± 0.20);4 者比较,差异有统计学意义(F=43.66,P<0.01);其中,与KRAS 野生型HCT8 细胞比较,突变型HCT116 和DLD1 的UBE21 mRNA 表达量均明显上调(P<0.01),而KRAS 野生型癌细胞RKO 细胞中的UBE21 mRNA 表达量差异无统计学意义(P=0.13,图1)。
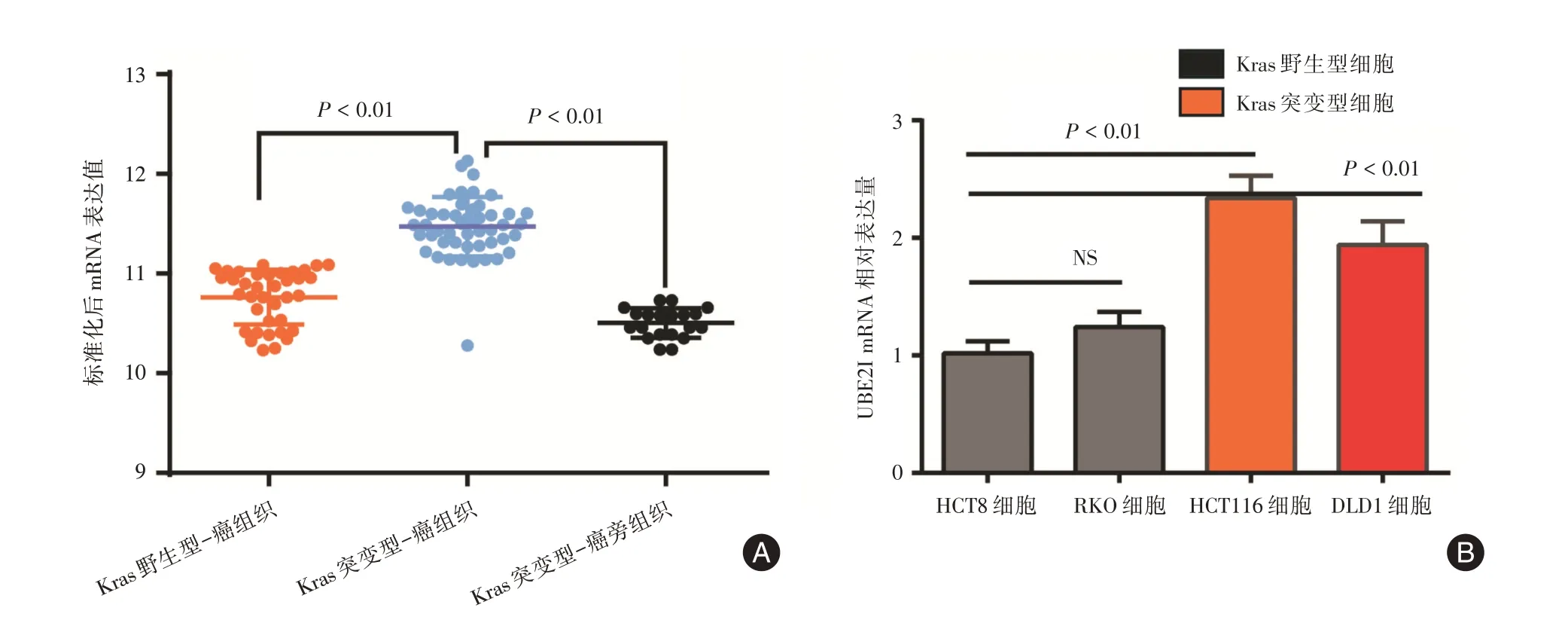
图1 UBE2I 在KRAS 突变型及野生型结肠癌组织及细胞中表达Fig.1 The expression level of UBE2I in KRAS mutant and wild-type colorectal cancer
2.2 KRAS 突变型结肠癌中UBE2I 表达水平与临床病理特征关联意义 以UBE2I 在所有KRAS 突变型样本的表达值中位数为标准分成高低表达两组。统计发现UBE2I 高表达与KRAS 突变型结肠癌的病理分级及临床分期密切相关(P<0.01;P=0.02),而与年龄、性别、淋巴转移及远处转移等特征差异无统计学意义。见表1。
2.3 构建shUBE2I 的KRAS 突变型结肠癌细胞对HCT116 及DLD1 两株细胞转染shUBE2I 及shNC空载质粒后,观察细胞荧光细胞占比(图2A),利用RT-PCR 和Western Blot 检测mRNA 及蛋白的表达变化。mRNA 及蛋白结果均显示,3 者差异有统计学意义(P<0.01)。其中,与空白对照组比较,HCT116 及DLD1 细胞系shNC 组mRNA 相对表达水平差异无统计学意义(均P>0.05);而shUBE2I组mRNA 相对表达水平均明显下调(P<0.01)。Western Blot 水平,相对于空白对照组,shNC 组蛋白表达量差异无统计学意义(均P>0.05),而shUBE2I组蛋白表达水平明显下调(P<0.01,图2)。
2.4 CCK8 及克隆平板实验 CCK8 增殖实验显示,HCT116 细胞OD450值在组间处理和培养时间的交互效应上差异有统计学意义(F= 35.39,P<0.01);其中,与同时间点NC 组比较,shUBE2I 组在培养72、96、120 h 后对应的细胞活性OD450值均明显降低(P<0.01)。同样地,DLD1 细胞OD450值在组间处理和培养时间的交互效应上差异有统计学意义(F=34.58,P<0.01);其中,与同时间点NC 组比较,shUBE2I 组在培养72、96、120 h 后对应的细胞活性OD450值均明显降低(P<0.01)。克隆形成实验显示,在HCT116 细胞中shUBE2I 组、shNC组及NC 组克隆形成数目分别为(24.67 ± 1.53)、(41.00±2.01)、(46.33±6.50);3 者比较,差异有统计学意义(F= 23.57,P<0.01);其中,shUBE2I 组克隆球形成数目明显低于shNC 组和NC 组(均P<0.01)。在DLD1 细胞株中,3 组克隆球数目分别为(25.67±3.05)、(50.01±3.01)、(56.67±4.51);3 者比较,差异有统计学意义(F= 61.97,P<0.01);其中,shUBE2I 组克隆球形成数目明显低于shNC 组和NC 组(均P<0.01,图3)。
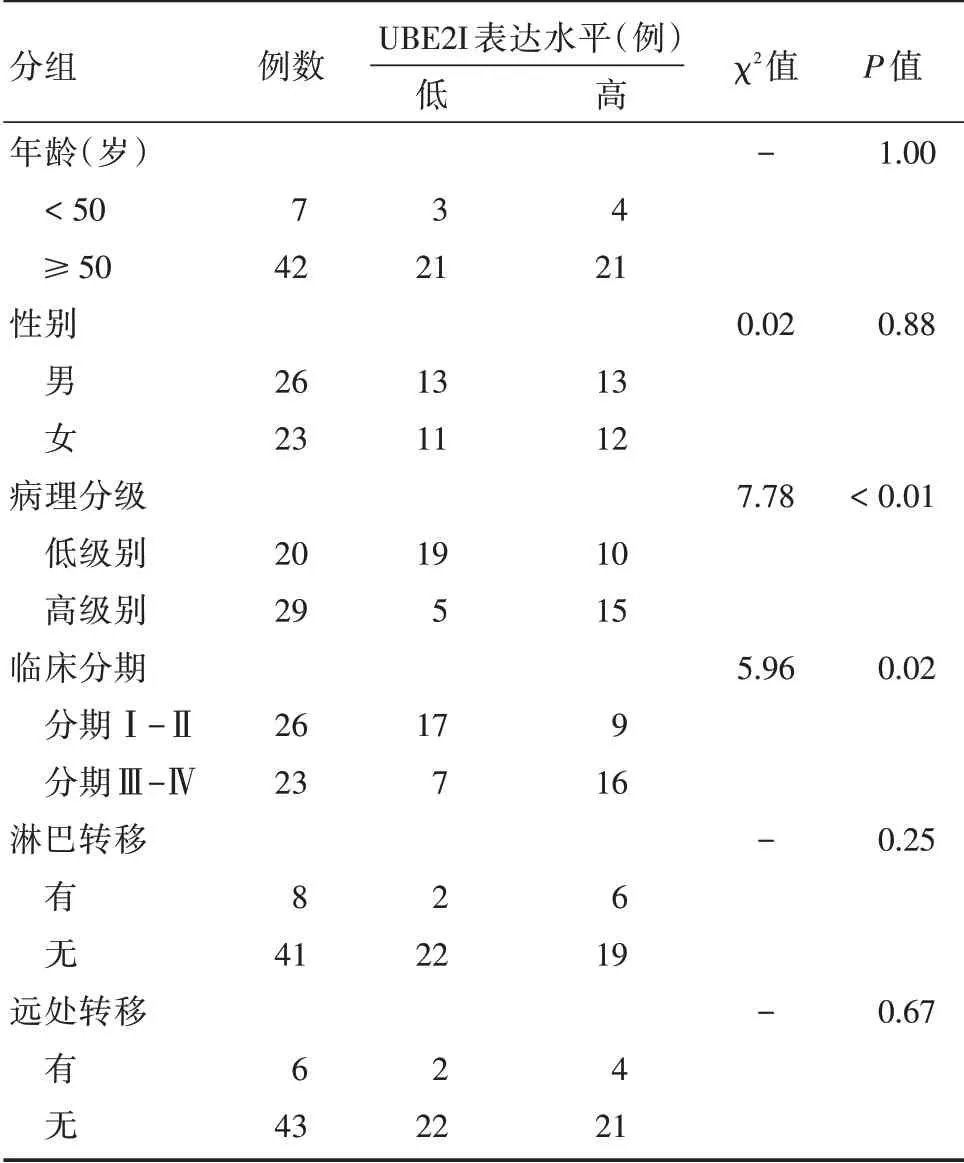
表1 UBE2I 表达水平与KRAS 突变型结肠癌病理特征之间的关联Tab.1 The relationship between UBE2I expression level and clinical characteristics of KRAS mutant colorectal cancer
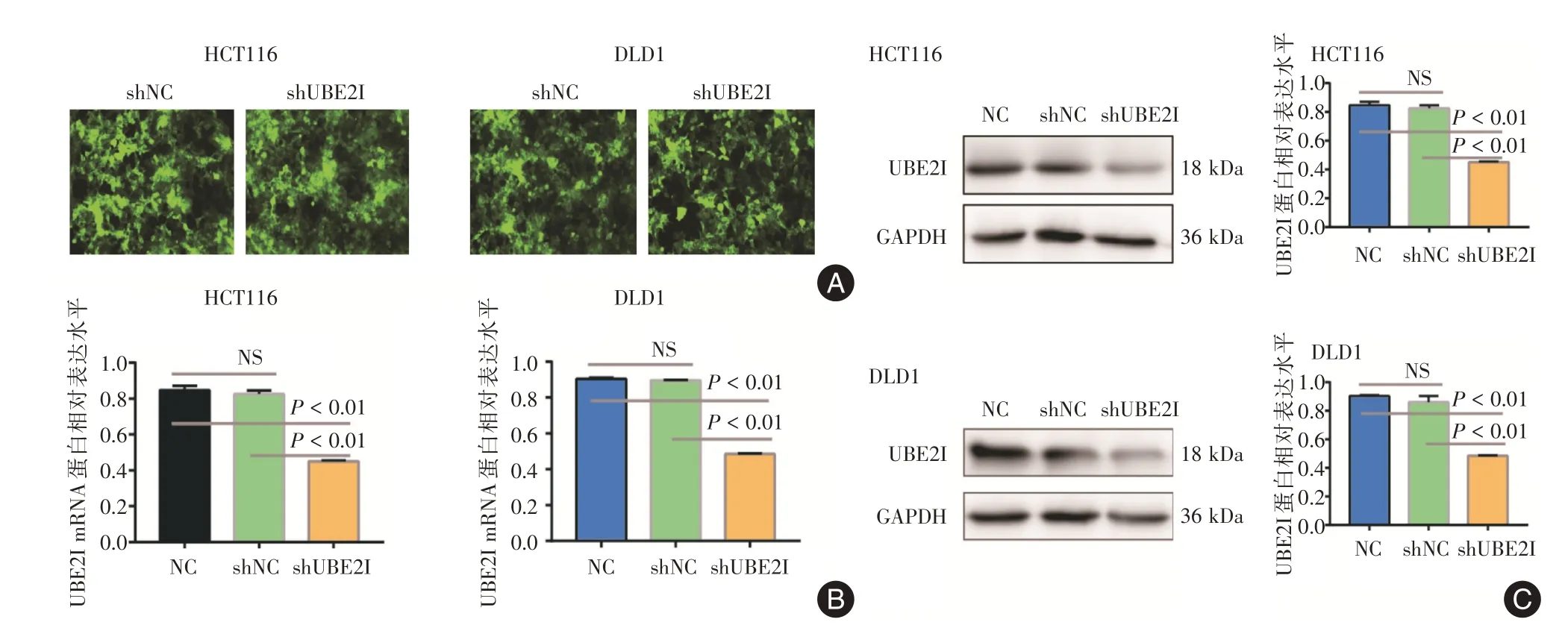
图2 构建shUBE2I 的KRAS 突变型结肠癌细胞及UBE2I 基因表达验证Fig.2 The construction and validation of shRNA-mediated UBE2I gene silencing
3 讨论
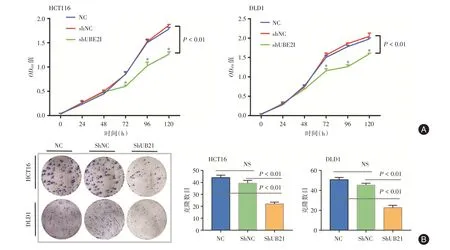
图3 肿瘤细胞的平板克隆及CCK8 增殖实验Fig.3 The clone formation and CCK8 proliferation experiments of KRAS mutant colorectal cancer cell
KRAS 突变型肿瘤细胞通过灭活表面受体及促进药物外排等分子机制,可对抗靶向表皮生长因子受体(EGFR)的药物反应,导致不同的代谢特征和治疗敏感性,并参与肿瘤恶性进展调控[4]。其中,KRAS 基因的突变与活化是参与恶性转变及耐药形成的重要的调控节点。质谱定量实验发现,KRAS 突变的肿瘤细胞中蛋白质SUMO 水平明显增高,KRAS 驱动及转化也依赖与SUMO 样修饰途径[4,9],提示SUMO 化与KRAS 相关信号的交互及调控是分子通路及药物研究的重要机制。
UBE2I 是SUMO 化修饰过程中介导“共轭结合”的重要限速蛋白,在三维空间上具有“催化袋”样结构,能够与底物中一系列特殊基团(如疏水残基、赖氨酸、间隔子区域及酸性残基)形成互补的拓扑结构,是药物研发的理想结构[10-11]。目前研究提示,UBE2I 在肺腺癌、卵巢癌、黑色素瘤等肿瘤中均显著高表达,且与肿瘤大小、药物敏感性及患者预后等密切相关[11-12]。肿瘤恶性进展中,UBE2I可能与ERK1/2 和p38 的激活调控、与内在凋亡途径交互作用及抑制免疫细胞浸润等有关[13]。UBE2I 可能还参与了RAS 基因的转录与表达,与乳腺癌多重药物耐药性形成有关[4,14];干扰敲除UBE2I 可明显增加肿瘤细胞对化疗药物的敏感性[14]。在结肠癌研究中,仅提示UBE2I 在癌组织中呈高表达差异,并与肿瘤肝转移相关,而未阐明具体的分子调控通路。虽然既往研究揭示了UBE2I对KRAS 基因驱动与转化的潜在调控线索,但其对KRAS突变型结肠的具体调控机制未展开研究。
本研究结果提示:(1)相对于KRAS 野生型细胞及组织,UBE2I 在KRAS 突变型结肠癌中的表达水平明显增高;(2)在KRAS 突变型结肠癌中UBE2I 高表达与肿瘤病理分级及临床分期相关;(3)沉默KRAS 突变型结肠癌中UBE2I 表达可显著降低肿瘤细胞的增殖及克隆能力。与既往研究相比,本研究首次探讨了UBE2I 在KRAS 突变型结肠癌中的调控作用。一方面揭示了结肠癌组织中UBE2I 的差异表达水平及临床意义;另一方面进一步阐述了其与KRAS 突变型结肠癌细胞增殖及克隆形成之间的交互关系,为KRAS 突变型结肠癌的分子机制及新药研发提供潜在靶点。从国内外研究来看,SUMO 化修饰与KRAS 突变之间的交互调控、结肠癌耐药形成及结肠癌转移等过程可能还与癌组织免疫微环境的构建有关[5-6,13,15]。因此,在以后的研究中,课题组将围绕UBE2I 与KRAS 突变具体的调控通路及潜在的免疫调控网络展开深入探索,从而明确UBE2I 在KRAS 突变型结肠癌中的具体调控作用,从而为此类“顽固性”结肠癌提供相应的指导策略。
