晚期内皮祖细胞条件培养液对阿霉素诱导的心肌细胞凋亡的影响
2019-05-10唐艳邓苏辛
唐艳 邓苏辛
1南华大学附属第一医院心血管内科(湖南衡阳421001);2衡阳市中心医院心血管内科(湖南衡阳421001)
阿霉素(adriamycin,ADR)是常见的抗肿瘤因子,因其心脏毒副作用,所以临床应用受到限制,而在其过程中心肌细胞(cardiomyocytes,CMs)凋亡为最主要的机制[1]。
各种干细胞条件培养液被开始应用于心血管疾病并取得了很好的结果[2]。而在众多干细胞中,内皮祖细胞(endothelial progenitor cells,EPCs)是一群能增殖、分化,暂未表达成熟血管内皮细胞的特征性表型及形成血管的幼稚内皮细胞,有促进血管新生和旁分泌功能,根据在培养过程中出现的时间分为早期和晚期EPCs,研究发现晚期EPCs 具有更强的旁分泌功能[3]。EPCs 因其取材方便,应用价值大,近年来受到关注,然而关于晚期EPCs 与ADR 引起的CMs 凋亡之间的研究甚少,因此,本研究原代培养乳鼠CMs,建立ADR 诱导的CMs 凋亡模型,同时制备晚期内皮祖细胞条件培养液(endothelial progenitor cells conditioned medium,EPCs-CM),观察晚期EPCs-CM 对ADR 诱导的CMs 凋亡的影响,并初步探讨其机制。
1 材料与方法
1.1 主要试剂及仪器 新生小牛血清,DMEM 培养基(美国Gibco 公司),Ⅱ型胶原酶,EDTA 胰酶(美国Sigma 公司),CD31 相关抗原抗体(北京博鳌生物技术公司),Ⅷ因子相关抗原抗体(Solarbio,北京),鼠抗cTnI 多克隆抗体,兔抗TGF-β1 单克隆抗体(北京中杉金桥),RT-PCR 试剂盒(美国Fermentas 公 司),Hoechst33342/PI,AnnexinV-FITC/PI 及MTT 试剂盒(凯基生物),TRIzol Reagent(美国Invitrogen 公司),盐酸阿霉素注射液(山西普德药业),倒置显微镜(日本Olympus 公司),电泳仪及垂直板蛋白电泳装置(美国Bio-rad 公司)。
1.2 研究对象 1~3 d SD 乳鼠,体质量7~11 g,雌雄不限;8~12 周健康雄性SD 大鼠,体质量170~240 g,由南华大学医学院实验动物中心提供。
1.3 EPCs 分离、培养及鉴定 颈椎脱臼法处死大鼠,无菌取出股、胫骨,冲洗骨髓腔,离心收集细胞,DMEM 培养基(含10%新生小牛血清)反复吹打制成细胞悬液,放置在37 ℃、5% CO2孵箱中培养。2 d 后全量换液,离心,上悬液接种于人纤维粘连蛋白预包被的6 孔细胞培养板中,继续培养,每隔2 d 换液,传代培养至28 d,免疫荧光显微镜检测EPCs 表面标志CD31、Ⅷ因子的表达进行鉴定。
1.4 晚期EPCs-CM 制备 培养28 d 收集晚期EPCs 的上清液,以2 000 r/min 离心10 min 离心弃细胞碎片,于-20 ℃保存。
1.5 CMs 原代培养 无菌取出乳鼠心脏,剪碎,加入0.1%胰酶及0.1%Ⅱ型胶原酶联合反复消化,细胞悬液先用200 目筛网过滤,离心收集CMs,培养基(含20%新生小牛血清)反复吹打制成细胞悬液,差速贴壁1 h 分离并弃成纤维细胞,以获得较纯的CMs,放置在37 ℃、5% CO2孵箱中培养。鼠抗心肌肌钙蛋白Ⅰ(cTnI)多克隆抗体,鉴定CMs。
1.6 实验分组与干预 分为对照组,模型组及实验组;对照组为原代培养CMs 108 h;模型组为原代培养CMs 48 h 后,无血清培养基培养12 h,后换等量的含ADR(5 μg/mL)的DMEM 培养基,继续培养48 h;实验组为原代培养CMs 48 h 后,无血清培养基培养12 h,后换等量的含ADR(5 μg/mL)的DMEM 培养基及晚期EPCs-CM,培养4、24、48 h 分别用MTT 法检测各组CMs 存活率,48 h 后3 组均检测CMs 凋亡率,测定BNP 和TGF-β1 的mRNA 及蛋白的表达。
1.7 MTT 法 将各组CMs 以1 × 104个细胞接种至96 孔培养板中,每组设置6 个复孔,每孔加入50 μL 1×MTT,继续37 ℃孵育4 h 后吸出上清液,再加入150 μL DMSO,低速摇匀,酶标仪在550 nm波长处检测每组的光密度(OD),将各测试孔的OD值减去调零孔OD值(调零孔是完全培养基加MTT),复孔的OD值取均数±标准差,细胞存活率(%)=(实验组细胞OD/正常组细胞OD-1)×100%,以作用时间为横坐标,细胞存活率为纵坐标绘制细胞存活率曲线。
1.8 Hoechst33342/PI 法 取各组CMs 消化收集后,将105~106个细胞悬浮于1 mL 培养基中,加入Hoechst 33342 染液10 μL,混匀,37 ℃孵育10 min,于4 ℃,1 000 r/min 离心5 min弃上清液,再加入1 mL 1 × Buffer A 工作液悬浮细胞,后再加入PI 染液5 μL,室温,避光,反应10 min 后,荧光显微镜下观察并计数正常细胞和凋亡细胞,凋亡指数=凋亡细胞/总细胞数×100%。
1.9 AnnexinV-FITC/PI 法 取各组CMs 用不含EDTA 的胰酶消 化 收 集,用PBS 洗涤2 次,2 000 r/min 离心5 min 收集1~5 × 105的CMs,用Binding Buffer 500 μL 悬浮细胞,向其加入Annexin V-FITC液5 μL,混匀,后再加入PI 染液5 μL,室温、避光、反应10 min;1 h 内,用流式细胞仪以激发波长为488 nm,发射波长为530 nm 进行观察,计算CMs凋亡指数。
1.10 qRT-PCR 法 各组CMs 按产品说明书用Trizol Reagent 裂解,抽取总RNA,逆转录反应合成cDNA,条件为65 ℃5 min,25 ℃5 min,42 ℃60 min,70 ℃5 min,保存于-70 ℃。以20 μL 的反应体系进行PCR,取2 μL 的逆转录反应产物分别与BNP,TGF-β1 及内参GAPDH 引物进行反应;BNP引物序列:上游:5′-TGATTCTGCTCCTGCTTTTC-3′;下游:5′-GTGGATTGTTCTGGAGACTG-3′;TGFβ1:上游:5′-GGACTACTACGCCAAAGAAG-3′;下游:5′-TCAAAAGACAGCCACTCAGG-3′;GAPDH:上游:5′-GCCTTCTCCATGGTGGTGAA-3′;下游:5′-GGTCGGTGTGAACGGATTTG-3′;反应条件:BNP:95 ℃预变性1 min,95 ℃变性15 s,58 ℃退火30 s,72 ℃延伸30 s,45 个循环;产物140 bp;TGF-β1:预95 ℃变性1 min,95 ℃变性15 s,52 ℃退火30 s,72 ℃延伸30 s,45 个循环。产物280 bp;GAPDH:94 ℃预变性3 min,94℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35 个循环,最后再72 ℃延伸7 min。产物251 bp。取10 μL PCR 产物,进行2%琼脂糖凝胶电泳,成像系统拍照,目的产物的相对表达量为目的产物/GAPDH 产物电泳条带密度的比值,引物由上海捷瑞公司提供,数据采用2-△△Ct法分析。
1.11 Western Blot检测 各组CMs按总蛋白提取试剂盒说明书进行,用细胞刮收集,4℃,12 000 r/min离心10 min 获得总蛋白,取10 μL 蛋白溶液在聚丙烯酰胺凝胶上进行电泳,先恒压电泳80 V,待溴芬蓝条带前端进入分离胶约10 min 后,将电压调至120 V,继续恒压电泳,当条带前端跑至分离胶底部,停止电泳,以0.8~3.0 mA/cm2恒流转膜1~2 h,将NC 膜取出后放入5%脱脂奶粉/TBS-T 液中4 ℃封闭1 h,再放入一抗(兔抗BNP 多克隆抗体1∶500,兔抗TGF-β1 单克隆抗体1∶500,1∶1 000 鼠抗β-actin多克隆抗体)中,孵育4 ℃过夜,再用TBS-T液洗膜共3 次,每次5 min,再放入辣根过氧化物酶标记的羊抗兔,羊抗鼠二抗(1∶5 000)中,4℃孵育4 h,后用TBST 液洗膜共3 次,每次10 min;ECL 发光试剂盒显色,显影,用图像处理系统拍照并分析。目的蛋白相对表达值为目的蛋白/内参蛋白(β-actin)的灰度值比值。
1.12 统计学方法 应用SPSS 17.0 统计软件进行分析,数据以均值±标准差表示,经正态性检验和方差齐性检验,多组间比较采用ANOVA 检验,组间两两比较采用q检验;P<0.05 为差异有统计学意义。
2 结果
2.1 EPCs 的培养与鉴定 培养2 d后大部分EPCs贴壁,呈圆形,体积较小;第4~7 天,细胞体积增大,呈梭形,形成集落,第8~10 天贴壁细胞逐渐增多,呈微血管样生长。第28 天,呈现“铺石路”样的晚期EPCs(图1)。免疫荧光显示:EPCs特征性标志物CD31、VIII 阳性细胞率高,约90%(图2)。
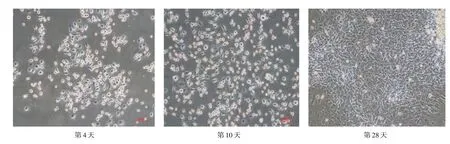
图1 培养的EPCs 形态学变化(×100)Fig.1 Morphological changes of the cultured endothelial progenitor cells(×100)

图2 EPCs 特征性标志物CD31 及VIII 因子的免疫荧光鉴定(×100)Fig.2 Immunofluorescence identification of characteristic marker CD31 and VIII factor of endothelial progenitor cells
2.2 CMs 的培养与鉴定 培养第1 天后见大部分CMs 呈梭形生长,集落样分布,可见非同步性搏动。第3 天CMs 搏动较前明显有力,呈同步性搏动,频率60~170 次/min(图3)。免疫荧光结果:CMs 的特征性标志物cTnI 阳性细胞率高,80%以上(图4)。
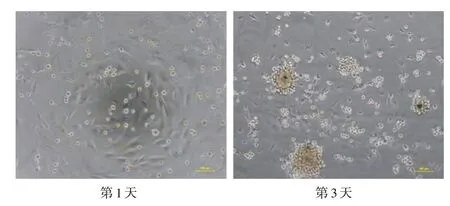
图3 原代培养乳鼠CMs 形态学变化(×100)Fig.3 Morphological changes of the primary cultured neonatal rat cardiomyocytes
2.3 晚期EPCs-CM 对ADR 诱导的CMs 存活率及凋亡率的影响 MTT 检测CMs 存活率:同一作用时间,与对照组相比,模型组的CMs 存活率较对照组降低,实验组的存活率较模型组明显升高,差异均具有统计学意义(P<0.05),同一组不同作用时间相比,4 、24 及48 h 的CMs 存活率差异具有统计学意义,存活率随着作用时间的延长逐渐降低,其中作用48 h差异最明显(P<0.05)。因而选择作用48 h 为最佳观察点,观察后续CMs 凋亡及相关基因蛋白的检测(图5)。
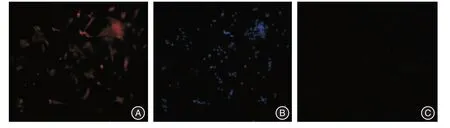
图4 CMs 特征性标志物cTnI 的免疫荧光鉴定(×100)Fig.4 Immunofluorescence identification of characteristic marker cTnI of cardiomyocytes

图5 MTT 法检测各组CMs 存活率Fig.5 Detection of cardiomyocytes survival rate in each group by MTT
AnnexinV-FITC/PI 法检测结果:对照组、模型组及实验组凋亡指数分别为:(7.22 ± 0.21)%、(59.33±0.83)%、(15.19±0.92)%;与对照组相比,模型组的CMs 的凋亡指数显著增加,差异有统计学意义(P<0.05);与模型组相比,实验组的凋亡指数显著降低,差异有统计学意义(P<0.05,图6)。
Hoechst33342/PI 法检测结果:对照组、模型组及实验组的CMs凋亡指数分别为:(7.21±0.15)%、(58.83±0.74)%、(15.77±0.18)%。与对照组相比,模型组的CMs 的凋亡指数明显增加,差异有统计学意义(P<0.05)。与模型组相比,实验组的凋亡指数明显降低,差异有统计学意义(P<0.05,图7)。

图6 AnnexinV-FITC/PI 双染法检测各组CMs 凋亡率Fig.6 Detection of cardiomyocytes apoptosis rate in each group by AnnexinV-FITC/PI double staining
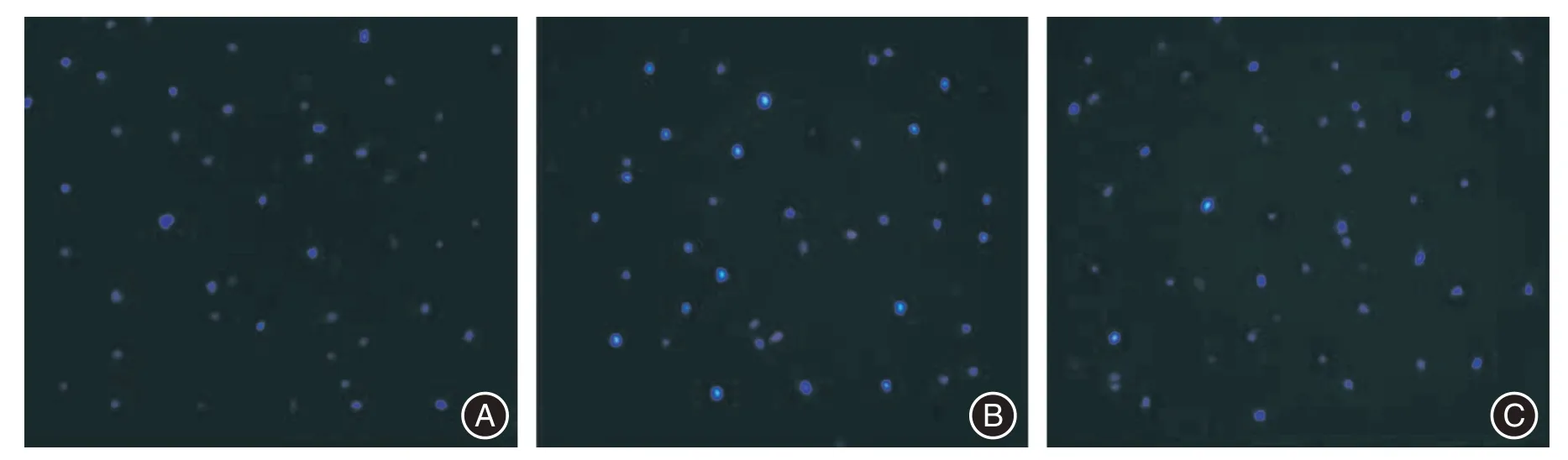
图7 Hoechst33342/PI 双染法检测各组CMs 凋亡率(×400)Fig.7 Detection of cardiomyocytes apoptosis rate in each group by Hoechst33342/PI double staining
2.4 各组CMs 的BNP 和TGF-β1mRNA 的相对表达量 2-△△Ct计算结果显示,同对照组相比,模型组的CMs 的BNP mRNA 相对表达量是对照组的0.32 倍,差异有统计学意义(P<0.05);同模型组相比,实验组的BNP mRNA 相对表达量为模型组的0.68 倍,差异有统计学意义(P<0.05)。同对照组相比,模型组的CMs 的TGF-β1 mRNA 相对表达量是对照组的3.6 倍,差异有统计学意义(P<0.05);同模型组相比,实验组的TGF-β1 mRNA 相对表达量为模型组的0.54 倍,差异有统计学意义(P<0.05,图8)。

图8 各组CMs 的BNP 及TGF-β1 mRNA 的相对表达量Fig.8 Relative expression of BNP and TGF-β1 mRNA in the cardiomyocytes of each group
2.5 各组CMs 的BNP 和TGF-β1 蛋白的相对表达量 同对照组相比,模型组的CMs 的BNP 蛋白表达明显下调,差异有统计学意义(P<0.05);同模型组相比,BNP 蛋白在实验组中表达上调,差异有统计学意义(P<0.05),同对照组相比,模型组的CMs 的TGF-β1 蛋白表达明显上调,差异有统计学意义(P<0.05),同模型组相比,TGF-β1 蛋白在实验组中表达明显下调,差异有统计学意义(P<0.05,图9)。
3 讨论
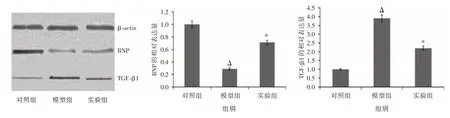
图9 各组CMs 的BNP 及TGF-β1 蛋白的相对表达量Fig.9 Relative expression of BNP and TGF-β1 protein in the cardiomyocytes of each group
ADR 是一个有效的抗实体瘤和恶性血液病的化疗药物,而心功能障碍是ADR 治疗最严重的副作用,因而使用受到限制。目前越来越多证据证实ADR 诱导的心肌病的过程中存在大量的机制,包括氧化应激、内皮细胞损伤、CMs 凋亡等,其中CMs 凋亡可能扮演了关键的角色[1]。本研究利用ADR 诱导CMs 凋亡模型作为研究的切入点,寻找能逆转其CMs 凋亡的有效方法及机制探讨。
3.1 晚期EPCs-CM 对ADR 诱导的CMs 凋亡的影响 EPCs 是血管内皮细胞的前体细胞,EPCs 主要存在于骨髓,当在缺血、血管损伤等因素的诱导下,可从骨髓动员到外周血,参与损伤血管的修复,在冠心病、高血压、血管成形术后再狭窄等血管性疾病中发挥治疗作用[2],近年来研究发现EPCs移植同样应用于心肌病如糖尿病心肌病、药物性心肌病等[4-5]。研究[3]证实:EPCs 除了具有新生血管功能外,其许多心血管的作用是通过旁分泌功能所实现的,而检测EPCs的旁分泌功能的方法就是将细胞X的条件培养液作用于细胞Y,观察其对细胞Y 相关功能的影响,WU 等[6]研究发现晚期EPCs 可分泌多种具有抗凋亡因子。HYNES 等[7]发现EPCs-CM 能通过调控胰岛素类似生长因子-1 的表达在急性心肌梗死后心脏重构中发挥抗CMs凋亡的作用。HANEEF 等[8]发现骨髓间充质细胞条件培养基能通过促进心脏血管再生在缺血性心肌病中发挥一定的治疗作用。本研究培养EPCs 28 d 后取其上清液作为晚期EPCs-CM,将其作用于ADR诱导的CMs凋亡模型中,MTT法、Hoechst33342/PI及AnnexinV-FITC/PI 双染法发现ADR 能明显降低CMs 的存活率及增加CMs凋亡率,而晚期EPCs-CM能抑制ADR诱导的CMs凋亡,提高CMs的存活率,在体外实验上初步揭示晚期EPCs-CM 可能能在ADR 诱导的心肌病上发挥一定的治疗作用。
3.2 在晚期EPCs-CM 作用于ADR 诱导的CMs凋亡上TGF-β1 的表达的变化 在心衰发生发展的过程中,CMs 能产生一系列细胞因子,通过自分泌或旁分泌,在特定的条件下,经特定的信号传导通路,调控心衰的发生发展。研究发现,TGF-β是在心衰发展过程中急剧增加的细胞因子中的一员,TGF-β1 作为TGF-β超家族中重要亚型,生物学功能复杂,尤以介导CMs 凋亡的功能为主[9]。本研究发现ADR 诱导的CMs 凋亡模型中,CMs 的TGF-β1 mRNA 及蛋白表达明显上调,而晚期EPCs-CM 可明显下调凋亡因子TGF-β1 mRNA 及蛋白的表达,提示晚期EPCs-CM 可能是通过下调TGF-β1的表达抑制ADR 诱导的CMs 凋亡。
3.3 在晚期EPCs-CM 作用于ADR 诱导的CMs凋亡上BNP 的表达的变化 BNP 作为一种神经激素,其分泌和释放受CMs 张力影响,在心衰的病理生理过程发挥重要作用,研究发现在动物体内注射ADR 后其血浆BNP 浓度上升,血浆BNP 可作为ADR心肌病的监测指标[10]。本研究应用5 μg/mL的ADR 建立CMs 凋亡模型模拟体外ADR 性心肌病,结果发现CMs 的BNP mRNA 转录没有增加反而被抑制,Western Blot检测也进一步证实BNP蛋白表达减少,这与体内实验于动物体内应用ADR 引起的BNP 浓度升高的结论相悖,考虑可能为体外一次性使用ADR 作用于CMs 后其急性毒性作用能引起BNP的表达暂时减少,而分次给动物体内应用ADR是一个剂量逐渐累积引起慢性毒性效应,导致心功能受损,心室负荷增加,从而引起BNP 表达分泌增加。本研究同时发现在ADR 诱导的CMs 凋亡模型中应用晚期EPCs-CM 能明显上调BNP mRNA 转录及蛋白的表达,提示晚期EPCs-CM可能是通过上调BNP的表达抑制ADR诱导的CMs凋亡。
综上所述,笔者认为晚期EPCs-CM 能抗ADR诱导的CMs 凋亡,其机制可能是通过下调凋亡因子TGF-β1 的表达及上调BNP 的表达所实现的,晚期EPCs 移植未来可能可用于ADR 诱导的心肌病的预防和治疗,甚至也可预防其他蒽环类药物抗肿瘤时对心肌的损害。然而晚期EPCs抗CMs凋亡机制复杂,且WU 等[6]研究结果已经提示多种细胞因子都可能对其起作用。受研究条件所限,本实验仅研究了其中的BNP 及TGF-β1,对于相关机制的探索,还有待于深入研究。本研究目前仅局限于体外细胞实验,动物实验及人体临床试验尚未开展,此研究为干细胞治疗心血管疾病提供前期基础。
