神经鞘磷脂合成酶2 基因沉默对乳腺癌细胞凋亡的影响
2019-05-10杭月林昌岫黄成日
杭月 林昌岫 黄成日
延边大学附属医院1妇产科,2中心实验室(吉林延吉133000)
神经鞘磷脂(sphingomyelin,SM)是脂质筏的重要成分[1],有希望成为肿瘤诊断和治疗的新靶标。神经鞘磷脂合成酶(sphingomyelin synthase,SMS)是SM 合成的最后一个酶,包含SMS1 和SMS2两个同工酶。SMS1 参与SM 的生物合成,而SMS2与SM 合成后的加工修饰有关,是影响细胞内SM、神经酰胺(ceramide,Cer)等细胞因子活性和浓度的关键酶,同时也是炎症反应中重要的调控因子[2]。由于有研究证实,SMS1 缺失后对癌细胞的影响作用并不明显,所以选择性的SMS1 抑制剂并不能作为理想的细胞毒性药物用于临床[3]。而下调SMS2 的表达可影响脂质筏的功能,进而抑制细胞的凋亡[4]。另外,已知肿瘤坏死因子α(tumor necrosis factor α,TNF-α)可通过激活酸性鞘磷脂酶(acid sphingomyelinase,ASM)降解SM 而生成Cer,诱导细胞凋亡[5]。为进一步证明SMS2 与肿瘤细胞亡的关系,笔者拟以人乳腺癌细胞株MCF-7 为实验模型,用TNF-α诱导凋亡后,将SMS2 siRNA 转染至细胞中,探讨SMS2 基因沉默后对MCF-7 细胞凋亡的影响,从而为临床治疗和药物研发提供潜在的靶标。
1 材料与方法
1.1 实验细胞 人雌激素受体阳性乳腺癌细胞株MCF-7 由延边大学病理学教研室提供并传代保存。将MCF-7 细胞培养在含有10%胎牛血清、100 U/mL 青霉素-链霉素双抗的RPMI1640 培养液中,置于37 ℃、5%CO2细胞培养箱中进行传代培养。
1.2 MTT 法检测细胞增殖 将对数期生长的MCF-7 细胞(1×104/孔)单层接种至96 孔板中,置于37 ℃,5%CO2细胞培养箱中进行培养,加入不同梯度浓度的TNF-α(50、100、200、400、800 ng/mL),孵育48 h 后,每孔加入20 μL MTT,置于37 ℃,5%CO2细胞培养箱中孵育4 h 后,弃除上清液,每孔加入200 μL DMSO,置于振荡器上震荡5 min,置于显微镜下观察无紫色结晶物。将96 孔板放置于酶标仪上,检测波长为570 nm 处的光密度值(OD值),计算细胞增殖抑制率和IC50:增殖抑制率(%)=1-OD值(受试孔)/OD值(对照空)×100%,每组取8 个复孔平均值。
重复上述实验,取IC50浓度的TNF-α分别作用于细胞24、48、72、96 h,检测波长为570 nm 处的光密度值(OD值),计算细胞增殖抑制率。
1.3 构建SMS2 siRNA转染细胞株 用DEPC水稀释SMS2 siRNA 至终浓度为20 μmol/L。取适量的SMS2 siRNA 加入至Opti-MEM 转染培养基中,轻轻混匀。再取适量的LipofectamineTM2000 与之混合,室温下孵育约20 min,形成siRNA-LipofectamineTM2000 复合体。于荧光倒置显微镜下观察荧光染色判断感染率。提前1 d 在相应备行转染的6 孔板上接种5 × 105个细胞,加入不含FBS 和双抗的培养基400 mL 至培养箱中饥饿培养3 h,随后加入10%FBS 和TNF-α(终浓度IC50)培养24 h 后,待融合率达到50%~60%时,再加入适量脂质体复合体,使SMS2 siRNA 终浓度为100 nmol/L。置于37 ℃,5%CO2细胞培养箱中培养24 h。提取细胞RNA 及蛋白,验证目的基因表达情况及转染效率。实验分为4 组:空白对照组(CTL 组)、TNF-α组、阴性对照组(SiR-Con 组)和转染组(SiR2 组)。
1.4 酶活性检测 收集对数期生长的MCF-7 细胞(1 × 107个),加入匀浆液置于冰浴中,取出匀浆粗酶液100 μL 加入SMS 反应体系(取100 μL 粗酶液、60 mL 匀浆液、425 μL 双蒸水、3 μL PC、2 μL NBD-Cer,37 ℃反应5 h)中,37 ℃反应5 h,加入900 μL 氯仿-甲醇(2∶1)溶液,充分震荡混匀后,离心并提取有机相,氮气干燥,用薄层层析法(thin layer chromatography,TLC)测定SMS 酶活性。
1.5 Hoechst33258/PI 双染法观察活细胞状态将各组细胞(1 × 104个/孔)单层接种至24 孔板中正常培养,每组设置8 个平行孔,加入预冷的PBS洗涤3 次,每孔加入浓度为5 μg/mL 的Hoechst 33258 染液200 μL,37 ℃避光孵育15 min,随后每孔加入浓度为15 μg/mL 的PI 染液50 μL,4℃避光孵育15 min,采用高内涵活细胞成像系统观察细胞凋亡形态。
1.6 流式细胞术检测细胞凋亡 收集细胞,采用预冷的PBS 洗涤3 次后,3 000 r/min 离心5 min,离心半径10 cm,弃上清;加入500 μL Binding Buffer重悬,加入Annexin V 5 μL,避光孵育15 min;加入PI 5 μL,4 ℃避光孵育15 min;3 000 r/min离心5 min,离心半径10 cm,弃上清;加入300 μL 结合缓冲液;上机检测。所有操作严格按照试剂盒说明书操作进行。采用流式细胞仪(Ex=488 nm,Em=530 nm)检测细胞凋亡情况。
1.7 荧光定量实时PCR (1)采用Trizol 法提取细胞总RNA;按照RNA 提取试剂盒说明书提供的步骤进行操作,采用分光光度计检测RNA 浓度。(2)以细胞cDNA 为模板,以β-actin 作为内参。将10 μL 反应体系置于37 ℃恒温水浴20 min,85 ℃5 s,将反应生成的cDNA 放于-20 ℃保存备用。(3)冰浴中配制20 μL PCR 反应体系,95 ℃30 s 预变性,95 ℃5 s 退火,60 ℃20 s 延伸,循环40 次,95 ℃15 s,60 ℃30 s,95 ℃15 s 终末延伸,4 ℃保存。引物序列如下:鼠抗B 淋巴细胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)(F:5′- CATTGGGAAGTTTCAAATCAGC-3′;R:5′-CTTTGCATTCTTGGACGAGG-3′);鼠抗Bcl-2 相关X 蛋白(bcl-2-associated X protein,Bax)(F:5′-TTGCTTCAGGGTTTCATCCA-3′;R:5′-CAGCCTTGAGCACCAGTTTG-3′);caspase-3(F:5′-CTGGGAAGGGTTGTGAATGA-3′;R:5′-CAGTTTGGCTTGCTGGTCTC-3′)。根据使用说明调整基线,以2-ΔΔCt表示目的基因mRNA 相对表达量。
1.8 免疫印迹法(Western Blot) 收集对数期生长的MCF-7 细胞1 × 107个,加入预冷PBS,清洗3 次;加入RIPA 细胞裂解液,收集上清;测定蛋白浓度。加入SDS 上样缓冲液充分混匀,置于95 ℃水浴中10 min,使蛋白变性。将10%的SDS-聚丙烯酰胺凝胶电泳分离,分离蛋白转移方法转移到PVDF 膜上并浸入密封液中1 h。冲洗,分别加入Bcl-2 抗体(1∶500 稀释)、Bax 抗体(1∶500 稀释)、caspase-3 抗体(1∶1 000 稀释),置于4 ℃摇床上过夜。采用TBST 冲洗3 次,加入二抗(1∶5 000 稀释),37 ℃孵育1 h,洗膜,显影5 min,采用Alpha 凝胶成像分析系统分析凝胶光密度值。
1.9 统计学方法 采用SPSS 19.0统计学软件进行处理;组间比较采用单因素方差分析,两两比较采用LSD-t检验;P<0.05表示差异具有统计学意义。
2 结果
2.1 TNF-α 对MCF-7 细胞增殖活性的影响 经MTT 法检测,不同浓度TNF-α 对MCF-7 细胞增殖的抑制率分别为(9.86±1.38)%、(15.41±3.77)%、(36.28±7.15)%、(58.34±6.86)%、(64.78±7.45)%,IC50为205.7 ng/mL(图1)。
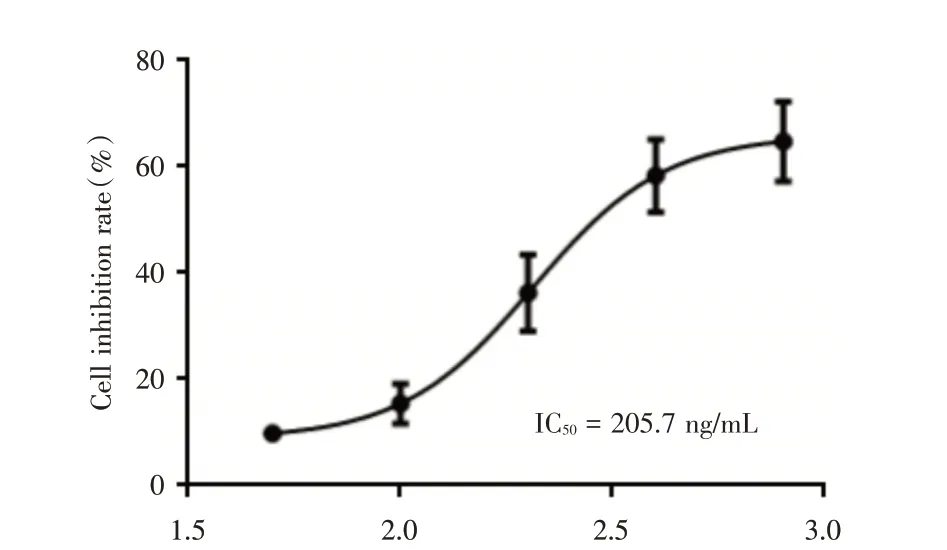
图1 经MTT 法检测TNF-α 对MCF-7 细胞增殖活性的影响Fig.1 Proliferation of MCF-7 cells induced by TNF-α by MTT assay
2.2 Si-SMS2 慢病毒转染效果 慢病毒按感染复数(multiplicity of infection,MOI;MOI=病毒数量/细胞数量)为50 时转染效率较高,细胞状态良好。经qRT-PCR 法检测,SiR2 组细胞SMS2 mRNA 表达水平明显低于CTL 组和SiR-Con 组,差异有统计学意义(F= 49.75,P<0.000),基因表达水平分别下降62.5%和64%(图2)。
2.3 SMS 酶活性测定 经凝胶图像分析仪扫描,CTL 组、TNF-α组、SiR-Con 组、SiR2 组SMS 酶活性灰度值分别为(18.17±3.78)、(12.26±3.15)、(11.53±3.65)、(4.35±1.29),经TNF-α诱导后,TNF-α组、SiR-Con组以及SiR2组细胞SMS酶活性灰度值均低于CTL 组细胞,差异有统计学意义(P<0.05);并且与TNF-α组、SiR-Con 组相比,SiR2 组细胞SMS 酶活性明显降低,差异有统计学意义(P<0.05)。见图3。
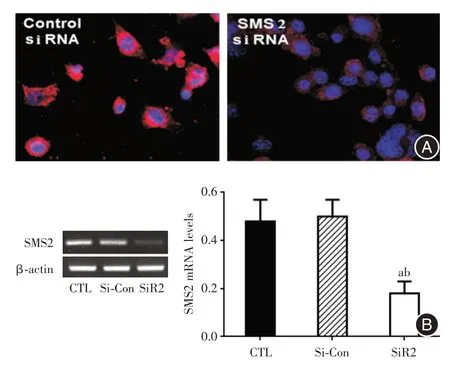
图2 MCF-7 细胞转染SMS2 siRNA 后SMS2 mRNA 表达情况Fig.2 SMS mRNA levels of MCF-7 cells transfected with SMS2 siRNA
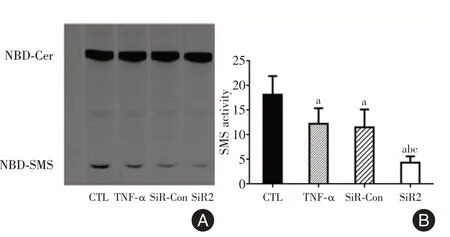
图3 基因沉默后SMS 酶活性比较Fig.3 Changes of SMS activity after RNA interference
2.4 MCF-7 细胞凋亡情况
2.4.1 经Hoechst33258/PI 双染法观察各组活细胞状态 如图4A 所示,活细胞为蓝色,而坏死细胞核呈红色并肿大,凋亡细胞可见细胞核染色质凝聚、皱缩、致密的红色或亮蓝色。CTL 组可见正常细胞的有丝分裂,而TNF-α组、SiR-Con 组和SiR2组细胞出现明显的凋亡和坏死,尤其是SiR2 组细胞红色标记细胞明显多于其他3组。CTL组、TNF-α组、SiR-Con 组、SiR2 组细胞凋亡率分别为(3.11 ±0.69)%、(14.29 ± 2.71)%、(13.85 ± 1.96)%、(31.08± 5.46)%,细胞坏死率分别为(0.63 ± 0.12)%、(1.72 ± 0.38)%、(1.65 ± 0.40)%、(3.75 ± 0.47)%,经TNF-α诱导后,TNF-α组、SiR-Con 组以及SiR2 组细胞凋亡率和坏死率均高于CTL 组细胞,差异有统计学意义(P<0.05);并且与TNF-α组、SiR-Con组相比,SiR2 组细胞凋亡率和坏死率明显增加,差异有统计学意义(P<0.05,图4B、4C)。
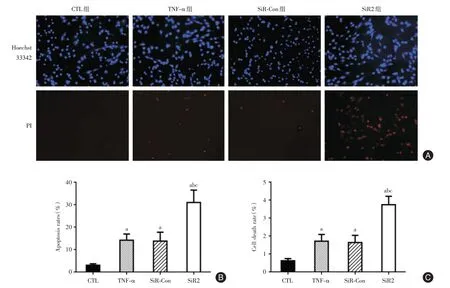
图4 Hoechst33258/PI 双染法观察各组细胞凋亡率和坏死率Fig.4 Apoptosis and death rates of MCF-7 cells observed by Hoechst33258/PI staining
2.4.2 FITC-annexin V/PI 双染法观察各组细胞凋亡情况 经FCM 法检测(图5A),CTL 组、TNF-α组、SiR-Con 组、SiR2 组细胞凋亡率分别为(7.15 ±2.14)%、(21.46 ± 5.72)%、(23.05 ± 7.28)%、(39.57±7.35)%,经TNF-α诱导的3组细胞,TNF-α组、SiRCon 组以及SiR2 组细胞凋亡率均高于CTL 组细胞,差异有统计学意义(P<0.05);并且与TNF-α组、SiR-Con 组相比,SiR2 组细胞凋亡率进一步增加,差异有统计学意义(P<0.05)。见图5B。
2.5 SMS2 基因沉默对MCF-7 细胞凋亡相关基因和蛋白表达的影响
2.5.1 qRT-PCR 法检测 如图6A 所示,经TNF-α诱导后,TNF-α组、SiR-Con组以及SiR2组细胞Bcl-2基因表达量明显低于CTL 组,而Bax 和caspase-3基因表达量均高于CTL 组细胞,差异有统计学意义(P<0.05);而且与TNF-α组、SiR-Con 组相比,SiR2 组细胞Bcl-2 基因表达量进一步降低,Bax 和caspase-3 基因表达则进一步上调,差异有统计学意义(P<0.05)。
2.5.2 Western Blot 检测 如图6B 所示[1],与qRTPCR法检测结果基本一致,经TNF-α诱导后,TNF-α组、SiR-Con 组以及SiR2 组细胞Bcl-2 蛋白表达量明显低于CTL 组,而Bax 和caspase-3 蛋白表达量均高于CTL 组细胞,差异有统计学意义(P<0.05);而且与TNF-α组、SiR-Con 组相比,SiR2 组细胞Bcl-2蛋白表达量进一步降低,Bax 和caspase-3 蛋白表达则进一步上调,差异有统计学意义(P<0.05)。
3 讨论
HAMPTON 等[6]首次发现可溶性神经鞘磷脂与细胞信号转导密切相关。尤其是Cer 作为神经鞘磷脂家族最重要的成员之一,既是细胞膜的主要组成成分,也是细胞凋亡、增殖、活化等过程的重要参与者。而与催化Cer 相关的关键酶SMS 也逐渐引起众多学者的关注。近几年,有研究发现SMS 活性改变可能与细胞凋亡有关。SMS 包含SMS1 和SMS2 两种同工酶,细胞内SMS2 缺乏可以明显降低SMS 酶活性以及细胞内SM 的水平[7]。
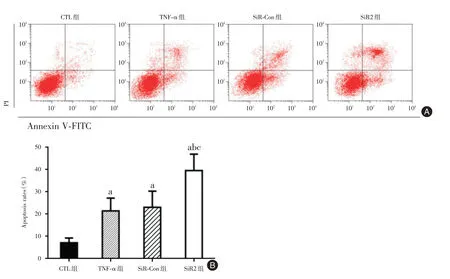
图5 流式细胞术检测SMS2 基因沉默对MCF-7 细胞凋亡的影响Fig.5 Apoptosis of MCF-7 cells by flow cytometry
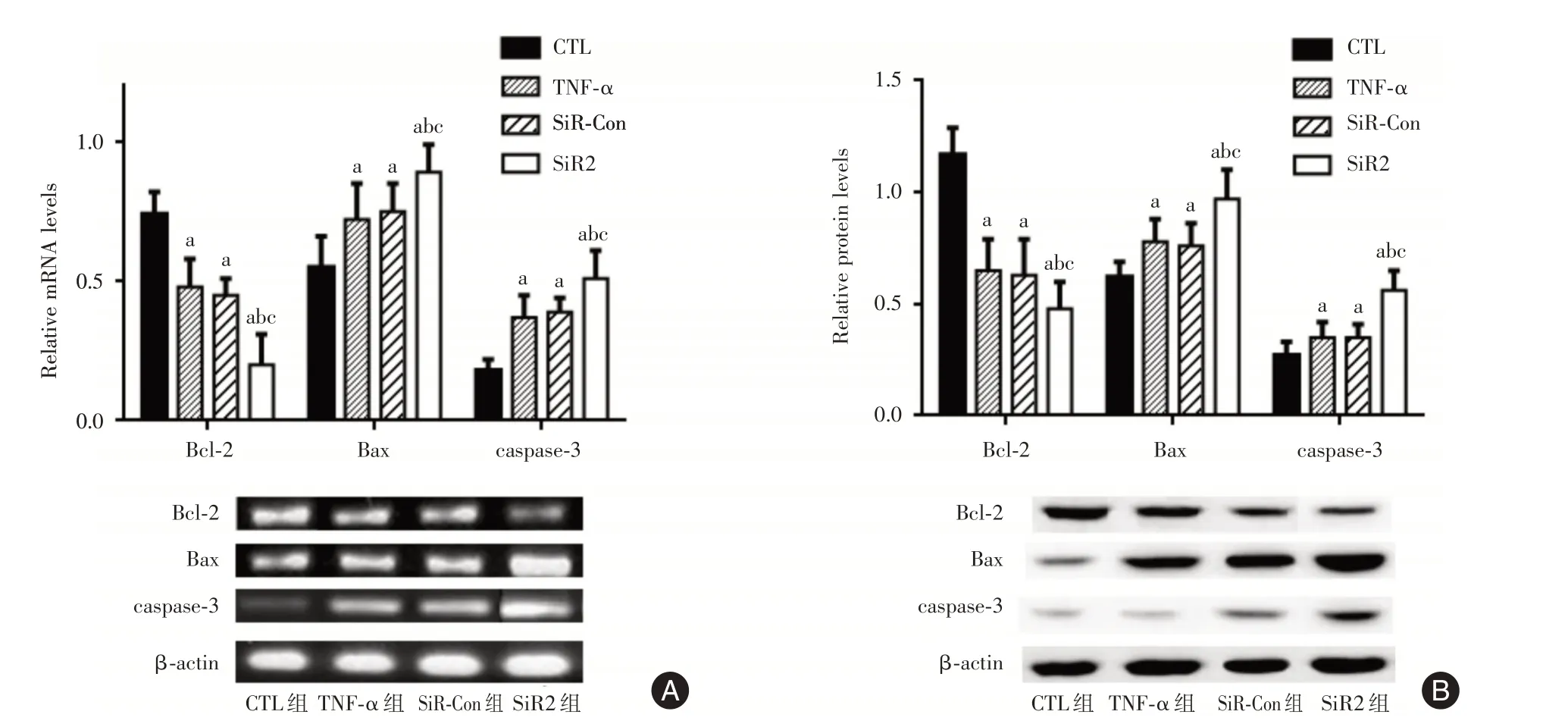
图6 SMS2 基因沉默对MCF-7 细胞凋亡相关基因和蛋白表达的影响Fig.6 The mRNA and protein levels of apoptosis-related factors
本研究首先通过MTT 法检测不同浓度梯度的TNF-α对MCF-7 细胞凋亡的促进作用,最终选择IC50浓度即205.7 ng/mL 作为后续研究的作用浓度。TNF-α是由活化的单核巨噬细胞分泌产生的一类最重要的细胞因子,作用机制复杂,对乳腺癌细胞呈现双向调控作用[8]。在体外可以显著抑制肿瘤细胞的增殖,促使其凋亡;而在体内则可通过调控机体免疫功能以及促炎性反应等,促使肿瘤细胞增殖,抑制其凋亡[9]。最新有研究证实TNF-α可通过激活酸性神经鞘磷脂降解鞘磷脂,从而生成Cer,诱导细胞发生凋亡[10]。因此本项研究旨在分析SMS2 基因沉默对TNF-α诱导MCF-7 细胞体外凋亡实验的影响。
既往报道称,SMS 基因异常表达不仅影响SMS酶活性,对细胞和培养基中SM 的水平也有一定的调节作用[11]。本研究也发现,下调SMS2 基因表达后,MCF-7 细胞内SMS 酶活性显著降低。同时出现典型的细胞凋亡特征,与空白MCF-7 细胞组或者单纯TNF-α诱导组相比,si-SMS2 组细胞凋亡率进一步增加。因此,笔者推测沉默MCF-7 细胞SMS2 基因表达后,细胞内SMS 酶活性降低,底物Cer 利用率随之下降,而剩余的Cer 水平也相应升高,Cer 作为公认的促凋亡信号分子,可能与多种信号通路调节或凋亡相关蛋白的表达有关。随后笔者进一步证实,经TNF-α诱导后,TNF-α组、SiRCon 组以及SiR2 组细胞Bcl-2 基因表达量明显低于CTL 组,而Bax 和caspase-3 基因表达量均高于CTL组细胞,并且与TNF-α组、SiR-Con组相比,SiR2组细胞Bcl-2 基因表达量进一步降低,Bax 和caspase-3基因表达则进一步上调。据判断,SMS2 作为催化卵磷脂和Cer 生成SM 和甘油二酯的关键酶,其表达下调,则底物Cer 水平相应增加,DAG 和SM水平随之减少。作为细胞内重要的第二信使,Cer和DAG 均与凋亡酶系统、线粒体凋亡途径等密切相关[12]。其中Bcl-2 蛋白家族和caspase 家族是目前最受关注的、作用最为确切的凋亡调控基因。Bcl-2 家族蛋白属于抗凋亡因子,主要通过调节细胞色素C 的释放来促进Bax 或抑制Bcl-2 诱导细胞凋亡[13]。当抗凋亡基因Bcl-2 表达上调时,Bcl-2与Bax 形成异源二聚体,从而抑制细胞凋亡。而caspase-3是多种凋亡途径共同的下游调控蛋白,被称为“死亡执行蛋白”[14]。而近年来关于Bcl-2、Bax、caspase-3 三者的关系研究也发生了突破性进展,发现Bcl-2、Bax 不仅是caspase-3 的上游调控基因,同时也是caspase-3 的直接作用底物,三者既相互联系,又相互制约[15]。因此,通过本项研究说明SMS2 基因沉默后细胞凋亡作用与死亡受体通路和线粒体途径均密切相关。
综上所述,通过体外细胞实验证实,乳腺癌细胞脂质筏中SMS2 基因缺失与促使细胞凋亡有关。SMS2 基因沉默可降低细胞内SMS 酶活性,通过抑制抗凋亡基因Bcl-2 的表达,同时上调促凋亡基因Bax 和caspase-3 的表达水平,提高TNF-α诱导肿瘤细胞凋亡的作用,因此及SMS2 基因表达调控可成为乳腺癌化疗药物的重要干预靶点。但是本项研究只是初步证明SMS2 基因沉默与乳腺癌细胞的凋亡存在一定的联系,如证实这个具体的作用机制,还需要纳入更多的肿瘤细胞进行进一步深入且细致地研究。
