产气荚膜梭菌β毒素蛋白抗原表位预测及CPB-N蛋白免疫原性分析
2019-05-10王玉建商红旗徐煜琳胡莉萍朱瑞良
王玉建,商红旗,朱 琳,徐煜琳,胡莉萍,朱瑞良*
(1.山东农业大学动物科技学院/山东省动物生物技术与疫病防治重点实验室,山东 泰安 271018;2.山东省动物疫病预防与控制中心,山东 济南 250022)
产气荚膜梭菌β毒素是由B型产气荚膜梭菌(C.perfringenstype B,CPB)和 C型产气荚膜梭菌(CPC)产生的一种强毒素,具有细胞毒性和强致死性,是引起人和动物坏死性肠炎以及动物痢疾的主要致病因子[1-2]。β毒素引起的严重疾病已经得到证实[3-4],研究β毒素在致病过程中激活淋巴细胞的免疫应答过程,需要探索及确定其抗原结合部位。产气荚膜梭菌β毒素蛋白完整序列含336个氨基酸,蛋白分子结构复杂,且完整的β毒素蛋白带有原始毒性,而决定抗原免疫活性的只是整个蛋白分子中部分抗原区域,即抗原表位[5]。重组基因的研究表明,有效的基因片段可以在受体菌中表达,并被特异性抗体识别表现出良好的免疫原性[6]。在之前研究的基础上[7-8],本研究采用多种生物信息学手段,通过预测β毒素蛋白抗原表位,并结合对三维空间模型的分析,截取一段优势蛋白序列,并对该序列进行表达,将表达的新蛋白(CPB-N)与原始β毒素蛋白免疫原性进行比较,确认CPB-N与原始β毒素蛋白免疫原性的相似性,为后续融合蛋白的构建奠定了基础。
1 材料与方法
1.1 主要实验材料 预测所用产气荚膜梭菌β毒素蛋白序列源自GenBank(KP064408.1);通过预测分析得到的CPB-N基因序列由上海生工生物工程技术服务有限公司全基因合成;大肠杆菌BL21(DE3)pLysS感受态细胞购自北京康为世纪生物科技有限公司;重组质粒pET28a-CPB-N由上海生工生物工程技术股份有限公司构建;表达β毒素蛋白的BL21-β菌株和β毒素单克隆抗体(MAb)由本实验室提供;HRP标记的山羊抗鼠IgG(IgG-HRP)和IgAHRP购自康为世纪生物科技有限公司;60只6周龄SPF BALB/c小鼠,购自济南赛恩斯科技有限公司。
1.2 β毒素蛋白抗原表位预测 采用DNAStar Lasergene软件对β毒素蛋白二级结构、亲水性、可塑性、抗原性进行预测[9];应用G+LPP模式对β毒素蛋白信号肽及切割位点进行预测;SWISS-MODEL建立β毒素蛋白的三维空间结构模型;ElliPro在线服务器以5个连续残基为最低标准预测线性和不连续的抗原表位[10];PyMOL软件标记β毒素蛋白优势抗原表位,筛选、截取并建立CPB-N三维空间结构模型。
1.3 CPB-N蛋白表达与鉴定 重组质粒pET28a-CPB-N经电转化转入大肠杆菌感受态BL21,筛选出阳性克隆子在含有Amp的LB肉汤中37℃、220 r/min培养至对数生长期(OD600nm=0.5~0.6),IPTG(终浓度1 ng/m L)诱导表达3 h,终止后菌液离心取沉淀,煮沸裂解后进行SDS-PAGE检测。以小鼠抗β毒素MAb(1∶2 000)为一抗,山羊抗鼠 IgG-HRP(1∶5 000)为二抗,进行western blot鉴定。
1.4 小鼠免疫及样品采集 分3组进行小鼠免疫实验,A组小鼠口服免疫1 m L 1010cfu/m L的pET28a-CPB-N/BL21重组菌液,B组小鼠口服免疫同剂量的BL21-β菌液,C组小鼠口服免疫相同剂量的PBS液。连续3 d进行重复免疫,并于首免后第14 d、15 d、16 d、28 d、29 d和30 d加强免疫。
各组分别在首免后的第0、7 d、14 d、21 d、28 d和35 d取3只小鼠从尾静脉采血分离血清,迫杀实验鼠后取肠段,用0.5 m L含有蛋白酶抑制剂的冰冷无菌PBS洗涤,收集肠道灌洗液。
1.5 特异性抗体测定 为鉴定CPB-N蛋白是否具有诱导系统性和粘膜抗体应答的能力,参照文献[11]ELISA方法,分别以预处理的小鼠血清和肠道灌洗液作为一抗,1∶4 000稀释的山羊抗鼠 IgAHRP/IgG-HRP为二抗,检测样本血清中和肠道灌洗液中的IgG和IgA特异性抗体。
1.6 数据统计 数据以平均值±标准偏差(X±SD)表示。使用SPSS软件(IBM)测定ANOVA的统计显著性,其中*:p<0.05为具有显著性差异,**:p<0.01为具有极显著的差异。
2 结果
2.1 β毒素蛋白抗原表位预测 β毒素蛋白二级结构预测显示aa200~aa320区段富含无规则卷曲和转角结构,易于接触;aa30~aa300区段为亲水性区域且可塑性较高;aa5~aa27区段为跨膜区,疏水性较强;ElliPro在线预测连续性与非连续性抗原表位主要集中在aa108~aa301区段。综合预测β毒素蛋白有效抗原表位主要在aa108~aa320区段。
2.2 β毒素蛋白三级结构预测及CPB-N蛋白筛选PyMOL编辑蛋白三维结构(图1):A显示在β毒素蛋白优势抗原表位部分(红色);B-1标记aa265位Cys替换为His,B-2标记CPB-N蛋白截取位置;C显示CPB-N独立的结构模型。综合上述预测β毒素蛋白抗原表位的各项信息以及对β毒素蛋白三维结构的分析,最终选取aa108~aa305区段且用His替代Cys-265作为有效呈递β毒素蛋白抗原的新蛋白CPB-N。
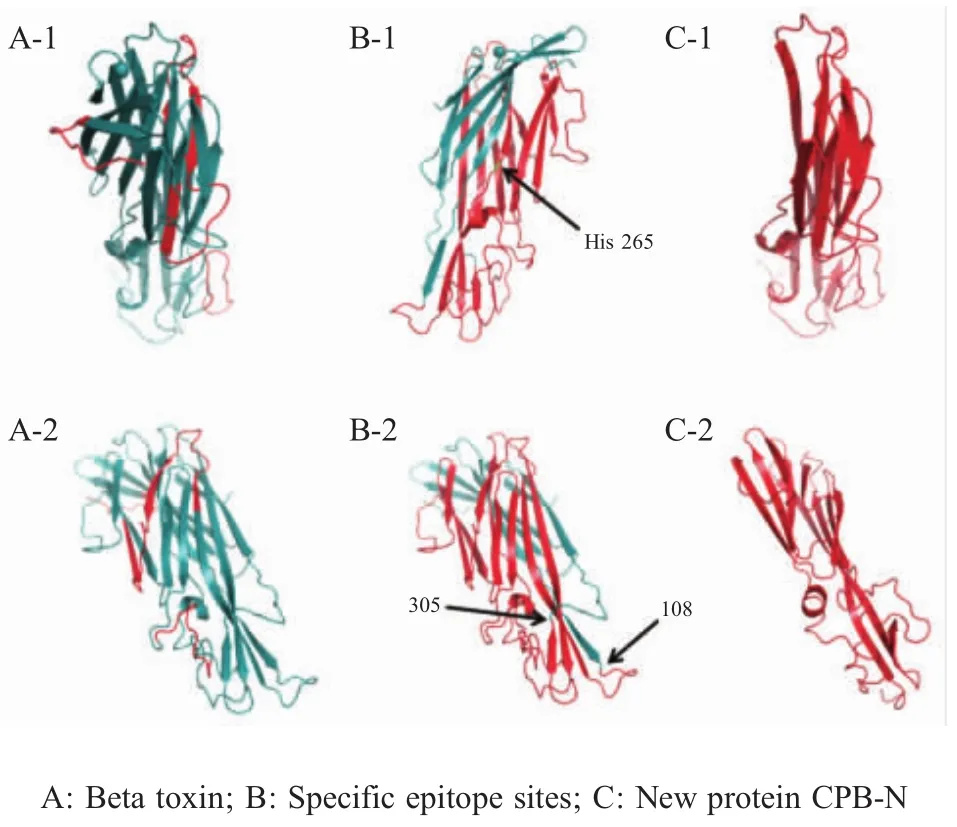
图1 β毒素蛋白三维结构模型Fig.1 The three-dimensional structuremodel of beta toxin protein
2.3 CPB-N蛋白的表达及鉴定 重组菌pET-32a-CPB-N/BL21经IPTG诱导后进行SDS-PAGE检测,结果显示诱导表达的蛋白约为24 ku(图2A),与预期新蛋白CPB-N大小相符。利用His标签抗体进行western blot检测结果显示在约24 ku处有一条特异性条带,且亮度与β毒素蛋白的条带亮度相近(图2B),表明CPB-N在BL21中表达效果较好。

图2 CPB-N蛋白的SDS-PAGE检测(A)及western blot鉴定(B)Fig.2 The detection and identification of CPB-N protein by SDS-PAGE(A)and western blot(B)
2.4 CPB-N蛋白与β毒素蛋白免疫原性比较 分别通过ELISA检测免疫小鼠特异性IgG和IgA抗体,结果显示,在口服免疫之前,3组小鼠之间的IgG和lgA水平无差异(p>0.05)。第一次加强免疫后,A和B组中抗β毒素特异性IgG和lgA的水平明显升高,两者之间差异不大(p>0.05),C组检测不到特异性抗体。在首免后第21 d、28 d和35 d观察到A组和B组抗体差异明显缩小,大致处于相同水平(p>0.05),表明CPB-N与β毒素蛋白具有相似的免疫原性。
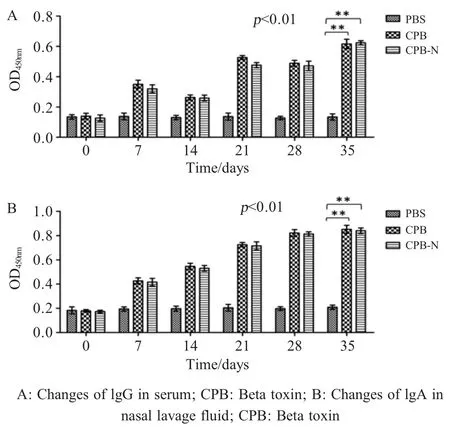
图3 免疫小鼠血清中lgG(A)及肠道灌洗液中lgA抗体(B)水平Fig.3 The antibody levels of lgG in serum(A)and lgA in intestinal lavage fluid(B)
3 讨论
产气荚膜梭菌β毒素是一种毒力较强的成孔毒素,由336aa编码组成,对胰蛋白酶敏感,具有溶细胞活性,同时能够增大毛细血管渗透性、增加血压、降低心率,是一种非典型性的神经毒素[12-13]。近年来已经确认β毒素分为两种,传统β毒素名为β1毒素,新型β毒素名为β2毒素,β1毒素仍然是造成各种疾病的主要致病因子[14],因此本研究预测的抗原表位也是针对传统β1毒素。抗原表位是决定蛋白抗原特异性的一段特殊化学基因,也是与相应的淋巴细胞表面的抗原受体特异性结合的部位,因此了解β毒素蛋白的抗原表位,一方面有助于为β毒素致病机制的研究提供思路,另一方面,可以针对性的做好β毒素的免疫预防工作。
实验证明CPB的C-末端残基(CPB256-276)与来自金黄色葡萄球菌的α毒素的C-末端部分(SAA245-267)极为相似。CPB256-276可能是整个β毒素蛋白序列中负责与细胞受体结合的区域,而N-末端未有特殊功能区域。与其它毒素一样(如肉毒杆菌神经毒素),受体结合结构域通常含有保护性表位的主要部分。同时,265位半胱氨酸残基被酪氨酸或组氨酸置换能够导致毒素的致死活性丧失而本身生物学活性不变[15]。结合抗原表位和β毒素蛋白三维空间构型预测的结果,aa108与aa305恰好位于β-折叠与无规则卷曲交界处,此区间包括线性抗原表位和aa108~aa301的非线性表位在内的所有有效氨基酸(包括CPB256-276),且具有良好的空间构型(利于抗原-抗体结合)。与多表位多肽相比,CPB-N蛋白异源表达产物表现出优秀的生物学活性,而多表位多肽表达产物空间构型尚不可知,并且某些功能未知的多肽容易被忽略,最终表达产物表现出的免疫原性可能与原始β毒素蛋白有差别。
本实验通过替换或去除β毒素蛋白无效区域,消除β毒素蛋白所具有的天然毒性且缩短氨基酸序列,保证了蛋白本身的生物活性。通过对CPB-N和β毒素蛋白免疫后小鼠的抗体滴度测定,已经确定CPB-N能够发挥与β毒素蛋白相似的免疫原性,而其本身分子量相对较小并且无毒性,也为抗原表位作为疫苗的候选物提供了检测依据。本研究对CPB-N蛋白进行筛选是希望探寻一种将多种小蛋白融合以达到综合免疫的效果,单一小蛋白(CPB-N)的免疫原性已经得到证明,与其他抗原融合的最终效果仍需要进一步探究。因此,通过对β毒素蛋白抗原表位的预测,筛选出分子量更小的CPB-N蛋白,对融合蛋白的有效构建极为重要,也为产气荚膜梭菌进一步的研究奠定了基础。
