抑制PI3K/AKt信号通路对帕金森病炎症细胞模型反应的影响
2019-05-10邵帅洪乐鹏邓雪华江梅丁涛姜经航王开秀
邵帅 洪乐鹏 邓雪华 江梅 丁涛 姜经航 王开秀
(1荆门市第二人民医院生殖医学科,湖北 荆门 448000;2广州医科大学人体解剖教研室;3韶关学院医学院人体解剖教研室)
研究显示,帕金森病(PD)模型中有磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKt)信号通路的抑制〔1~7〕,说明该通路参与PD发病的相关进程,而PD的神经保护类药物也是通过PI3K/AKt信号通路来发挥神经保护作用的,如:在6-羟基多巴诱导的PD模型中,人碱性成纤维细胞生长因子通过PI3K/AKt信号通路来抑制Tau蛋白磷酸化〔8〕;来自金银花的提取物类黄酮也可以通过PI3K/AKt信号通路来抑制小鼠小胶质瘤细胞(BV2)诱导的炎症反应〔9〕。尽管PI3K/AKt信号通路在PD的发病及神经保护作用中扮演重要角色,但目前尚无研究报道关于抑制PI3K/AKt信号通路对PD炎症反应的影响。本文观察抑制PI3K/AKt信号通路对PD炎症反应表达的影响。
1 材料和方法
1.1材料与试剂 BV2细胞株为南方医科大学人体解剖学教研室惠赠。DMEM 高糖培养基、胎牛血清(FBS)、胰蛋白酶、青链霉素、磷酸盐缓冲液(PBS)购自美国GIBCO公司;脂多糖(LPS)、诱导型一氧化氮合酶(iNOS)抗体购自美国Sigma公司;LY294002(LY)购自美国Santa Cruz公司;电化学发光(ECL)液购自赛默飞公司;磷酸化(p)-AKt、AKt抗体购自Abcam公司;β-actin、辣根过氧化物酶(HRP)标记-山羊抗兔为中杉金桥生物技术有限公司的产品;Trizol 购自美国invitrogen 公司。RT-PCR 反转录试剂盒、荧光定量PCR试剂盒、RNase-free H2O均购自TakaRa公司。
1.2方法
1.2.1BV2细胞培养 BV2细胞培养于DMEM高糖培养基+10%FBS+1%青链霉素,置于37℃、5%CO2的培养箱培养,24 h换液。
1.2.2细胞处理及分组 BV2细胞消化传代以1×105/ml接种于6孔板中并加入2 ml完全培养基,24 h后换液并处理细胞,细胞共分为4组:(1)对照组:相同的时间加入等量的生理盐水;(2)LPS组:1 μg/ml LPS孵育24 h;(3)LY+LPS组:20 μmol/L LY处理0.5 h后,1 μg/ml LPS孵育24 h;(4)LY组:20 μmol/L LY处理。
1.2.3Western印迹检测 细胞经上述药物处理后,加入RIPA 裂解液〔含1%的苯甲基磺酰氟(PMSF)〕提取蛋白,酶标仪检测蛋白浓度。总蛋白与上样缓冲液进行加热变性,用40 μg总蛋白进行十二烷基硫酸钠(SDS)/聚丙烯酰胺凝胶电泳(PAGE),然后转膜至聚偏氟乙烯(PVDF)膜上,5%脱脂牛奶封闭,一抗p-AKt、AKt、iNOS、β-actin各1∶1 000稀释孵育,4℃过夜,二抗1∶1 000 室温孵育2 h,化学发光显影。
1.2.4实时荧光定量PCR检测
1.2.4.1引物设计 根据Primer-BLAST 的cDNA 序列,分别设计β-actin、白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α引物序号。β-actin正义链5′-GTTACAGGAAGTCCCTCACCC-3′,反义链5′-CAGAAGCAATGCTGTCACCTT-3′;IL-1β正义链5′-TGCCACCTTTTGACAGTGATG-3′,反义链5′-GGAAGGTCCACGGGAAAGAC-3′;TNF-α正义链5′-ATGGCCTCCCTCTCATCAGT-3′,反义链5′-ATAGCAAATCGGCTGACGGT-3′。
1.2.4.2RNA提取及逆转录 细胞经药物处理后,用Trizol 法提取细胞总RNA。在NanoDrop-1000分光光度计上检测RNA的浓度和纯度,琼脂糖凝胶电泳检测RNA的降解度,将各组的RNA通过RT-PCR 反转录试剂盒逆转录为cDNA,以cDNA 为模板,添加上表中相关引物扩增各基因。ABI 7500软件检测各基因的mRNA表达水平。荧光定量PCR扩增条件:95℃ 30 s;95℃ 5 s,60℃ 34 s,共40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。每组均重复3次实验。
1.3统计学分析 采用SPSS16.0软件进行统计学分析,数据经正态性检验和方差齐性检验,采用单因素方差分析进行比较。
2 结 果
2.1LPS处理后对PI3K/AKt信号通路的影响 LPS组p-AKt/AKt蛋白比明显下调,与对照组相比差异具有统计学意义(P<0.01);LY+LPS组p-AKt/AKt蛋白比显著低于LPS组(P<0.01)。LY组p-AKt/AKt蛋白比显著高于LY+LPS组(P<0.01)。各组AKt蛋白表达差异无统计学意义(P>0.05)。见图1、表1。
2.2抑制PI3K/AKt信号通路对炎症因子表达的影响 LPS组IL-1β、TNF-α mRNA表达水平明显高于对照组(均P<0.01);LY+LPS组IL-1β、TNF-α mRNA表达显著低于LPS组(均P<0.01);LY组IL-1β、TNF-α mRNA表达水平明显低于LY+LPS组(均P<0.01)。见表1。
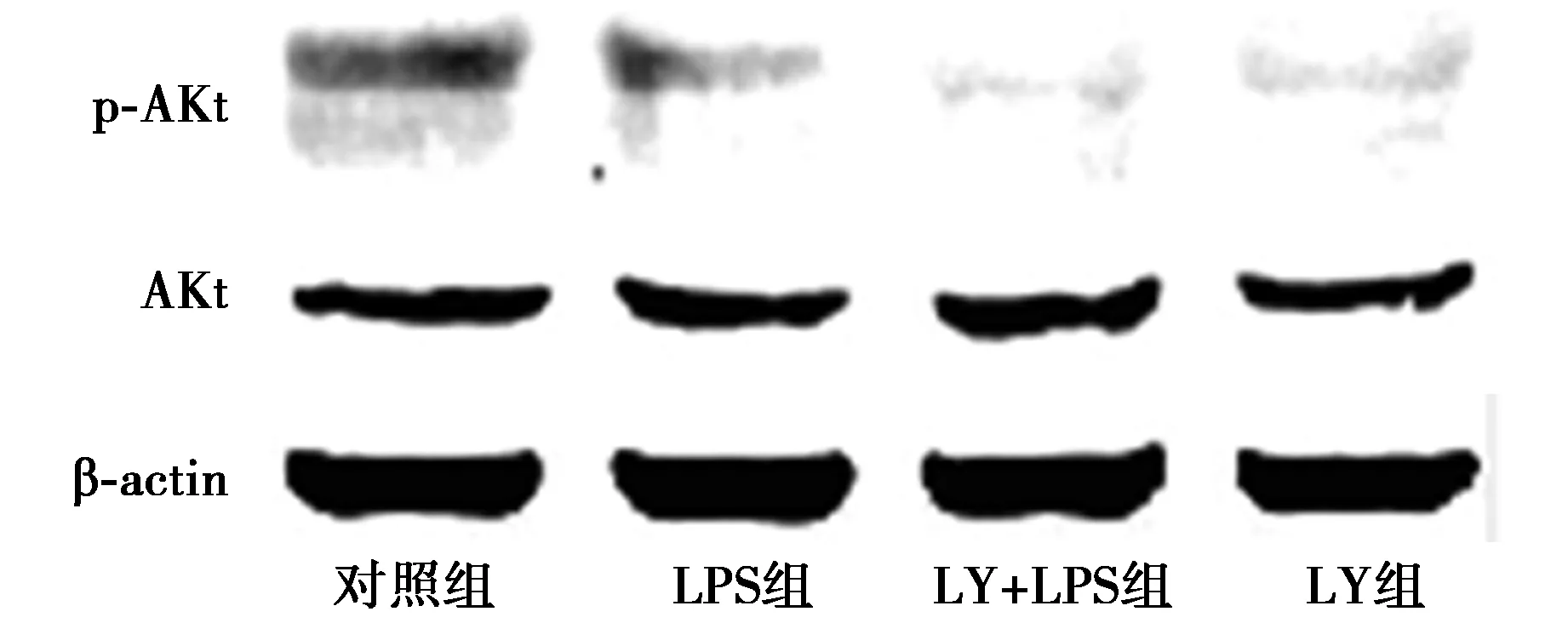
图1 Western印迹检测各组p-AKt、AKt蛋白表达
2.3抑制PI3K/AKt信号通路对iNOS表达的影响 LPS组iNOS蛋白表达显著高于对照组(P<0.01);LY+LPS组iNOS蛋白表达显著低于LPS组(P<0.01)。LY组iNOS蛋白表达显著低于LY+LPS组(P<0.01)。见图2,表1。

图2 Western印迹检测各组iNOS蛋白表达

表1 各组p-AKt/AKt、AKt、iNOS蛋白及IL-1β 、TNF-α mRNA表达水平比较
与对照组比较:1)P<0.01;与LPS组比较:2)P<0.01;与LY+LPS组比较:3)P<0.01
3 讨 论
PD是除了阿尔茨海默病外的第二大神经退行性疾病,多见于中老年人,但近年随着环境恶化,PD也逐渐年轻化。调查显示65岁以上PD患病率为1%,85岁以上PD患病率为5%〔10〕。目前尚无有效治疗PD的方法,针对PD症状治疗的药物也无法干预PD的进程,因此从PD的发病机制寻找治疗方法势在必行,小胶质细胞参与的神经炎症导致的多巴胺能神经元死亡在PD发病及其进程中发挥重要作用〔11〕。
PI3K/AKt信号通路除调节细胞增殖、分化、代谢、抗细胞凋亡等细胞生物学作用外,还能调节学习记忆能力。研究发现PI3K/AKt信号通路与PD的联系越来越紧密,PI3K/AKt信号在PD中存在通路抑制,而且神经保护药物也是通过该通路发挥作用,如:E3泛素连接酶c-Cb1抑制小胶质细胞介导的中枢神经系统炎症与PI3K/AKt信号通路有关〔12〕,法舒地尔在PD模型内也是通过PI3K/AKt信号通路依赖的方式来抑制炎症,从而发挥神经保护作用〔13〕。可以猜想单独激活PI3K/AKt信号通路也可以发挥一定抑炎及神经保护作用。
本研究中LPS刺激BV2细胞后产生炎症反应时出现PI3K/AKt信号通路的抑制,这与Dilshara等〔14〕的研究结果相一致。LY预处理抑制PI3K/AKt信号通路后则明显抑制LPS诱导的炎症反应,降低IL-1β、TNF-α mRNA表达水平;单独使用LY预处理抑制PI3K/AKt信号后则出现更为明显的炎症抑制效果;iNOS既作为促炎因子又作为氧化应激分子,在PD发病机制及加速神经死亡中发挥重要作用,LY预处理抑制PI3K/AKt信号通路后,不管是炎性反应激活中的iNOS蛋白,还是正常细胞中的iNOS蛋白表达均被明显抑制。单从文献报道的神经保护类药物可以通过PI3K/AKt信号通路来发挥对PD的神经保护作用来看,激活PI3K/AKt信号通路后应该会对PD起一定的有利作用,而本研究结果刚好与预想结果相矛盾,炎症反应中PI3K/AKt信号通路与PD的作用需进一步深入研究,也有可能与细胞的不同,药物预处理时间不同等有关。
综上所述,炎症反应中有PI3K/AKt信号通路的抑制,LY抑制PI3K/AKt信号通路后,可以明显抑制促炎因子的表达,具体的抑炎有待进一步研究查证,这为从炎性反应方向和PI3K/AKt信号通路研究PD提供了新的思考,为PD的临床治疗提供了理论基础。
