正五聚蛋白3对血管紧张素Ⅱ刺激后血管内皮细胞凋亡及血管活性物质分泌的影响
2019-05-10杨雁华汤建民来桂棵王丰云
杨雁华 汤建民 来桂棵 王丰云
(郑州大学第二附属医院心血管内科,河南 郑州 450000)
血管内皮细胞(HUVECs)是细胞和血液进行物质交换的机械屏障,其内分泌功能的改变或细胞损伤会导致内环境稳态的失衡,进而引发多种心血管疾病。作为多数心血管疾病的病理基础,动脉粥样硬化的发生机制十分复杂,HUVECs凋亡和损伤被认为是其形成的始动环节〔1〕。因此,如何改善HUVECs凋亡和损伤一直是防治动脉粥样硬化的研究热点。血管紧张素(Ang)Ⅱ是肾素-Ang系统中一种重要的血管活性因子,在诱导血管内皮细胞凋亡及损伤、增加内皮细胞通透性、调控血管活性物质分泌和血管收缩等方面发挥重要的作用,与多种心血管疾病的发生发展密切相关〔2~4〕。正五聚蛋白(PTX)3又称为肿瘤坏死因子刺激基因(TSG)14,是PTXs超家族中重要的急性期蛋白,PTX3能够与多种可溶性配体相结合,在免疫反应、炎症反应和细胞凋亡等方面发挥重要作用〔5~7〕。研究〔8,9〕报道,PTX3参与了动脉粥样硬化过程,但其对AngⅡ诱导的HUVECs凋亡及血管活性物质分泌的影响未见报道。本研究观察PTX3在AngⅡ诱导的HUVECs中的表达,并通过生物学手段干预其表达后,从HUVECs增殖、凋亡及对血管活性物质内皮素(ET)-1和诱导型一氧化氮合酶(iNOS)表达的角度观察PTX3对血管内皮细胞的调控作用,以期为以PTX3为靶点的抗动脉粥样硬化和心血管疾病治疗提供理论依据。
1 材料与方法
1.1材料 HUVECs购于美国ATCC 细胞库。青链霉双抗购于美国 Hyclone公司,胎牛血清购于杭州四季青公司,胰蛋白酶和 RPMI1640培养基购于美国Gibco 公司。AngⅡ和噻唑蓝(MTT)试剂购于美国Sigma公司。PTX3 siRNA和阴性对照序列购于美国Lafayette公司。Lipofectamine2000购于美国Invitrogen公司。PTX3抗体、β-actin抗体和辣根过氧化物酶标记二抗购于美国Santa Cruz公司。总蛋白提取试剂盒、总RNA提取试剂盒购于天根生化公司,电化学发光(ECL)试剂盒、二辛可宁酸(BCA)蛋白定量试剂盒和细胞凋亡检测试剂盒购于上海碧云天公司。酶标仪购于瑞士TECAN公司,紫外分光光度计购于上海光谱仪器公司,流式细胞仪和细胞培养箱购于美国Thermo公司。
1.2细胞培养及AngⅡ处理 采用含有10%胎牛血清和1%青链霉双抗的RPMI1640培养基于5% CO2、37℃及饱和湿度的培养箱中常规培养HUVECs。定期观察细胞状态,待细胞生长融合度达90%以上时,加入0.25%胰蛋白酶消化,并按1∶3比例传代。收集长势良好的第3代对数生长期细胞,调整细胞密度,以每孔105个细胞接种至96孔板上,常规条件下培养过夜。次日,以浓度为10-7mol/L AngⅡ分别刺激0、12、24和48 h。
1.3细胞分组及转染 取对数生长期的HUVECs,以每孔105个细胞接种至6孔板上,常规条件下培养24 h。次日,将细胞随机分为对照组、阴性组和干扰组三组,每组重复3次。按照Lipofectamine2000说明书步骤将PTX3 siRNA和阴性对照序列转染至干扰组和阴性组细胞中,其中PTX3 siRNA和阴性对照序列的终浓度为100 nmol/L,而对照组细胞不做转染。转染6 h后换液,加入终浓度为10-7mol/L AngⅡ刺激48 h后,收集各组细胞。
1.4Western印迹检测 采用总蛋白提取试剂盒提取HUVECs中的总蛋白,BCA蛋白定量试剂盒对所提取总蛋白进行定量。取蛋白样品60 μg,加入等体积上样缓冲液,混匀后沸水浴煮沸5 min。行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转膜。 取出聚偏氟乙烯(PVDF)膜,放入封闭液中常温反应2 h。加入1∶1 000倍稀释的PTX3特异性一抗4℃孵育过夜,再加入1∶10 000倍稀释的二抗(含5%脱脂牛奶)37℃孵育1 h。暗室内加入ECL试剂显影,凝胶成像系统扫描,Quantity one软件分析PTX3蛋白的表达量,以β-actin作为内参校正。
1.5MTT检测 取96孔细胞板,以每孔105个细胞接种至96孔板上,将细胞随机分为空白组(未做任何处理)、 AngⅡ组(10-7mol/L AngⅡ刺激)、 AngⅡ+siNC组(转染阴性对照序列后,给予10-7mol/L AngⅡ刺激)和 AngⅡ+siPTX3组(转染PTX3 siRNA后,10-7mol/L AngⅡ刺激),参照1.3中的方法转染各组细胞后,并给予10-7mol/L AngⅡ刺激。其中,每组细胞设置5个复孔。分别刺激24、48和72 h后,收集细胞,加入MTT溶液(浓度0.5 mg/ml)20 μl孵育4 h后,以二甲基亚砜100 μl震荡反应10 min。选取570 nm波长,酶标仪检测各组细胞的吸光度值(OD)。每组实验重复3次。
1.6流式细胞仪检测 收集空白组、 AngⅡ组、AngⅡ+siNC组和AngⅡ+siPTX3组细胞,以胰蛋白酶消化后,调整细胞浓度,制备浓度为106个/ml的细胞悬液。取细胞悬液1 ml,以磷酸盐缓冲液洗涤后,先加入结合缓冲液200 μl,再分别加入Annexin-V-异硫氰酸荧光素(FITC)和碘化丙啶(PI)各5 μl,避光条件下充分反应后,补加300 μl结合缓冲液。采用流式细胞仪检测各组细胞的凋亡率。
1.7实对聚合酶链反应(RT-PCR)检测 收集空白组、AngⅡ组、AngⅡ+siNC组和AngⅡ+siPTX3组细胞,采用RNA提取试剂盒提取总RNA,并经紫外分光光度计对总RNA进行定量。根据反转录试剂盒合成cDNA。以上海生工生物公司合成的ET-1引物(上游:5′-TCTGCCACCTGGACAT-3′,下游5′-CAGCCCTGAGTTCTTTT-3′)、iNOS引物(上游:5′-GGAAGCGGTAACAAAGGA-3′,下游5′-GCCAGCATAGCGGATG-3′)和β-actin引物(上游:5′-GGACCTGACTGACTACCTC-3′,下游5′-TACTCCTGCTTGCTGAT-3′)进行PCR扩增。扩增条件:95℃预变性3 min(1 个循环),95℃变性 30 s(35 个循环),59℃退火 30 s(35个循环),72℃延伸1 min(35 个循环),72℃ 总延伸5 min(1 个循环)。以β-actin为内参,利用2-△△Ct法计算ET-1和iNOS mRNA表达。
1.8数据处理 采用SPSS21.0软件进行单因素方差分析和SNK-q检验。
2 结 果
2.1AngⅡ刺激后各时间点HUVECs中PTX3的表达升高 与0 h(0.12±0.01)相比,12、24和48 h作用时间下PTX3蛋白表达(0.16±0.02、0.25±0.02、0.37±0.05)均明显升高(P<0.05),且在48 h作用时间下升高最明显。见图1。
2.2PTX3 siRNA下调HUVECs中PTX3的表达 与对照组(0.25±0.03)相比,阴性组细胞中PTX3 蛋白的相对表达量(0.22±0.02)无明显变化(P>0.05),但干扰组中PTX3 蛋白表达(0.10±0.01)明显降低(P<0.05)。见图2。
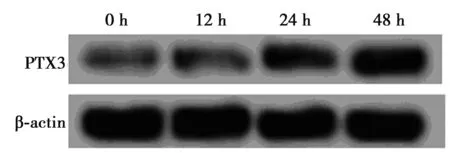
图1 AngⅡ刺激后不同时间HUVECs中PTX3表达
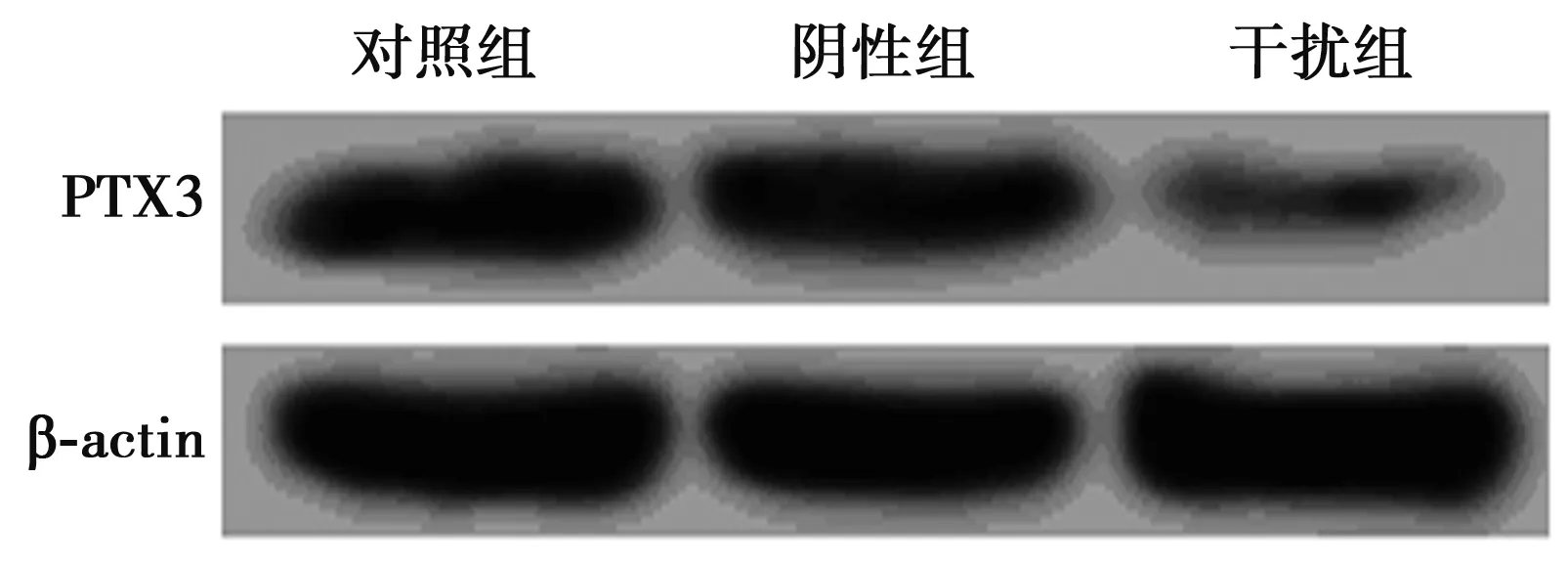
图2 PTX3 siRNA对HUVECs中PTX3表达的影响
2.3下调PTX3表达促进HUVECs增殖 相同作用时间下,与空白组相比,AngⅡ组、 AngⅡ+siNC组和AngⅡ+siPTX3组刺激不同时间细胞的OD值均明显降低(P<0.05),且AngⅡ+siPTX3组的下降幅度明显小于 AngⅡ组(P<0.05),而 AngⅡ+siNC组与AngⅡ组差异不显著(P>0.05)。见表1。

表1 各组刺激不同时间细胞的OD值
与空白组相比:1)P<0.05;与Ang Ⅱ组相比:2)P<0.05;下表同
2.4下调PTX3表达抑制HUVECs凋亡 与空白组(6.72%±2.26%)相比,AngⅡ组、 AngⅡ+siNC组和AngⅡ+siPTX3组细胞的凋亡率(23.35%±2.06%、22.85%±3.12%、13.31%±1.08%)均显著升高(P<0.05);同时,AngⅡ+siNC组与AngⅡ组细胞凋亡率无明显改变,而AngⅡ+siPTX3组较AngⅡ组显著降低(P<0.05)。见图3。

图3 流式细胞仪检测结果
2.5下调PTX3表达抑制HUVECs中ET-1和iNOS mRNA表达 与空白组相比,AngⅡ组、 AngⅡ+siNC组和AngⅡ+siPTX3组细胞中ET-1和iNOS mRNA表达水平均明显升高;与AngⅡ组相比,AngⅡ+siNC组细胞中ET-1和iNOS mRNA表达差异不显著(P>0.05),但AngⅡ+siPTX3组细胞中ET-1和iNOS mRNA表达明显降低(P<0.05)。见表2。

表2 各组细胞ET-1和iNOS mRNA相对表达量
3 讨 论
作为一种体态识别分子,PTX3可被内皮细胞、巨噬细胞和树突细胞等多种细胞在炎症因子如脂多糖、肿瘤坏死因子α和白细胞介素1β等刺激下产生,因其可识别多种配体,在先天免疫、组织修复和癌症等方面均发挥重要的调控作用〔10,11〕。PTX3在多种疾病组织或细胞中异常高表达,与多种细胞生理病理过程密切相关,被作为急性胰腺炎、脓毒症和肺癌等疾病的生物标志物或诊断指标〔12~14〕。
研究〔15,16〕报道,沉默PTX3表达可通过抑制巨噬细胞趋化迁移改善胃癌相关的炎症,而PTX3过表达则使食管癌细胞增殖和集落形成减少,凋亡率增加,改善肿瘤的发展。在炎症反应诱导的内皮细胞凋亡过程中常常伴随有PTX3基因表达升高〔17〕。张旦欢等〔18〕在高脂血症小鼠中尾静脉注射PTX3抗体后,可通过抑制核因子(NF)-κB通路下调血脂水平,减缓了动脉粥样硬化进展。有报道〔19〕指出,在氧化型低密度脂蛋白(ox-LDL)诱导的平滑肌细胞中PTX3表达升高,细胞增殖和迁移能力增强,PTX3参与了动脉粥样硬化的形成。本研究结果发现,PTX3表达呈时间依赖性升高。Qiu等〔20〕发现,厚朴酚通过抑制PTX3表达改善棕榈酸(PA)诱导的人脐静脉内皮细胞功能失调的结果与本文吻合。提示,PTX3可能在动脉粥样硬化进展中发挥促进作用。
内皮细胞还可通过释放血管活性物质如一氧化氮(NO)和ET-1等调控血管内皮细胞的功能。NO是由NO合酶(NOS)催化左旋精氨酸(L-Arg)氧化生成,在血管扩张、抑制血小板凝聚和血管平滑肌细胞的生长过程中发挥着重要作用;iNOS是NOS的一种异结构,iNOS激活可诱导高浓度NO合成,进而加重细胞损伤。ET-1则与NO作用相反,可以引起血管收缩,激活巨噬细胞,促进血管平滑肌细胞增殖和迁移,在动脉粥样硬化中发挥促进作用。Iba等〔21〕在慢性肾脏病患者内皮功能障碍的研究中发现,PTX3与ET呈正相关。Zhao等〔22〕指出,PTX3可通过介导的iNOS表达和Iκb激酶(IKK)/IκB/NF-κB活化加重动脉粥样硬化诱导的HUVEC损伤。提示,PTX3可能通过介导血管内皮细胞分泌NO和ET-1参与动脉粥样硬化。
综上,PTX3在AngⅡ刺激后HUVECs中表达升高,下调其表达可抑制AngⅡ诱导的细胞凋亡及血管活性物质分泌。PTX3有望成为防治动脉粥样硬化的靶标。
