金潮原因种铜藻外源无机碳利用特征初步研究
2019-05-10马增岭徐智广
刘 婷,马增岭,李 慧,徐智广
(1.温州大学生命与环境科学学院,浙江温州 325035;2.鲁东大学生命科学学院,山东烟台 264025)
固着生长的马尾藻(Sargassum)断裂后漂浮在海面上,暴发性生长而出现生物量大规模聚集在海水表面的生态现象称之为金潮[1]。近年来,墨西哥湾、西非、加勒比海、巴西等世界多地沿海海岸线频繁暴发金潮,而自2015年以来,漂浮马尾藻在我国黄海及东海近海发现频次和分布面积也呈大幅上升态势,2016年底江苏省暴发铜藻(Sargassum horneri)金潮,大量铜藻的堆积导致南通、盐城海域的紫菜养殖筏架大面积垮塌,对水产养殖业造成了毁灭性破坏。因而,继绿潮之后,金潮可能成为另一个对我国沿海地区造成巨大影响的生态灾害[2-3]。马尾藻金潮的形成与光照 、温度 、N/P营养、pH等环境因子的变化可能存在着一定的关系[3]。与此同时,人类活动导致的大气CO2浓度持续升高,使得海水碳酸盐系统发生改变,势必会影响金潮藻的光合固碳过程[4-5],而金潮藻对外源无机碳的吸收利用特点极可能影响着金潮的暴发与否。实际上,对淡水藻水华的研究已经证实,蓝藻水华从形成到暴发与蓝藻自身对外源无机碳的吸收利用关系密切[6]。
藻类进行光合作用的碳源主要来自海水中的溶解性无机碳[7]。海水中的无机碳形式主要有 CO2、和。绝大多数藻类可以通过跨膜扩散直接利用溶解在海水中的CO2,而有些藻类不仅可以利用海水中的CO2,还能够通过耗能的阴离子交换蛋白来实现对的直接利用,如石莼(Ulva lactuca)、长襄水云(Ectocarpus siliculosus)、掌状红皮藻(Palmaria palmata)和坛紫菜(Porphyra haitanensi)自由丝状体[8-11]。此外,还有些藻类在海水中可以经胞外碳酸酐酶(CA)将转化为 CO2再进行吸收利用,如条斑紫菜(Porphyra haitanensi)叶状体能够利用胞外碳酸酐酶催化海水中快速转化为CO2后将 其吸 收[12]。而在 细 基 江 蓠 (Gracilaria gaditana)中同时存在直接和间接两种利用方式[13]。因此,藻类利用主要有3种方式:利用阴离子交换蛋白的直接吸收、利用胞外碳酸酐酶的间接吸收以及同时具备以上两种方式[14]。由此可见,不同藻类具有不同的无机碳利用机制,而同一藻类可能同时具有多种无机碳利用途径[15]。
虽然关于大型海藻无机碳利用方面的研究在很多种类中已经做得较为深入[16-17],但对国内金潮原因种铜藻的相关研究目前仍比较缺乏。藻类主要是通过主动运输和/或被动跨膜扩散来吸收利用海水中的HCO-3和/或分子CO2,在这个过程中,藻体附近培养海水中的pH值会受到一定的影响。因此,可以通过测定密闭系统中海水pH值的变化(即pH漂移曲线)来衡量藻类的光合作用[18]。在光合作用测定时,TRIS缓冲液通常用于维持反应介质的恒定pH值。然而,有研究表明,缓冲液本身有时也可能抑制某些大型藻类如糖海带(Laminaria saccharina)、亨氏马尾藻(Sargassum henslowianum)等的光合固碳[19-20]。因此,本研究以铜藻为研究对象,对比研究不同pH值、TRIS缓冲剂及不同碳利用抑制剂对其光合固碳速率的影响,并探讨不同pH下的pH漂移曲线,以期揭示铜藻无机碳利用的基本特性,进而为铜藻金潮暴发机制的研究提供一定的理论参考。
1 材料与方法
1.1 材料
铜藻采自山东省荣成市近海漂浮种群,采集海区表层海水温度为18℃。采集之后将其放于低温箱(5℃)中于2 h内运回实验室。采集回的铜藻用自然海水洗净,选择健康及大小一致的个体在实验室内用自然海水暂养48 h后用于后续实验。自然海水的盐度为30,硝氮浓度为50.0 μmol·L-1,氨氮浓度为 0.3μmol·L-1,无机磷浓度为0.8μmol·L-1。暂养条件如下:温度为18℃,光照强度为150μmol photons·m-2·s-1,光周期为L∶D=12 h∶12 h,连续充气速率为2 L·min-1。
1.2 光合固碳速率的测定
藻体光合固碳速率用光合放氧速率(μmol O2·h-1·g-1FW)来表示,采用氧电极法测定。氧电极反应杯的温度通过低温恒温槽(NDC-0506,浙江纳德科学仪器有限公司)控制,温度为18℃。光源用碘钨灯提供,光强为600μmol photons·m-2·s-1,通过调整钨灯与反应杯的距离来获取,并使用光量子计(QRT1,英国Hansatech公司)测定。测定放氧速率时,选取藻体的小叶片部位,剪成长度约为1 cm的片段,为降低机械损伤对光合作用的影响,片段先置于原培养条件下恢复培养约1 h。称取0.15 g左右湿重的片段置于盛有8 mL无碳海水的反应杯内,插入氧电极(Chlorolab 3,Hansatech,UK),使其和海水之间无任何气泡。光照适应10 min左右来消耗掉藻体自身以及海水中的碳,当放氧速率为零时,藻体处于碳耗竭状态。再向反应杯内注入一定浓度的NaHCO3溶液作为铜藻的外源无机碳,待放氧速率稳定后,记录其单位时间内的放氧量。
无碳海水的配制(现配现用):向500 mL过滤灭菌海水中加入1∶1 HCl至pH小于4.0;通氮气2 h以驱除海水中的CO2气体;加入TRIS缓冲液使其终浓度为25 mmol·L-1;再使用浓度为1mmol·L-1的NaOH调节 pH为8.0,密封备用。pH值测定使用pH计(PHS-3CW,上海理达仪器厂),使用前校准。
1.3 不同p H、缓冲剂、抑制剂处理
取500 mL过滤灭菌海水(无机碳浓度为2.2 mmol·L-1),加入TRIS缓冲液,对照组不加缓冲液,使其终浓度为 25 mmol·L-1,以 1∶1 HCl和 1 mmol·L-1NaOH分别调节 pH为 6.5、8.0和9.5。称取湿重为0.15 g左右的片段,置于氧电极反应杯中,加入不同pH的灭菌自然海水8 mL,插入氧电极,打开光源,适应5 min待放氧稳定,待放氧速率稳定后,记录放氧速率。
称取湿重为0.15 g左右的片段,置于氧电极反应杯中,加入不同pH的灭菌自然海水8 mL,插入氧电极,打开光源,适应5 min待放氧稳定,加入碳酸酐酶抑制剂AZ、EZ及阴离子交换蛋白抑制剂 DIDS,AZ和 EZ终浓度为200μmol·L-1,DIDS的使用终浓度为300μmol·L-1,对照组中不加抑制剂。待放氧速率稳定后,记录放氧速率。抑制率的计算公式如下:
抑制率(%)=(对照组放氧速率-含抑制剂组放氧速率)/对照组放氧速率×100。
1.4 光合作用-无机碳响应曲线(P-C曲线)的测定
用氧电极(Chlorolab 3,Hansatech,UK)测定藻体光合放氧速率。将无碳海水注入反应杯中,于18℃、600μmol photons·m-2·s-1光强下注入不同浓度的NaHCO3溶液。无机碳浓度梯度设置为0.137 5、0.275 0、0.550 0、1.100 0、2.200 0、4.400 0、8.800 0、13.200 0、17.600 0 mmol·L-1。当反应杯内放氧速率为零时,测定光合放氧速率。得到光合放氧速率对无机碳浓度响应曲线(P-C曲线),用米氏方程对P-C曲线进行非线性拟合[21]:
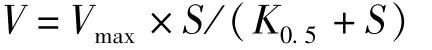
其中,V为光合固碳速率,Vmax为最大光合固碳速率,S为反应介质中总无机碳浓度,K0.5为达到最大光合固碳速率一半时对应的无机碳浓度,1/K0.5表示藻体对外源无机碳的亲和力。
1.5 pH漂移曲线(pH-drift)及pH补偿点的测定
称取0.5 g左右鲜重藻体置于25 mL的透光玻璃管中,并加入20 mL灭菌海水。分为4组:对照组(不加抑制剂)、添加AZ组、添加EZ组、添加DIDS组。密封后在温度为25℃、光强为150 μmol photons·m-2·s-1条件进行连续光照,每隔1 h测定培养海水的pH,直至pH值稳定不变为止,此pH值即为pH补偿点,所得曲线为pH漂移曲线(pH-drift)。光强通过光照培养箱(MGC-250P型,上海一恒科技有限公司)调节,pH测定使用pH计(PHS-3CW,上海理达仪器厂),使用前校准pH计。
1.6 统计分析
实验测定结果均表示为平均值±标准差(n≥3),数据运用 Excel和 SPSS来进行整理及统计分析,采用 origin 8.0(Origin,USA)作图。对测定结果进行正态化数据检验,均为正态分布数据,选用单因素方差分析(One-way ANOVA,Duncan)对测定结果进行差异性分析,差异显著性水平为 P<0.05。
2 结果与分析
2.1 缓冲液TRIS对铜藻光合固碳的影响
对照组铜藻光合固碳速率在pH值为6.5、8.0、9.5时分别为(59.62±2.35)、(33.70±1.51)、(12.48±0.32)μmol O2·h-1·g-1FW。TRIS缓冲液处理组铜藻的光合固碳速率在pH值为 6.5、8.0、9.5时分别为(58.66±1.87)、(33.38±1.76)、(12.26±0.18)μmol O2·h-1·g-1FW。对照组与TRIS缓冲液处理组铜藻的光合固碳速率无显著差异(P>0.05,图1),这一结果表明TRIS缓冲剂对铜藻的光合固碳速率无显著影响。同一处理组中,对照组和TRIS处理组铜藻的光合固碳速率均随着pH值的升高而下降,且在3种pH值处理组间光合固碳速率差异显著(P<0.05)。与对照组pH值6.5下的光合固碳速率相比,pH值升至8.0和9.5时,其光合固碳速率分别下降了43.47%和79.06%。

图1 不同pH值下TRIS缓冲液对铜藻光合固碳速率的影响Fig.1 Effects of TRIS buffer on the photosynthetic carbon fixation rates of Sargassum horneri under different pH levels注:不同小写字母表示数值之间存在显著差异(P<0.05)Note:Different lowercase letters indicate significant differences between values(P<0.05)
2.2 抑制剂AZ、EZ及DIDS对铜藻光合固碳的影响
同一pH值下,与对照组相比,加入抑制剂AZ、EZ和DIDS均显著抑制了铜藻的光合固碳速率(P<0.05),且抑制率为 AZ<EZ<DIDS(图2)。在pH值为6.5时,与对照组相比,加入AZ、EZ和DIDS分别使其光合固碳速率降低了7.32%、52.06%和 60.65%。在 pH值为 8.0时,加入AZ、EZ和DIDS分别使其光合固碳速率降低了10.44%、69.31%和77.86%。当 pH值进一步升至9.5时,加入AZ、EZ和DIDS分别使其光合固碳速率降低了25.64%、37.66%和57.29%。
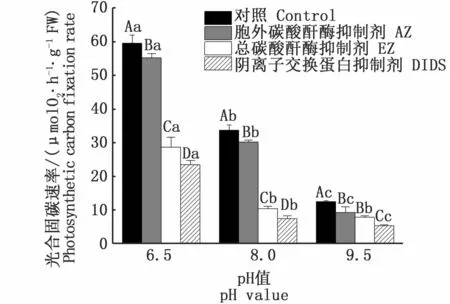
图2 不同pH值下抑制剂对铜藻光合固碳速率的影响Fig.2 Effects of inhibitors on the photosynthetic carbon fixation rates of Sargassum horneri under different p H levels注:不同大写和小写字母分别表示相同pH值下不同处理及不同pH下相同处理之间具有显著差异(P<0.05)Note:Different uppercase and lowercase letters indicate significant differences between different treatments at the same pH level and the same treatment at different pH levels(P<0.05)
当pH值为6.5时,抑制剂 AZ、EZ和DIDS对铜藻光合固碳速率的抑制率分别为7.25%、52.03% 、60.65% ;当 pH值为 8.0时,上述 3种抑制剂的抑制率分别为10.27%、69.32%、77.84% ;而当pH值为9.5时,其抑制率分别为25.38%、37.64%、57.24%(图 3)。可见在同一pH值下,抑制剂AZ、EZ和DIDS均显著抑制了铜藻的光合固碳速率(P<0.05)。在pH值为6.5和8.0时,AZ、EZ和 DIDS的抑制率存在显著差异(P<0.05);在 pH值为9.5时,AZ和 EZ的抑制率无显著差异(P>0.05),但 AZ、EZ的抑制率均与DIDS存在显著差异(P<0.05)。同一抑制剂处理时,AZ的抑制率随着pH的增加而增加,但在3种pH处理组间无显著性差异(P>0.05)。EZ和DIDS的抑制率随着pH的增加先增加后减少,且均在pH值8.0时达到最大抑制率,且3种pH值下的抑制率存在显著性差异(P<0.05,图3)。
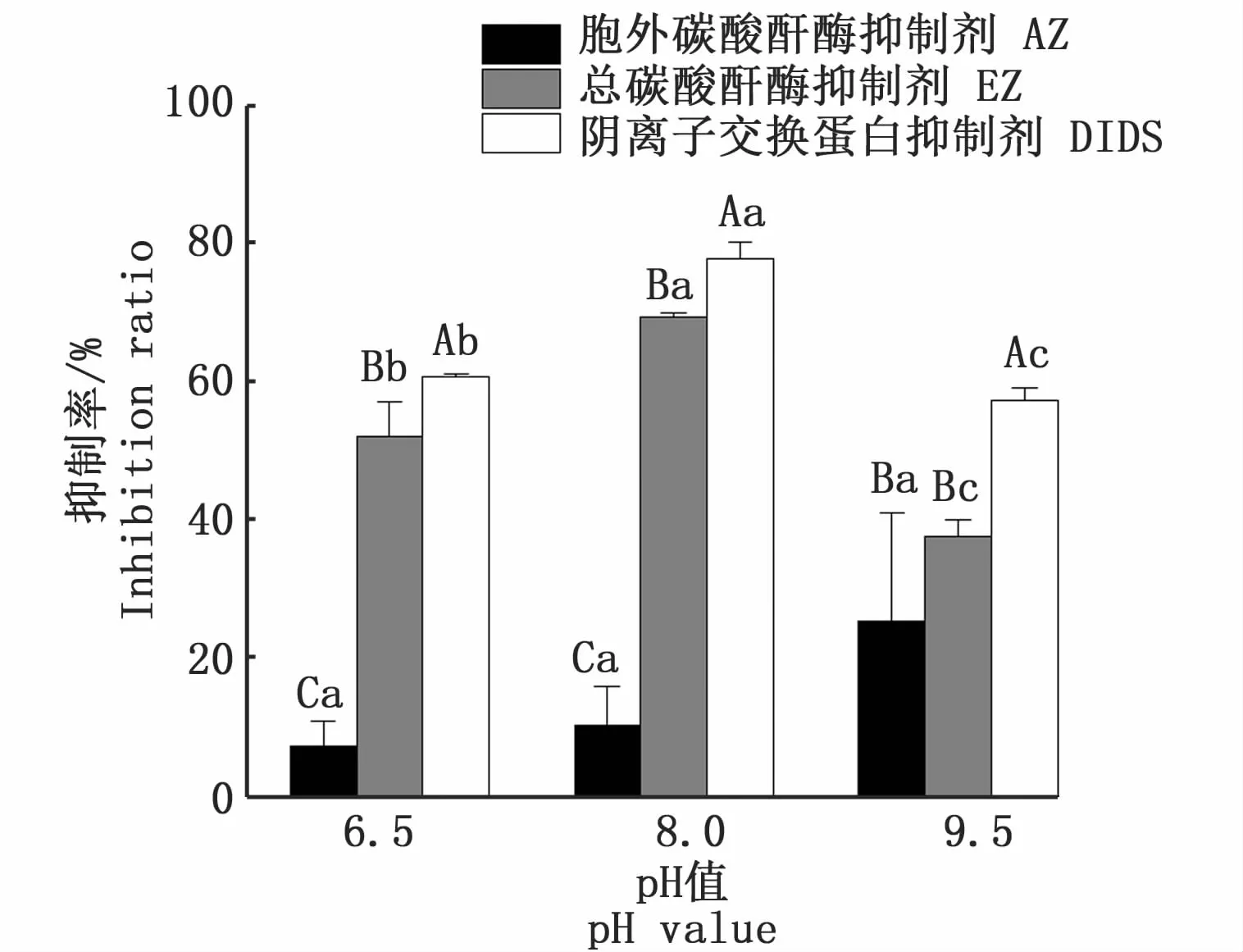
图3 不同p H值下3种抑制剂对铜藻光合固碳速率的抑制率Fig.3 Inhibition ratio of three inhibitors on the photosynthetic carbon fixation rates of Sargassum horneri under different pH levels注:不同大写和小写字母分别表示相同pH值下不同处理及不同pH值下相同处理之间具有显著差异(P<0.05)Note:Different uppercase and lowercase letters indicate significant differences between different treatments at the same pH level and the same treatment at different pH levels(P<0.05)
2.3 不同p H值下铜藻光合固碳对无机碳(Ci)浓度的响应
铜藻的光合固碳速率在各pH值条件下均随着外源无机碳浓度的升高而升高,并渐趋饱和(图4)。在pH值为6.5时,其光合放氧速率在无机碳浓度为2.2 mmol·L-1时达到饱和;在pH值8.0和9.5时,其光合放氧速率均在无机碳浓度为 8.8 mmol·L-1时达到饱和。在 pH值为6.5、8.0、9.5时,铜藻的最大光合固碳速率(Vmax)分别为(88.24±4.36)、(82.85±4.86)、(61.78±2.98)μmol O2·h-1·g-1FW;Vmax在 pH值为6.5和8.0时差异不显著(P>0.05),但两者均与pH值9.5的 Vmax有显著性差异(P<0.05,表1)。光合固碳表观半饱和常数 K0.5(DIC)是用来表示细胞光合作用对外源无机碳的亲和力,K0.5(DIC)越小,亲和力越大,即细胞达到最大光合固碳速率需要外源无机碳浓度越小。铜藻光合固碳的半饱和常数 K0.5(DIC)随着 pH的增大而增大,在 pH值为6.5、8.0、9.5时分别为(1.31±0.25)、(1.61±0.35)、(1.91±0.33)mmol·L-1(表 1)。与 pH值 6.5下的 K0.5(DIC)相比,pH值升至 8.0、9.5时,其 K0.5(DIC)升高了 22.90%和 45.80%。
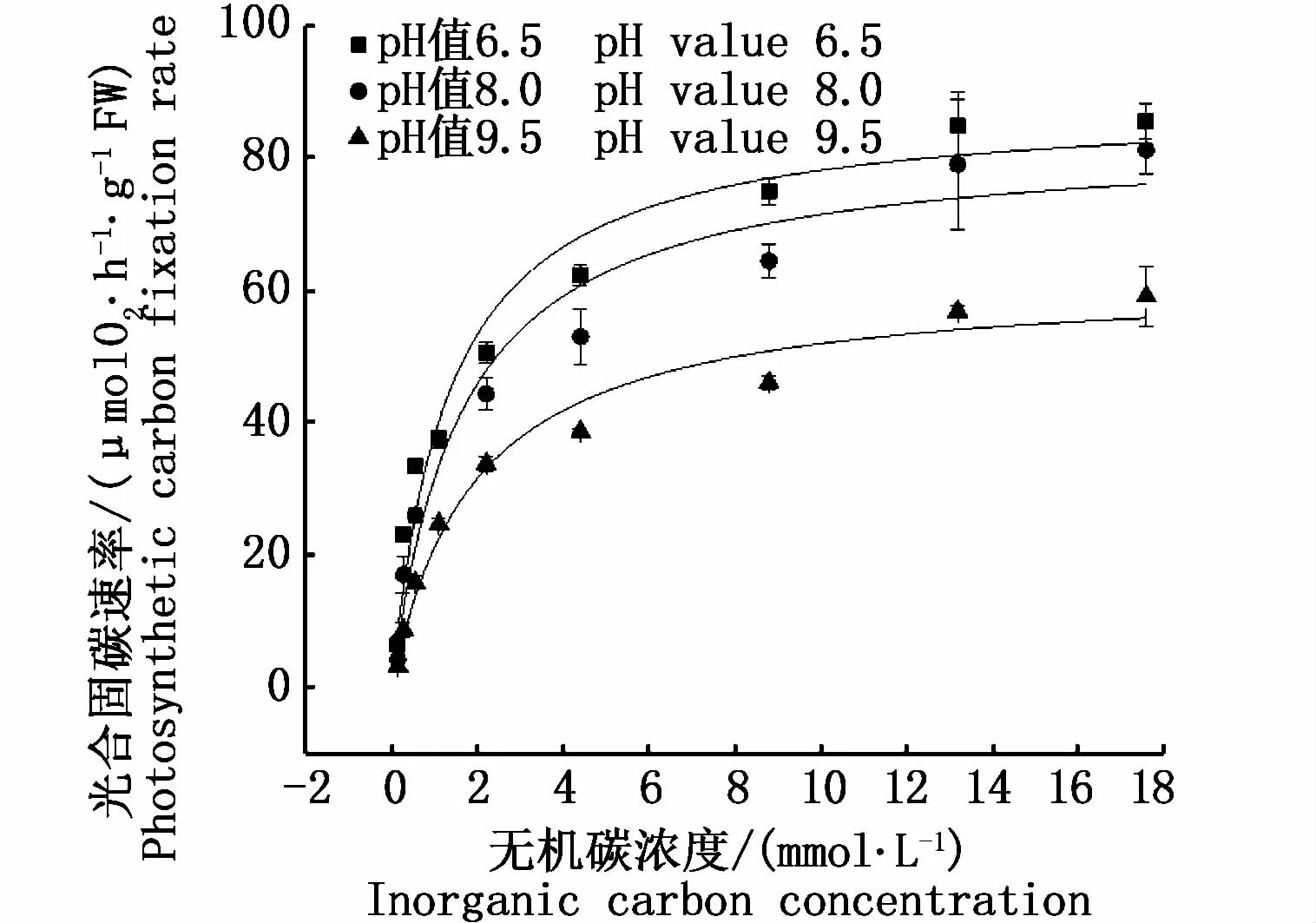
图4 不同p H值下铜藻光合固碳速率对无机碳升高的响应Fig.4 Responses of photosynthetic carbon fixation rate of Sargassum horneri to inorganic carbon concentration changes under different p H levels
2.4 不同pH值下铜藻的pH漂移曲线及p H补偿点
添加铜藻的各密闭系统中海水的pH值随着照射时间的增加而升高,并在6 h趋于稳定(图5)。在对照组中,海水的pH值稳定在9.0;加入抑制剂AZ和EZ的处理,海水的pH值分别稳定在8.89和8.66;而加入抑制剂 DIDS的处理,海水pH值稳定在8.56。在同一时间下,铜藻的pH值补偿点大小依次为:对照组>AZ>EZ>DIDS。
3 讨论

图5 不同抑制剂对铜藻pH漂移曲线的影响Fig.5 Effects of different inhibitors on pH-drift curves of Sargassum horneri
本研究中,铜藻的光合放氧速率未受pH缓冲剂TRIS的影响(图1),这与之前报道的石莼、紫菜[19]、龙须菜(Gracilaria lemaneiformis)[22]和海黍子(Sargassum muticum)[17]的研究结果类似。因此,本研究在调节pH时选用TRIS缓冲剂。有研究表明,海水中游离的CO2浓度会随着pH值的改变而改变[23],且海水的pH值与游离CO2浓度呈反比,即 pH值升高,游离 CO2浓度则下降[24],有报道称,CO2浓度升高和 pH值降低能提高龙须菜吸收CO2占总无机碳利用的比例[25]。在海水 pH值从6.5上升到 8.0再上升到9.5的过程中,海水中游离的CO2浓度从1 000 μmol·L-1降低到 15μmol·L-1再降到接近 0 μmol·L-1[23]。本研究中,pH值由 8.0降至6.5,CO2的浓度升高,铜藻的光合放氧速率显著升高(图2);而 pH值由 8.0升到 9.5,CO2的浓度降低,铜藻的光合放氧速率显著下降(图2)。表明铜藻对CO2有相当高的亲和力,进行光合固碳过程中能够直接利用海水中游离的CO2。另一方面,pH值大于8.0的海水中,外源无机碳存在的形式为HCO-3,本研究中铜藻仍然可以进行光合固碳,并且光合固碳速率随着无机碳浓度的升高而升高(图4),进一步表明高pH条件下,铜藻可以利用海水中的HCO-3来进行光合固碳,这与在海带目(Laminariales)中的研究结果类似[26]。

表1 不同pH值下铜藻的最大光合固碳速率(V max)和半饱常数(K0.5)Tab.1 Carbon-saturating maximum photosynthetic carbon fixation rate(V max)and half saturation constant(K0.5)of Sargassum horneri under different pH levels
碳酸酐酶(CA)由于其分布位置不同,分为胞外碳酸酐酶(periplasmic CA,pCA)和胞内碳酸酐酶[27]。添加碳酸酐酶抑制剂AZ、EZ及阴离子交换蛋白抑制剂DIDS都使得铜藻的光合固碳速率和pH补偿点显著降低(图2,图5)。这是因为碳酸酐酶对藻类吸收利用HCO-3极其重要[24],碳酸酐酶的作用是将HCO-3快速转化成CO2以此来供应光合固碳作用[27]。AZ为胞外碳酸酐酶抑制剂只抑制pCA的活性,pCA主要作用是催化藻体细胞表面的HCO-3转变为CO2;EZ为总的碳酸酐酶抑制剂,能够同时抑制胞内和胞外CA两者的活性[28]。本研究中,加入碳酸酐酶抑制剂AZ抑制了pCA活性,细胞表面的HCO-3转变为CO2这一过程受到抑制,导致进入细胞内的无机碳量减少,而加入EZ同时抑制胞内和胞外CA两者的活性,导致藻体整体的光合固碳速率降低。因此,抑制作用EZ显著大于AZ(图3)。证实了铜藻可以通过pCA把HCO-3催化为CO2后再吸收利用。这一现象在海带、海黍子、坛紫菜中也存在[16-17,29]。
除此之外,阴离子交换蛋白酶也可以直接作用HCO-3使其转化为藻类的无机碳源,而DIDS抑制了阴离子交换蛋白酶的活性,从而抑制无机碳的利用[30],本研究中铜藻的光合固碳速率显著下降。同时,与胞外碳酸酐酶催化HCO-3相比,阴离子交换蛋白直接吸收 HCO-3的效率更高[31]。有报道称,掌状红皮藻(Palmaria palmate)在自然海水中主要通过pCA吸收外源无机碳,但当藻体处于高pH碳限制环境一段时间后,藻体将主要通过阴离子交换蛋白酶直接吸收HCO-3[32],因环境pH的差异导致藻体无机碳的利用机制有所不同[33-34]。有研究报道,海带、海黍子等大型海藻中阴离子交换蛋白抑制剂DIDS在高pH条件下具有较高抑制率[16-17]。该结论在本研究中也得到了证实,pH值为9.5时DIDS的抑制率最高(图4)。这也表明铜藻存在高效的HCO-3直接吸收方式。
藻体在密闭系统进行光合作用会消耗海水中的CO2,导致CO2浓度下降,海水pH升高。因此,也可以用pH补偿点的变化来探究藻体无机碳的利用[20]。有研究表明,密闭系统进行的pH漂移实验中,那些能够利用培养液中HCO-3的藻类 pH补偿点通常大于 9.0[35-36]。本研究中,经过一段时间后,培养铜藻的海水pH值最终稳定在9.0左右(图5)。与此同时,3种抑制剂都导致了铜藻的pH补偿点下降,进一步证明铜藻在进行光合固碳过程中可以直接吸收利用HCO-3。这一方式是大型海藻无机碳利用的重要途径[37]。
4 小结
本研究显示,我国近海金潮原因藻铜藻的光合固碳速率随着pH值的升高而降低,TRIS缓冲液对铜藻光合固碳速率无显著影响;3种抑制剂AZ、EA和DIDS显著抑制了铜藻光合固碳速率,且抑制率排序为DIDS>EZ>AZ;与此同时,铜藻在光合固碳进程中,既可以利用海水中游离的CO2,也可以直接利用阴离子交换蛋白吸收HCO-3,还可以利用胞外碳酸酐酶把HCO-3催化为CO2再进行吸收利用。铜藻光合固碳过程中存在的多种无机碳利用方式可使其在断裂漂浮后迅速吸收海水中的外源无机碳用于快速生长,最终可能导致铜藻金潮的暴发。
