人工合成甘蓝型油菜抗旱性及DNA甲基化水平分析
2019-05-09方婷婷蒋金金王幼平
袁 溢 朱 双 方婷婷 蒋金金 王幼平
人工合成甘蓝型油菜抗旱性及DNA甲基化水平分析
袁 溢 朱 双 方婷婷 蒋金金*王幼平
扬州大学生物科学与技术学院, 江苏扬州 225009
甘蓝型油菜是具有重要经济价值的多倍体物种, 是优质食用植物油和饲料蛋白质的重要来源之一。但是其驯化历史较短, 遗传背景狭窄, 且在整个生命周期中都对干旱胁迫敏感, 因此培育高产耐旱品种是甘蓝型油菜的重要育种目标之一。本文用15% PEG-6000模拟干旱胁迫, 对人工合成甘蓝型油菜不同世代(S1~S4)及其二倍体亲本进行不同时间的胁迫处理, 并结合表型观察, 以及叶片中丙二醛(MDA)、可溶性蛋白含量、过氧化物酶(POD)、超氧化物歧化酶(SOD)等生理指标的测定, 初步了解上述材料的抗旱性差异。结合表型观察和叶片中相对含水量分析, 发现人工合成甘蓝型油菜S1~S4及其亲本的抗旱性表现为甘蓝 > Bn-S3> Bn-S4> Bn-S1> Bn-S2> 白菜型油菜。干旱胁迫后Bn-S3、Bn-S4的POD及SOD活性较高, MDA含量较低, 表明Bn-S3和Bn-S4能更加有效地清除活性氧(ROS), 对过氧化损伤的防御能力更强。通过HPLC分析发现所有材料的甲基化水平在胁迫12 h时最高, 其中亲本白菜型油菜Br的甲基化水平最高, Bn-S1和Bn-S4介于两亲本之间, 而Bn-S2和Bn-S3低于两亲本。甲基化敏感多态性分析也显示人工合成甘蓝型油菜在干旱胁迫后, 甲基化和去甲基化水平均发生了明显的变化, 表明植物的甲基化变化可能有利于提高其抗旱能力。
人工合成甘蓝型油菜; 白菜型油菜; 甘蓝; 干旱胁迫; DNA甲基化
植物在生长过程中会持续受到一系列外界环境信号的影响和刺激, 包括非生物(如水、光、营养物质等)和生物因素(如与其他生物体之间的相互作用)。在适应不同的环境条件中, 植物进化出一套用于感知和转导外部信号的分子机制和复杂的信号网络[1]。缺水造成的干旱胁迫会严重影响植物的形态结构和生理功能, 影响其生长、发育和繁殖, 是导致作物产量严重损失的主要非生物胁迫之一[2-3], 是目前农作物生长面临的最大问题之一, 也是所有非生物逆境中最亟待解决的。Tardieu等[4]研究发现植物会通过叶片卷曲、气孔关闭等降低失水速率, 以减少干旱胁迫时的水分流失。同时植物还能够通过体内积累各种有机质和无机物质, 增加细胞液的浓度, 降低细胞渗透势, 提高在缺水条件下的保水力, 使干旱复原能力增强[5]。如果在生长早期受到干旱胁迫, 植物会提前从营养生长阶段过度到生殖生长阶段, 从而规避干旱带来的危害[6]。此外, 植物能够启动一系列复杂的酶和非酶抵御系统[7], 以维持细胞内氧化还原反应的动态平衡。因此, 明确干旱胁迫对农作物生理和生长的影响, 对于提高植物抗旱性、培育抗旱品种、降低干旱对植物的影响以及提高农作物产量具有重要意义[8]。
甘蓝型油菜(, AACC, 2=38)是十字花科芸薹属中具有重要经济价值的物种, 是优质食用植物油和饲料蛋白质的重要来源之一。Zhu等[1]发现甘蓝型油菜在整个生命周期中都对干旱胁迫敏感。干旱胁迫不但影响种子的油脂成分, 降低含油量, 影响油菜籽品质[9], 而且会严重影响甘蓝型油菜的产量, 制约其种植面积。因此, 培育高产耐旱品种是甘蓝型油菜的重要育种目标之一[10]。研究表明, 干旱对甘蓝型油菜的不同生长发育阶段具有不同的影响, 花期至种子发育成熟阶段是甘蓝型油菜对干旱的敏感时期[11-13]。干旱会促进内源ABA合成, 而ABA可以促进叶片气孔关闭, 减少水分流失, 同时促进根部发育, 增加根系和土壤的接触面积, 增加水分吸收[14-15]。ABA介导的信号传导途径与植物逆境应答响应密切相关。拟南芥()中过表达ABA信号途径中的MYB转录因子后, 会使表达下调, 最终导致转基因拟南芥的耐旱性降低[16]。此外, 干旱诱导植物内源ABA含量提高会促进脯氨酸的积累[11], 而脯氨酸的积累可以调节渗透势、降低细胞酸性、保持细胞内环境稳态, 从而增强植物的抗旱能力[17]。Di等[18]发现甘蓝型油菜的和受干旱诱导上调表达, 表明BnPYL蛋白可能参与甘蓝型油菜对干旱胁迫的响应。目前, 甘蓝型油菜响应干旱胁迫的遗传调控机制仍有待深入探索。
多倍化对植物的生长发育及胁迫响应具有重要影响。多倍体与相应的二倍体相比具有更好的农艺性状、更强的耐逆性和抗病性[19-20]。Ramsey等[21]对欧蓍草(的田间实验表明, 在沙丘栖息地中六倍体比四倍体具有5倍的适应性优势。Allario等[22]研究表明四倍化甜橙()比其二倍体亲本更耐干旱胁迫。Eliášová等[23]发现四倍体野豌豆()可通过改变株高来增强对干旱胁迫的适应性, 将生物质更多地分配到种子生产方面, 以减少局部灭绝。此外, Manzaneda等[24]发现短柄草()对干旱胁迫的承受能力与倍性有关。对拟南芥的研究表明多倍体可能与环境挑战或变化的时期相关[25], 多倍化有助于提高植物的应激能力和适应性, 尤其能够提高作物的耐逆性。
由于甘蓝型油菜的驯化历史短, 其遗传资源与亲本相比较为狭窄。因此, 研究者们根据芸薹属禹氏三角关系, 以白菜型油菜(, AA, 2=20)和甘蓝(, CC, 2=18)为亲本合成异源四倍体甘蓝型油菜, 以拓宽其遗传基础, 为选育具有优良抗逆性状的种质资源奠定基础[26]。研究表明, 人工合成甘蓝型油菜较非合成种质具有更丰富的遗传多样性[27]。此外, 人工合成甘蓝型油菜具有丰富的基因(gene presence/absence variation), 其中包括与抗病性、开花时间相关的基因[28]。李勤菲等[29]利用六倍体(AnAnCnCnCoCo)与白菜型油菜杂交, 发现7个杂种的菌核病抗性均高于亲本, 且杂种苗期具有丰富的表型变异。Ran等[30]比较不同世代的人工合成甘蓝型油菜, 发现后期世代的甲基化水平高于早期世代。目前, 关于人工合成甘蓝型油菜及其亲本的抗旱性差异, 以及干旱胁迫后DNA甲基化水平变化的研究尚未见报道。本研究通过PEG模拟干旱胁迫, 比较不同胁迫时间对人工合成甘蓝型油菜及其亲本的表型及生理指标的影响, 结合干旱胁迫处理前后的甲基化水平分析, 以了解甘蓝型油菜多倍化对其抗旱性的影响, 为全面了解多倍化对植物抗旱性的影响及其生理和分子机制奠定重要的基础。
1 材料与方法
1.1 材料及干旱胁迫处理
将人工合成甘蓝型油菜不同世代(S1~S4)及其亲本白菜型油菜(Br)品种“矮抗青”、甘蓝(Bo)品种“中花芥蓝”在同等条件下(蛭石为介质, 25℃, 16 h光照/8 h黑暗光周期, 70%相对湿度)生长35 d。用ddH2O清洁幼苗根部后转移到1/2 MS液体培养基中。1 d后, 将所有植株移入含有15% PEG-6000的1/2 MS液体培养基中, 分别胁迫0、6、12、24 h后取3棵植株的叶片混样, 并保存于-80℃备用。
1.2 相对含水量(RWC)和相对保水力测定(RWR)
根据Barrs等[31]方法测定RWC和RWR。
1.3 丙二醛(MDA)含量测定
采用改良的硫代巴比妥酸(TBA)方法[32], 测定样品在450nm、532nm、600nm处的吸光值。C (µmolL–1) = 6.45 (A532 nm-A600 nm)-0.56×A450 nm;(µmolg–1) =*/。其中,(µmol g–1)为单位鲜重组织中MDA含量,(µmol L–1)为MDA浓度,为提取液的体积,为植物组织鲜重(g)。
1.4 可溶性蛋白含量测定
用100 mmol L–1pH 7.0磷酸缓冲液将1 mL提取液稀释至5 mL, 分别在260 nm、280 nm下检测其吸光度[33]。蛋白浓度(mg mL–1) = 1.45 × A280 nm-0.74 × A260 nm; 蛋白含量= (1.45 × A280 nm-0.74 × A260 nm)×/样品重× 100%, 其中为稀释倍数。
1.5 过氧化物酶(POD)活性的测定
称取0.5 g叶片混样, 用8 mL 50 mmol L–1预冷磷酸缓冲液(pH 7.8)冰浴研磨至匀浆, 1000转min–1、4℃离心20 min。上清液(50 μL)中依次加入1.5 mL 100 mmol L–1磷酸缓冲液(pH 7.8)、1.5 mL 0.1%愈创木酚, 30℃恒温水浴反应5 min。反应产物中加入1 mL 0.08% H2O2, 混匀后在470 nm处测定其吸光度值, 每隔1 min记录1次, 以每分钟A470 nm增加0.01为一个酶活性单位(U)。POD活性(U g–1) = ΔA470 nm× VT/(0.01××VS×)。其中ΔA470 nm为反应时间内吸光度的变化,为样品鲜重(g),为反应时间(min), VT为提取酶液总体积(mL), VS为测定时所用酶液总体积(mL)。
1.6 超氧化物歧化酶(SOD)活性的测定
根据Giannopolitis等[34]的方法测定SOD活性。
1.7 基因组DNA甲基化水平的HPLC分析
使用CTAB法提取纯化植物基因组DNA, 参照Ran等[30]的方法用HPLC分析全基因组DNA甲基化水平。
1.8 甲基化敏感多态性(MSAP)分析
根据Xiong等[35]的方法分析MSAP, 所用引物与谢涛等[36]相同。
2 结果与分析
2.1 干旱胁迫后植物的表型变化
经过不同时间的干旱胁迫后, 人工合成甘蓝型油菜不同世代(S1~S4)及其二倍体亲本幼苗表现出不同的变化(图1)。胁迫处理6 h时, Br出现叶片萎蔫、发黄的现象, 人工合成四倍体后代与父本甘蓝(Bo)无明显变化; 12 h时, Br植株叶片萎蔫、发黄的现象更加明显, S1~S4植株开始出现不同程度叶片萎蔫、发黄、叶边缘卷曲的现象。处理24 h时, Bo植株叶片依然鲜绿挺立, 其余植物叶片均明显萎蔫、发黄。

图1 干旱胁迫后植物的表型
Br: 白菜型油菜; Bo: 甘蓝; S1~S4: 人工合成甘蓝型油菜自交后代。
Br:; Bo:; S1–S4: progenies of resynthesized.
12 h干旱胁迫后, 所有植物的RWC和RWR均降低。其中, Br的RWC降低比Bo明显, 四倍体后代中Bn-S2下降最明显, Bn-S1其次, Bn-S3和Bn-S4降低最小。RWR的结果与之相似, 干旱胁迫前后Br和Bn-S4均最低, Bo和Bn-S1较高, Bn-S2下降最明显(图2)。上述结果表明, 四倍体后代及其亲本的抗旱性强弱为Bo>Bn-S3>Bn-S4>Bn-S1>Bn-S2>Br。
2.2 干旱胁迫后植物的生理指标变化
胁迫处理6 h和12 h时, 所有植物的POD活力均呈上升趋势; 24 h时, POD活力降至与0 h基本一致的水平。在整个处理过程中, Bn-S1和Bn-S3的POD活力介于两亲本之间, Bn-S4的POD活力最高, 而Bn-S2的POD活力与Br相似(图3-A)。Bn-S3、Bn-S4及Bo的MDA水平始终保持较为平稳的低水平, 其中Bn-S4的MDA含量最低; 而Bn-S1、Bn-S2及Br的MDA水平受胁迫影响较为明显, 其中Bn-S2在胁迫6 h时的MDA含量显著高于双亲(图3-B)。此外, 在胁迫12 h时, 所有植物的SOD活性均为最低值。与POD酶活力相似, 不同时间胁迫处理后, Bn-S3和Bo的SOD活性一直保持在相对较高水平(图3-C)。所有植物在胁迫处理24 h时可溶性蛋白含量明显提高, 而Bn-S4在胁迫12 h时可溶性蛋白含量达到最大值(图3-D)。以上结果表明, 多倍化的杂种后代Bn-S3和Bn-S4能够更有效地清除ROS, 对过氧化损伤的防御能力更强, 对生物膜及细胞生命的保护作用更强, 因此Bn-S3、Bn-S4可能具有更强的耐旱性。

图2 干旱胁迫12 h后植物的相对含水量和相对保水力
CK: 对照; DT: 干旱胁迫; Br: 白菜型油菜; Bo: 甘蓝; S1~S4: 人工合成甘蓝型油菜自交后代。
CK: control; DT: drought stress; Br:; Bo:; S1-S4: progenies of resynthesized.

图3 干旱胁迫处理下植物的生理指标分析
A: 过氧化物酶活力; B: 丙二醛含量; C: 超氧化物歧化酶活力; D: 可溶性蛋白含量。平均值±标准误,= 3。Br: 白菜型油菜; Bo: 甘蓝; S1~S4: 人工合成甘蓝型油菜自交后代。
A: POD activity; B: MDA content; C: SOD activity; D: soluble protein. Average value ± SD,= 3. Br:; Bo:; S1-S4: progenies of resynthesized.
2.3 干旱胁迫后植物的DNA甲基化水平
随着胁迫处理时间的增加, 所有植物的甲基化水平都发生了明显变化。干旱胁迫0 h时, S1~S4的甲基化水平介于双亲之间。而处理6 h后, Bn-S1和Bn-S2的甲基化水平低于双亲, Bn-S3和Bn-S4的甲基化水平介于双亲之间。12 h后, 所有植物的甲基化水平均达到最高值, 且Br的甲基化水平最高, Bn-S1和Bn-S4介于双亲之间, 而Bn-S2和Bn-S3低于双亲。处理24 h后, 所有植物的DNA甲基化水平降低, S1~S4的甲基化水平均介于双亲之间, 其中Bn-S1和Bn-S3的DNA甲基化水平高于Bn-S2和Bn-S4。另外, 经过不同时间的干旱胁迫处理后, Bo的甲基化水平变化幅度最小, 相对最稳定, 其次分别是Bn-S2和Bn-S3; Bn-S2的甲基化水平一直较低; 而Br、Bn-S1、Bn-S4的甲基化水平波动幅度较大(图4)。
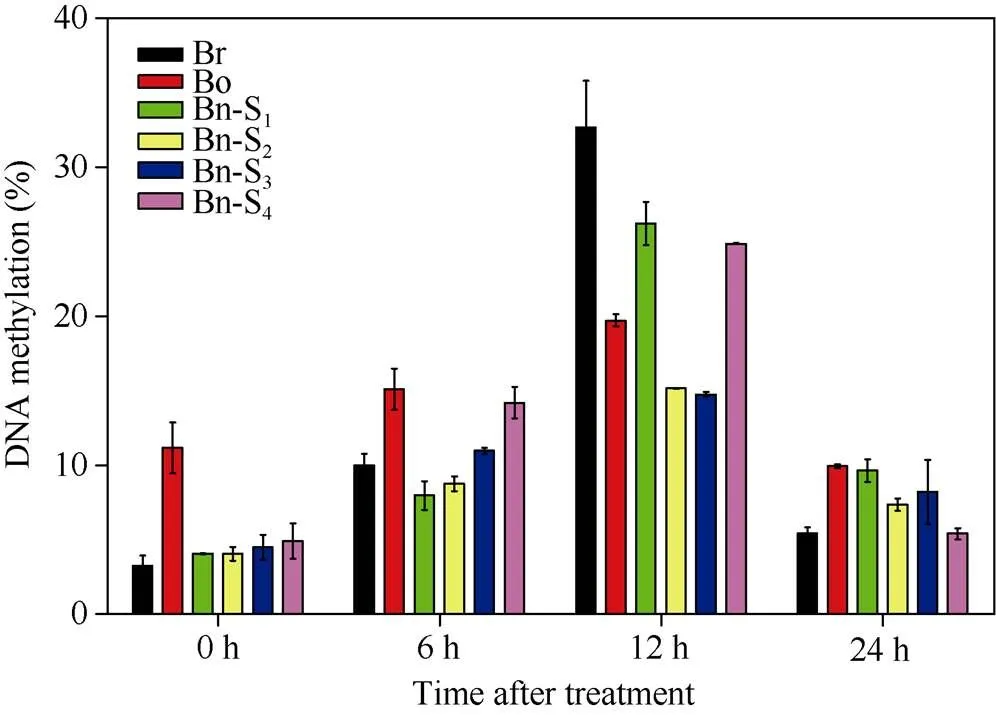
图4 干旱胁迫处理下植物DNA甲基化水平的变化
Br: 白菜型油菜; Bo: 甘蓝; Bn-S1~S4: 人工合成甘蓝型油菜自交后代。
Br:; Bo:; Bn-S1-S4: progenies of resynthesized.
通过MSAP分析, 本研究比较了人工合成甘蓝型油菜S1~S4及其二倍体亲本在不同时间干旱胁迫后的DNA甲基化变化(图5, 表1~表3)。
Br的甲基化(hypermethylation/methylation)水平随着胁迫时间的增加而降低, 而Br在胁迫12 h的去甲基化(hypomethylation/demethylation)水平最高。Bo在胁迫24 h后的甲基化水平最高, 其去甲基化水平随着胁迫时间的增加而降低。不同胁迫时间下, Bo的甲基化水平均高于Br, 而去甲基化水平均低于Br, 这可能与亲本的抗旱性差异有关。随着胁迫时间的增加, Bn-S1和Bn-S2的甲基化水平均有所下降, 而去甲基化水平均有所增加; Bn-S3的甲基化水平随胁迫而增加, 且12 h干旱胁迫时的甲基化和去甲基化水平均达到最高; Bn-S4的甲基化水平明显增加, 而去甲基化水平明显降低。此外, 胁迫6 h和12 h时, 与Bn-S3和Bn-S4相比, Bn-S1和Bn-S2的平均甲基化水平较高, 去甲基化水平均较低。而干旱胁迫24 h的甲基化水平为Bo>Bn-S4>Bn-S2>Bn-S1>Bn-S3>Br, 去甲基化水平为Bn-S3>Bn-S2>Bn-S1>Bn-S4>Br>Bo。上述甲基化修饰水平的差异也可能与材料间的抗旱性差异有关。

图5 干旱胁迫处理下植物中不同类型DNA甲基化修饰的百分比
Br: 白菜型油菜; Bo: 父本甘蓝; Bn-S1~S4: 人工合成甘蓝型油菜自交后代。
Br:; Bo:; Bn-S1-S4: progenies of resynthesized.

3 讨论
植物在整个生命周期中会持续受到一系列外界环境信号的影响, 也会不可避免地遭遇恶劣的环境条件, 包括生物和非生物胁迫。干旱胁迫是影响植物生长发育和生产的环境因素之一[37]。甘蓝型油菜在受到干旱胁迫时会产生对细胞的高渗胁迫, 极端情况下会降低光合作用和产量[38]。因此, 培育具有耐旱性和高产量的品种对于改良我国油菜供求不平衡的现状尤为重要[39]。在不适环境中, 植物进化出具有适应性的生理变异和信号传导机制[1], 尤其是感知和应对干旱胁迫的复杂信号调控网络[40]。
3.1 干旱胁迫后植物的表型变化
本研究通过观察植物萎蔫程度来直接鉴定其抗旱性, 发现胁迫6 h时Br出现叶片萎蔫、发黄的现象, 而S1~S4在12 h时才开始出现不同程度的叶片萎蔫发黄、叶边缘卷曲。同时所有植物的RWC和RWR均降低, 其中Br的RWC降低最明显, Bn-S2和Bn-S1其次, Bn-S3和Bn-S4的降低最小, RWR的结果与之相似。而RWC和RWR是反映植物抗旱性的重要指标, 与植物抗旱性呈正相关。此外, 在整个胁迫处理过程中, Bo叶片一直鲜绿挺立, 且在胁迫12 h后的RWC和RWR的降低幅度最小。因此, 四倍体后代及其亲本的抗旱性为Bo>Bn-S3>Bn-S4>Bn-S1> Bn-S2>Br。
3.2 干旱胁迫后植物的生理指标变化
大多数植物获得了在胁迫条件下引起的活性氧(ROS)积累的防御机制[41-42], 且植物在受到干旱胁迫时, 酶和非酶抗氧化剂会相应变化, 以保护自身免受应激诱导的氧化损伤[43], 其中POD能够有效清除植物体内过量的ROS[44], 减少植物受到的氧化损伤。本研究中, 干旱胁迫处理早期, 所有植物的POD活性呈现上升趋势, 12 h时达到峰值, 24 h后POD活力下降, 推测12 h的干旱胁迫可能接近甘蓝型油菜的胁迫敏感时间。不同时间的干旱胁迫处理下, Bn-S1和Bn-S3的POD活性介于亲本之间, Bn-S4的POD活性最高。说明S1~S4清除ROS的能力优于Br, 对过氧化损伤的防御能力更强。Ahmad等[45]报道SOD和MDA是植物体内的氧化应激标记物, 其含量可以反映植物遭受逆境伤害的程度。其中MDA含量在一定范围内越高, 则表明植物受伤害程度越重, 抗逆能力越低; 而SOD的增加和积累可以增强植物细胞的保水能力。Akram等[46]报道干旱胁迫后甘蓝型油菜可溶性蛋白含量显著降低, MDA含量和POD活性降低, SOD活性不受影响。对萝卜[47]、花椰菜[48]、小麦[49]、欧李[50]等的研究表明, 植物能够通过增加抗氧化活性来改善对干旱胁迫的耐受性。本研究发现MDA含量与POD活性相反, 经过不同时间的干旱处理后, Bn-S3和Bn-S4的MDA含量均低于Br、Bn-S1和Bn-S2, 这与Xia等[51]的结果一致, 表明Bn-S3和Bn-S4受到的氧化胁迫压力较小。此外, 不同时间的干旱胁迫后, 所有植物的可溶性蛋白含量都有所增加, 在24 h时均达到最大值, 且在干旱处理12 h时, Bn-S4的可溶性蛋白含量高于亲本及其他杂种后代, 这可能利于调节细胞渗透, 增强细胞的保水力。
3.3 干旱胁迫后植物的DNA甲基化水平
植物多倍化后除了农艺性状和生理生化方面之外, 还可能诱导基因组、转录组和表观遗传中的一系列变化[52]。以DNA甲基化为核心的表观遗传修饰参与基因表达、基因组稳定性和适应性的平衡, 这对于作物性状改良十分重要[53]。Fang等[54]报道了异源四倍体棉花的进化、多样性和双重驯化事件, 使其兼具双亲的优势, 生产力和纤维质量大大提高。此外, 关于人工合成甘蓝型油菜及其亲本的DNA甲基化水平变化已有报道[36], 且研究表明DNA甲基化变化在多倍体物种形成过程中是可传递的[55]。目前, 关于人工合成甘蓝型油菜在胁迫处理下的甲基化水平相关的研究报道较少。本研究的HPLC数据显示, 干旱胁迫6 h和12 h时, 所有植物的DNA甲基化水平均呈现上升趋势, 而胁迫24 h时的甲基化水平均明显下降。干旱胁迫处理6 h后, Bn-S1和Bn-S2的甲基化水平低于两亲本, Bn-S3和Bn-S4的甲基化水平介于两亲本之间。胁迫处理12 h后, 所有植物的甲基化水平均达到最高值, 其中Br的甲基化水平最高, Bn-S1和Bn-S4的甲基化水平介于两亲本之间, 而Bn-S2和Bn-S3的甲基化水平低于两亲本。MSAP分析结果显示, 干旱胁迫处理6 h后, Bn-S1与Bn-S2的甲基化水平也明显高于亲本, 而去甲基化水平均低于两亲本; Bn-S3与Bn-S4的甲基化和去甲基化水平与Bn-S1和Bn-S2相反。胁迫处理12 h后, Bn-S1的甲基化水平明显高于双亲, 其去甲基化水平低于双亲。干旱胁迫后, 杂种后代及其二倍体亲本均发生大量甲基化变化(甲基化和去甲基化), 推测甲基化修饰水平的变化与后代的抗性有关。这些甲基化水平的差异可能与多倍化过程中基因组的稳定性相关。上述甲基化修饰水平的差异可能引起相关基因表达水平的差异, 其中可能包括参与干旱胁迫应答的相关基因。具体哪些基因的甲基化修饰差异可能与上述材料的抗旱性差异相关, 还有待于对胁迫前后的全基因组甲基化水平深入分析, 具体了解每个基因上存在的甲基化修饰位点及其可能参与的生物学路径, 从而为了解甘蓝型油菜多倍化过程中抗旱性的差异奠定基础。
4 结论
初步了解了人工合成甘蓝型油菜不同世代在干旱胁迫下的抗旱性差异, 以及不同胁迫处理时间下二倍体亲本及人工合成甘蓝型油菜不同世代的甲基化修饰水平的差异, 为了解甘蓝型油菜多倍化过程中的抗旱性变化奠定了基础。
[1] 朱健康, 倪建平. 植物非生物胁迫信号转导及应答. 中国稻米, 2016, 22(6): 52–60. Zhu J K, Ni J P. Abiotic stress signaling and responses in plants., 2016, 22(6): 52–60 (in Chinese with English abstract).
[2] 王汉中, 殷艳. 我国油料产业形势分析与发展对策建议. 中国油料作物学报, 2014, 36: 414–421. Wang H Z, Yin Y. Analysis and strategy for oil crop industry in China., 2014, 36: 414–421 (in Chinese with English abstract).
[3] Zhu M, Assmann S M. Metabolic signatures in response to abscisic acid (ABA) treatment inguard cells revealed by metabolomics., 2017, 7: 12875–12890.
[4] Tardieu F. Plant response to environmental conditions: assessing potential production, water demand, and negative effects of water deficit., 2013, 4: 17–27.
[5] 纪瑞鹏, 车宇胜, 朱永宁, 梁涛, 冯锐, 于文颖, 张玉书. 干旱对东北春玉米生长发育和产量的影响. 应用生态学报, 2012, 23: 3021–3026. Ji R P, Che Y S, Zhu Y N, Liang T, Feng R, Yu W Y, Zhang Y S. Impacts of drought stress on the growth and development and grain yield of spring maize in northeast China., 2012, 23: 3021–3026 (in Chinese with English abstract).
[6] Luo L J. Breeding for water-saving and drought-resistance rice (WDR) in China., 2010, 61: 3509–3517.
[7] Fang Y J, Xiong L Z. General mechanisms of drought response and their application in drought resistance improvement in plants., 2015, 72: 673–689.
[8] 王娅玲, 李维峰. 干旱胁迫对植物生长及其生理的影响概述. 南方农业, 2015, 9(6): 37. Wang Y L, Li W F. Summary of effects of drought stress on plant growth and physiology., 2015, 9(6): 37 (in Chinese).
[9] Enjalbert J N, Zheng S S, Johnson J J, Mullen J L, Byrne P F, McKay J K. Brassicaceae germplasm diversity for agronomic and seed quality traits under drought stress., 2013, 47: 176–185.
[10] 焦靖芝, 谢伶俐, 李小龙, 田志宏, 许本波. 甘蓝型油菜耐旱机理研究进展. 湖北农业科学, 2015, 54: 773–777.Jiao J Z, Xie L L, Li X L, Tian Z H, Xu B B. Drought tolerance in rapeseed (L) oil., 2015, 54: 773–777 (in Chinese with English abstract).
[11] Mailer R J, Cornish P S. Effects of water stress on glucosinolate and oil concentrations in the seeds of rape (L.) and turnip rape (L. var.[Lam.] Briggs)., 1987, 27: 707–711.
[12] Tesfamariam E H, Annandale J G, Steyn J M. Water stress effects on winter canola growth and yield., 2010, 102: 658–666.
[13] Ma Q, Turner D W. Osmotic adjustment segregates with and is positively related to seed yield in F3lines of crosses betweenandsubjected to water deficit., 2006, 46: 1621–1627.
[14] Danquah A, Zelicourt A D, Colcombet J, Hirt H. The role of ABA and MAPK signaling pathways in plant abiotic stress responses., 2014, 32: 40–52.
[15] Balestrini S, Vartanian N. Rhizogenic activity during water stress-induced senescence invar.., 1983, 21: 269–277.
[16] Jaradat M R, Feurtado J A, Huang D Q, Lu Y Q, Cutler A J. Multiple roles of the transcription factor AtMYBR1/AtMYB44 in ABA signaling, stress responses, and leaf senescence., 2013, 13: 192–210.
[17] Szabados L, Savouré A. Proline: a multifunctional amino acid., 2010, 15: 89–97.
[18] Di F F, Jian H J, Wang T Y, Chen X P, Ding Y R, Du H, Lu K, Li J N, Liu LZ. Genome-wide analysis of thegene family and identification ofgenes that respond to abiotic stress in, 2018, 9: 156–173.
[19] Luo Q X, Peng M, Zhang X L, Lei P, Ji X M, Wahsoon C, Meng F J, Sun G Y. Comparative mitochondrial proteomic, physiological, biochemical and ultrastructural profiling reveal factors underpinning salt tolerance in tetraploid black locust (L.)., 2017, 18: 648–670.
[20] Fomeju B F, Falentin C, Lassalle G, Manzanares-Dauleux M J, Régine D. Comparative genomic analysis of duplicated homoeologous regions involved in the resistance ofto stem canker., 2015, 6: 772–785.
[21] Ramsey J. Polyploidy and ecological adaptation in wild yarrow., 2011, 108: 7096–7101.
[22] Allario T, Brumos J, Colmenero-Flores J M, Iglesias D J, Pina J A, Navarro L, Talon M, Ollitrault P, Morillon R. Tetraploid Rangpur lime rootstock increases drought tolerance via enhanced constitutive root abscisic acid production., 2013, 36: 856–868.
[23] Eliášová A, Münzbergová Z. Factors influencing distribution and local coexistence of diploids and tetraploids of: inferences from a common garden experiment., 2017, 130: 677–687.
[24] Manzaneda A J, Rey P J, Bastida J M, Weiss-Lehman C, Raskin E, Mitchell-Olds T. Environmental aridity is associated with cytotype segregation and polyploidy occurrence in(Poaceae)., 2012, 193: 797–805.
[25] Novikova P Y, Hohmann N, Van de Peer Y. Polyploidspecies originated around recent glaciation maxima., 2018, 42: 8–15.
[26] Xu Y, Xu H, Wu X, Fang X, Wang J. Genetic changes following hybridization and genome doubling in synthetic., 2012, 50: 616–624.
[27] Golicz A A, Bayer P E, Barker G C, Edger P P, Kim H, Martinez P A, Chan C K K, Severn-Ellis A, McCombie W R, Parkin I A P, Paterson A H, Pires J C, Sharpe A G, Tang H B, Teakle G R, Town C D, Batley J, Edwards D. The pangenome of an agronomically important crop plant., 2016, 7: 13390–13397.
[28] Gabur I, Chawla H S, Liu X W, Kumar V, Faure S, Tiedemann A, Jestin C, Dryzska E, Volkmann S, Breuer F, Delourme R, Snowdon R, Obermeier C. Finding invisible quantitative trait loci with missing data., 2018, doi:10.1111/ pbi.12942.
[29] 李勤菲, 陈致富, 刘瑶, 梅家琴, 钱伟. 六倍体(AnAnCnCnCoCo)与白菜型油菜杂交可交配性及后代菌核病抗性. 中国农业科学, 2017, 50: 123–130.Li Q F, Chen Z F, Liu Y, Mei J Q, Qian W. Crossability andresistance among hybrids between hexaploid (AnAnCnCnCoCo) and., 2017, 50: 123–130 (in Chinese with English abstract).
[30] Ran L P, Fang T T, Rong H, Jiang J J, Fang Y J, Wang Y P. Analysis of cytosine methylation in early generations of resynthesized., 2016, 15: 1228–123.
[31] Barrs H D, Weatherley P E. A re-examination of the relative turgidity technique for estimating water deficits in leaves., 1968, 15: 413–428.
[32] Hodges D M, Delong J M, Forney C F, Prangel R K. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds., 1999, 207: 604–611.
[33] Snyder J C, Desborough S L. Rapid estimation of potato tuber total protein content with coomassie brilliant blue G-250., 1978, 52: 135–139.
[34] Giannopolitis C N, Ries S K. Superoxide dismutases: II. Purification and quantitative relationship with water-soluble protein in seedlings (of corn, peas, and oats)., 1977, 59: 315–318.
[35] Xiong L Z, Xu C G, Saghai Maroof M A, Zhang Q F. Patterns of cytosine methylation in an elite rice hybrid and its parental lines, detected by a methylation-sensitive amplification polymorphism technique., 1999, 261: 439–446.
[36] 谢涛, 戎浩, 蒋金金, 孔月琴, 冉丽萍, 吴健, 王幼平. 人工合成甘蓝型油菜及其亲本的甲基化变异模式分析. 作物学报, 2016, 42: 513–524. Xie T, Rong H, Jiang J J, Kong Y Q, Ran L P, Wu J, Wang Y P. Analysis of DNA methylation patterns in resynthesizedand diploid parents., 2016, 42: 513–524 (in Chinese with English abstract).
[37] Valliyodan B, Nguyen H T. Understanding regulatory networks and engineering for enhanced drought tolerance in plants., 2006, 9: 189–195.
[38] Qaderi M M, Kurepin L V, Reid D M. Growth and physiological responses of canola () to three components of global climate change: temperature, carbon dioxide and drought., 2006, 128: 710–721.
[39] Joshi R, Wani S H, Singh B, Bohra A, Dar Z A, Lone A A, Pareek A, Singla-Pareek Sneh L. Transcription factors and plants response to drought stress: current understanding and future directions., 2016, 7: 1029–1043.
[40] Nagahatenna D S K, Langridge P, Whitford R. Tetrapyrrole-based drought stress signalling., 2015, 13: 447–459.
[41] Shao H B, Chu L Y, Jaleel C A, Manivannan P, Panneerselvam R, Shao M A. Understanding water deficit stress-induced changes in the basic metabolism of higher plants-biotechnologically and sustainably improving agriculture and the ecoenvironment in arid regions of the globe., 2009, 29: 131–151.
[42] Liu D, Pei Z F, Naeem M S, Ming D F, Liu H B, Khan F, Zhou W J. 5-Aminolevulinic acid activates antioxidative defence system and seedling growth inL. under water-deficit stress., 2011, 197: 284–295.
[43] Shafiq S, Akram N A, Ashraf M, Arshad A. Synergistic effects of drought and ascorbic acid on growth, mineral nutrients and oxidative defense system in canola (L.)plants., 2014, 36: 1539–1553.
[44] Mittler R, Vanderauwera S, Gollery M, Gollery M, Breusegem F V. Reactive oxygen gene network of plants., 2004, 9: 490–498.
[45] Ahmad J, Bashir H, Bagheri R, Baig A, Al-Huqail A, Ibrahim M M, Qureshi M I. Drought and salinity induced changes in ecophysiology and proteomic profile of., 2017, 12: e0185118.
[46] Akram N A, Iqbal M, Muhammad A, Ashraf M, Al-Qurainy F, Shafiq S. Aminolevulinic acid and nitric oxide regulate oxidative defense and secondary metabolisms in canola (L.) under drought stress., 2018, 255: 163–174.
[47] Shafiq S, Akram N A, Ashraf M. Does exogenously-applied trehalose alter oxidative defense system in the edible part of radish (L.) under water-deficit conditions?, 2015, 185: 68–75.
[48] Latif M, Akram N A, Ashraf M. Regulation of some biochemical attributes in drought-stressed cauliflower (L.) by seed pretreatment with ascorbic acid., 2016, 91: 129–137.
[49] Caverzan A, Passaia G, Rosa S B, Ribeiro C W, Lazzarotto F, Margis-Pinheiro M. Plant responses to stresses: role of ascorbate peroxidase in the antioxidant protection., 2012, 35: 1011–1019.
[50] Ren J, Sun L N, Zhang Q Y, Song X S. Drought tolerance is correlated with the activity of antioxidant enzymes inseedlings., 2016, 2016: 2038–2047.
[51] Xia L J, Yang L Q, Sun N L, Li J, Fang Y J, Wang Y P. Physiological and antioxidant enzyme gene expression analysis reveals the improved tolerance to drought stress of the somatic hybrid offspring ofand, at vegetative stage., 2016, 38: 1–10.
[52] Wang T, Huang D Y, Chen B Y, Mao N N, Qiao Y S, Ji M X. Differential expression of photosynthesis-related genes in pentaploid interspecific hybrid and its decaploid ofspp., 2018, 40: 321–331.
[53] Jiao J, Wu J, Lyu Z, Sun C, Gao L, Yan X, Cui L, Tang Z, Yan B, Jia Y. Methylation-sensitive amplified polymorphism-based genome-wide analysis of cytosine methylation profiles incultivars., 2015, 14: 15177–15187.
[54] Fang L, Gong H, Hu Y, Liu C X, Zhou B L, Huang T, Wang Y K, Chen S Q, Fang D D, Du X M, Chen H, Chen J D, Wang S, Wang Q, Wan Q, Liu B L, Pan M Q, Chang L J, Wu H T, Mei G F, Xiang D, Li X H, Cai C P, Zhu X F, Chen Z J, Han B, Chen X Y, Guo W Z, Zhang T Z, Huang X H. Genomic insights into divergence and dual domestication of cultivated allotetraploid cottons., 2017, 18: 33–45.
[55] Song Q X, Zhang T Z, Stelly D M, Chen Z J. Epigenomic and functional analyses reveal roles of epialleles in the loss of photoperiod sensitivity during domestication of allotetraploid cottons., 2017, 18: 99–112.
Analysis of drought resistance and DNA methylation level of resynthesized
YUAN Yi, ZHU Shuang, FANG Ting-Ting, JIANG Jin-Jin*, and WANG You-Ping
College of Bioscience and Biotechnology, Yangzhou University, Yangzhou 225009, Jiangsu, China
, as one of the important resources of edible plant oil and forage protein, is a polyploid species with great economic value. However, it is sensitive to drought stress throughout whole lifecycle due to short domestication history and narrow genetic background. Thus, it is a main purpose to breedcultivar with high yield and drought resistance. In the present study, we compared the drought resistance among S1–S4generations of resynthesizedand diploid parents under different time periods of 15% PEG-6000 treatment. The different drought tolerance levels were assessed based on phenotype observation, leaf physiological indexes (MDA, soluble protein, SOD and POD). Accompanying with water content analysis, we found the drought tolerance showed a trend of> Bn-S3> Bn-S4> Bn-S1> Bn-S2>. Under drought stress, POD and SOD activities in Bn-S3and Bn-S4were higher than these in other plants tested, and MDA content was decreased, indicating that Bn-S3and Bn-S4have better ability in clearing ROS, and defending from peroxidation damage. On the basis of HPLC analysis, the methylation level in all materials was the highest under drought stress of 12 h. And the methylation level inwas higher than that in others, that in Bn-S1and Bn-S4was between that in parents, while that in Bn-S2and Bn-S3was lower than that in parents. Methylation sensitive amplification polymorphism analysis also revealed multiple changes in methylation and demethylation level of resynthesizedunder drought stress, indicating methylation changes might be involved in plant drought tolerance.
resynthesized;;; drought stress; DNA methylation
2018-09-09;
2018-12-24;
2019-01-17.
10.3724/SP.J.1006.2019.84120
蒋金金, E-mail: jjjiang@yzu.edu.cn, Tel: 0514-87997303
E-mail: yuanyi0668@163.com
本研究由国家自然科学基金项目(31771824, 31771825), 中国和江苏省博士后科学基金项目(2014M561719, 2015T80591, 1401078B)资助。
This study was supported by the National Natural Science Foundation of China (31771824, 31771825), China and Jiangsu Postdoctoral Science Foundation (2014M561719, 2015T80591, 1401078B).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20190116.1554.002.html
