强闪光抑制棉花叶片光系统II活性和热耗散
2019-05-09吴含玉张亚黎姜闯道张旺锋
吴含玉 肖 飞 张亚黎 姜闯道 张旺锋,*
强闪光抑制棉花叶片光系统II活性和热耗散
吴含玉1,3肖 飞1张亚黎2姜闯道3,*张旺锋2,*
1石河子大学生命科学学院, 新疆石河子 832003;2石河子大学农学院 / 新疆生产建设兵团绿洲生态农业重点实验室, 新疆石河子 832003;3中国科学院植物研究所/ 北方资源植物重点实验室, 北京 100093
除持续强光导致光合作用效率降低外, 强闪光也能够影响光合功能, 但规律和机制尚不清楚。为研究强闪光对喜光植物棉花叶片光合功能的影响, 选用陆地棉(L.)品种新陆早45号为材料, 于强闪光处理(20,000 µmol m–2s–1, 300 ms, 间隔10 s, 处理时间持续30 min)前后分别测定叶绿素荧光、P700和气体交换。结果表明, 强闪光处理后不仅有活性的PSI (光系统I)反应中心含量下降, 同时PSII (光系统II)电子传递活性也受到限制。与对照相比, 强闪光处理后PSI的ND(PSI供体侧限制引起的非光化学量子产量)下降,NA(PSI受体侧限制引起的非光化学量子产量)增加, 暗示强闪光能够抑制PSI受体侧电子传递活性。强闪光处理不仅使PSII的实际量子产量明显下降, 而且非光化学猝灭和NPQ(PSII调节性能量耗散的量子产量)也降低; 但是,NO(PSII非调节性能量耗散的量子产量)明显增加, 表明强闪光导致热耗散降低和PSII失活。此外, 强闪光处理后光合速率和气孔导度均降低, 但细胞间隙CO2浓度增加, 证明强闪光处理后同化能力的降低不是气孔限制导致的。因此, 本研究认为强闪光处理不仅抑制PSI活性, 而且导致PSII失活和可调节性热耗散下降; 光合电子传递活性的下降可能是强闪光下光合速率降低的重要原因。
棉花; 强闪光; 光抑制; 光合作用; 电子传递
光是植物光合作用的能量来源, 较高的光合速率是作物加快生长、提高生物量和产量的基础。但是, 光照强度超过植物光合作用所能利用的范围时会导致光合效率下降, 即产生光抑制[1]。这时PSII的电子传递活性降低幅度远大于PSI[2], 因此强光下PSII容易发生光抑制, 而PSI光抑制较少[3]。一方面, PSII的光损伤可能与放氧复合体猛簇的破坏有关; 另一方面, 强光下活性氧(ROS)也会通过抑制PSII反应中心的修复进而导致PSII失活[4-5]。
在高等植物中PSII对强光等逆境环境更敏感, 但也有研究认为PSI有时会取代PSII成为主要的光抑制位点[6-10]。冷敏感植物黄瓜、甜椒等叶片在低温胁迫条件下PSI优先发生光抑制, 而PSII的光抑制程度则很轻[6,11-12]。这些实验是在弱光和低温交互作用下开展的, 所以PSI的光抑制也是发生在弱光下, 而非强光伤害。近期研究表明, 使用强闪光处理向日葵叶片很容易诱导PSI失活, 其中PSI以O2依赖的方式受到伤害, 而对PSII影响很小[13]。也有研究认为一系列闪光处理时PSI和PSII光化学活性均降低, 只是对PSII活性的影响相对较小[14]。很显然, 强闪光能够伤害PSI, 但是否以及多大程度上伤害PSII还存在争议。
前人对稳态强光以及光斑条件下光合作用的光抑制研究较多, 很多结论也是在此基础上得出的。田间条件下由于风的作用作物叶片经常发生高频摆动, 导致作物叶片经常遭受强闪光环境。叶片高频摆动导致的强闪光是叶片同一位置反复遭受强光, 而光斑是随着阳光入射角的变化而移动的光点, 它的位置更可能发生在同一叶片的不同部位。因此, 强闪光这种光环境既不同于稳态强光, 也不同于光斑。PSII具有相对完善的光破坏防御机制, 尤其是非光化学猝灭中的高能态猝灭组分可以迅速启动, 从而有效保护PSII免遭强光伤害。可是, 高频强闪光下, 如果PSI受到严重伤害, 会导致光合电子传递受阻及跨类囊体膜pH梯度下降, 进而限制非光化学猝灭以至伤害PSII。本研究的目的是解释强闪光伤害PSI的同时是否也会伤害PSII, 其机制是什么。
棉花起源于热带, 喜温好光, 是全球最重要的经济作物之一。目前新疆是我国最重要的棉花生产基地。新疆不仅光照强度高, 而且多风。田间棉花叶片往往由于高频摆动而暴露在强闪光条件下。因此, 本研究以棉花为材料探讨强闪光(20,000 μmol m–2s–1, 300 ms, 间隔10 s)对棉花叶片光合速率以及PSI和PSII活性的影响, 从而探讨棉花光合作用规律, 为棉花生产提供理论和技术支持。
1 材料与方法
1.1 试验材料
选用新疆棉花主栽品种新陆早45号。于2016年4月, 取饱满种子播于25 cm × 20 cm的花盆中, 培养基质为蛭石、珍珠岩、优良土壤, 三者按1∶1∶1混合。将花盆置室外, 待棉花出苗后每盆留一株, 常规水肥供应, 并注意适时防虫除草, 确保棉株生长良好、株高均匀一致。
1.2 试验设计
待棉花进入开花结铃期, 挑选长势一致的健康棉株9盆, 采用Sejima等[13]的方法, 在人工气候室以黑暗中(不存在光化光(AL)的状态下)连续间隔10 s的短饱和闪光(20,000 μmol m–2s–1, 时间300 ms)照射30 min, 对棉花进行处理(用Inactivited表示), 对照(CK)不做任何处理。
1.3 气体交换光响应曲线测定
用Li-6400便携式光合仪(Li-Cor公司, 美国)测定棉花主茎倒四功能叶的净光合速率(n)、气孔导度(s)、胞间CO2浓度(i)。光照强度依次为2000、1600、1200、800、500、300、200、100、80、50、20、0 μmol m–2s–1。二氧化碳浓度控制在400 μmol mol–1, 由仪器CO2注入系统提供, 叶温控制在25℃。
1.4 叶绿素荧光猝灭动力学和P700测定
选取棉花主茎倒四功能叶, 采用Dual PAM-100荧光仪(Walz, Germany)同步测定PSII和PSI。参考Suzuki等[15]方法并略有改动, 测定前将棉花进行充足的暗适应(1 h), 测定中避免其他光源的干扰, 首先打开测量光测定最小荧光产量(o), 然后施加饱和脉冲光得到最大荧光产量(m)和最大P700信号(m), 随后打开光化光(Al), 强度为1030 μmol photons m–2s–1, 待荧光信号稳定后(4~5 min), 打开饱和脉冲光(SP), 强度为20,000 μmol photons m–2s–1, 时间为300 ms, 测定任意时间的实际荧光产量(s), 过30 s关掉作用光(AL), 测定光适应状态下的最大荧光产量(m′)和光下最大P700信号(m′)。
按Dual-PAM-100使用说明并参考Kramer等[16]文献, 分析PSII和PSI量子产量, 相关参数包括PSII实际光化学效率(PSII)[17]、PSII非调节性能量耗散的量子产量(NO)、PSII调节性能量耗散的量子产量(NPQ)[16]、PSI受体侧限制引起的非光化学量子产量(NA)、PSI供体侧限制引起的非光化学量子产量(ND)、PSI光化学量子产量(PSI)等[5,18]。
PSII= (m¢–s)/m¢
NPQ=s/m¢−s/m,NO= 1−PSII−NPQ
NA= (m–m¢)/m,ND= 1−P700red,PSI= 1−ND−NA。
1.5 叶绿素荧光诱导曲线及P700光吸收的测定
根据Schreiber等[19-20]用Dual-PAM-100 (Walz, Germany)进行快速叶绿素荧光和P700光吸收曲线的测定并计算各参数。
v/m= (m–o)/m,J= (J–o)/(P–o),K= (K–o)/(J–o)
2 结果与分析
2.1 强闪光对PSI氧化还原和PSII快速诱导动力学曲线的影响
在对照和强闪光处理中, P700起初是缓慢地上升, 在数十秒后达到峰值, 然后快速下降(图1-A)。与CK相比, 在强闪光照射后P700的光吸收曲线峰值有明显的下降。m是P700最大氧化状态, 可反映有活性PSI反应中心含量, 其下降能够衡量PSI光抑制的程度。与CK相比, 强闪光后m下降了18.6% (图1-B), 说明强闪光导致PSI失活。
从图2-A可看出, 强闪光后荧光诱导动力学曲线发生明显改变, 其中O-J (从开始到虚线)荧光上升速率加快。根据该曲线可以计算有关PSII的功能参数。与CK相比, PSII的最大量子效率(v/m)降低的幅度很小, 仅下降3.3% (图2-B)。与对照相比强闪光后J增加了58%, 而K增加了65% (图2-C, D)。J和K的大幅提高表明强闪光使PSII电子传递活性下降。
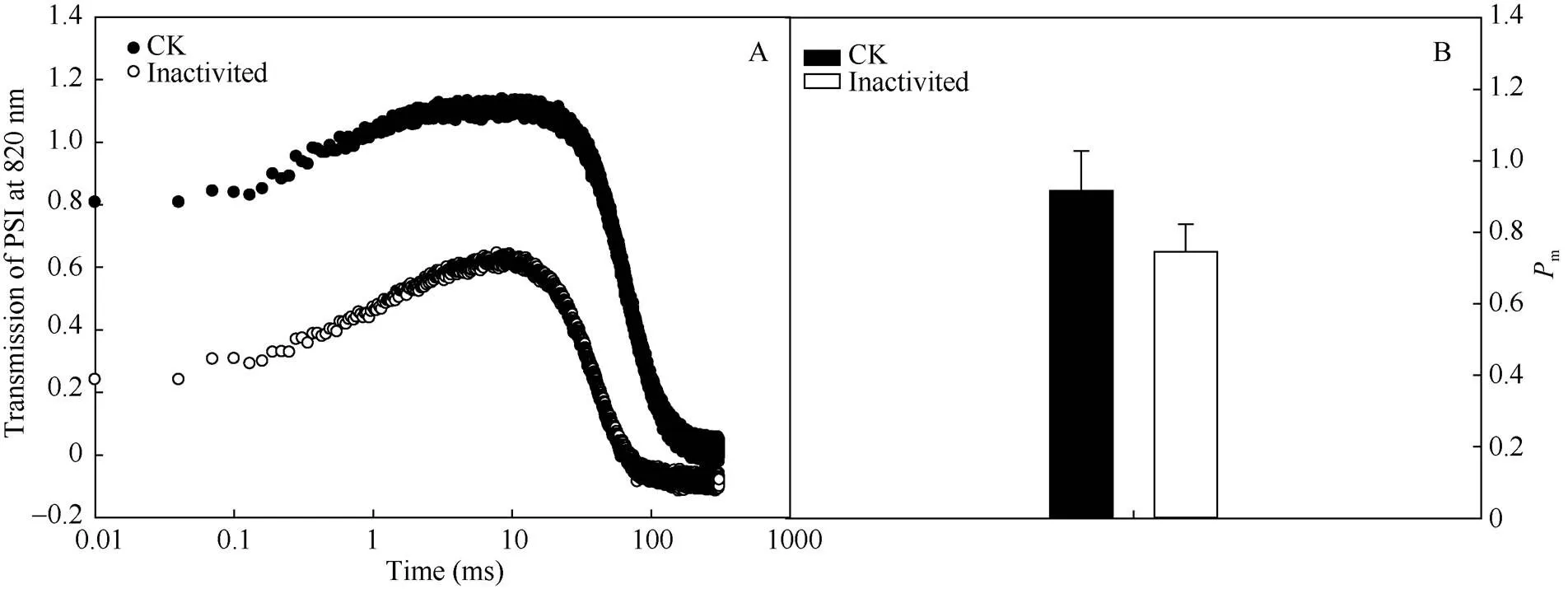
图1 强闪光处理对棉花叶片P700氧化还原曲线(A)和P700最大氧化状态(Pm)(B)的影响

图2 强闪光处理对棉花叶片PSII叶绿素快速诱导动力学曲线(A)、PSII的最大量子产量Fv/Fm (B)、VJ (C)和WK的影响
2.2 强闪光对光下PSI氧化还原状态和激发能分配的影响
与CK相比, 强闪光处理后有更低的PSI, 且随着光强的增加两处理间PSI的差异略有减小。同时, 与对照相比, 强闪光处理后ND较低; 相反, 强闪光处理后较CK有较高的NA(图3)。这些结果说明强闪光主要使PSI受体侧受到伤害。
2.3 强闪光对PSII光化学效率和激发能分配的影响
PSII是PSII实际光化学效率。随着光强的增加, 强闪光处理前后PSII都呈下降趋势。与CK相比, 强闪光后PSII量子产量明显较低, 不过随着光强增加这种差异略有减小(图4-A)。此外, 在强闪光处理前和处理后, NPQ随光强增加都呈上升趋势(图4-B)。强闪光处理后, 尽管棉花NPQ也随着光强的提高而增加, 但与CK相比明显较低。进一步分析发现,NPQ随着光强增加呈上升趋势, 强闪光处理导致该值明显降低(图4-C)。但是,NO在强闪光处理后较对照明显增加(图4-D)。这些结果说明强闪光造成PSII光抑制和可调节的热耗散下降。
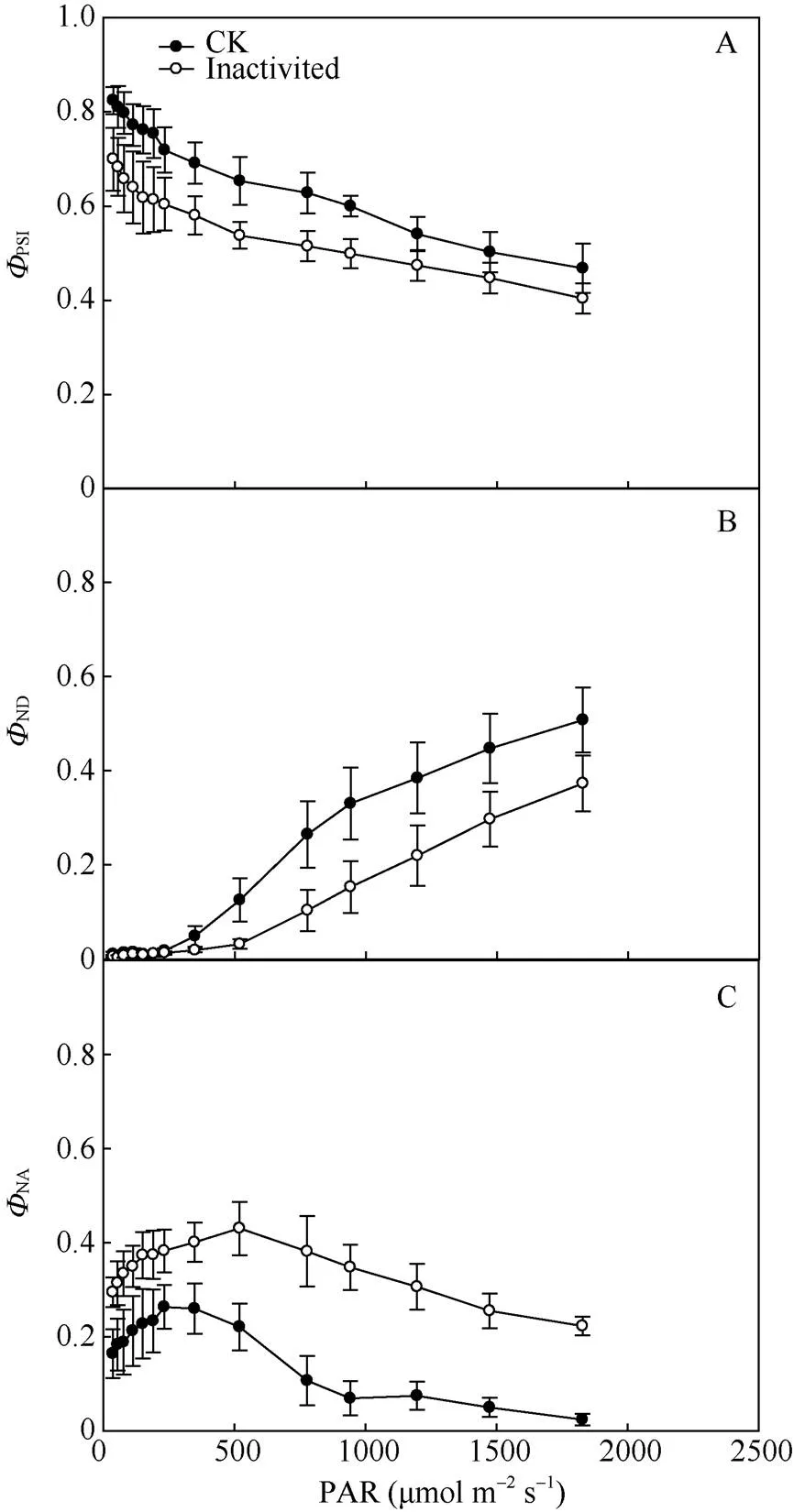
图3 强闪光处理对棉花叶片PSI氧化还原状态的影响
A: 光下PSI量子产量(PSI); B: 光下PSI被氧化的比例(ND), 是PSI由于供体侧限制引起的PSI非光化学量子产量; C: 光下PSI未发生氧化的比例(NA), 是由于受体侧限制引起的PSI非光化学量子产量。
A: effective photochemical quantum yield of PSI (PSI); B: fraction of overall P700 that is oxidized in a given state (ND), i.e. the quantum yield of non-photochemical energy dissipation due to donor side limitation; C: fraction of overall P700 that cannot be oxidized in a given state due to reduced PSI electron acceptors (NA), i.e. the quantum yield of non-photochemical energy dissipation due to acceptor side limitation.
2.4 强闪光对气体交换的影响
强闪光处理前后光合速率均随着光强增加而逐渐上升; 与CK相比, 强闪光处理后光合速率较低(图5-A)。从图5-B可以看出, 随光强增加, 强闪光处理前后气孔导度均有所增加; 不过, 气孔导度在强闪光处理后比处理前略低。同时, 本研究还观察到胞间CO2浓度与光合速率和气孔导度的变化趋势相反。尽管随光强增加, 强闪光处理前后i呈降低的趋势, 但强闪光处理后i比处理前高(图5-C)。这说明强闪光造成碳同化能力降低主要是叶肉限制, 而非气孔限制。
3 讨论
3.1 强闪光处理抑制PSI活性
P700最大氧化状态可反映有活性的PSI反应中心含量, 其下降能够指示PSI光抑制的程度, 也是衡量PSI是否受环境损伤的重要指标[7-8,21]。本研究结果表明, 强闪光处理后m下降, 与CK相比降低了18.6% (图1-B)。因此, 强闪光处理导致了PSI失活。研究表明, PSI的失活仅发生在高氧含量下, 在低氧下很少发生[13,22]; 而且, 加入PSII的抑制剂DCMU, 在完整叶片或离体类囊体中均能够抑制PSI伤害[23]。这些证据说明PSI受体侧的光失活与线性电子传递和活性氧生成有关。本研究结果还表明NA增加幅度较ND更明显(图3), 证明强闪光使PSI受体侧光损伤更严重。很可能强闪光条件下线性电子传递受阻和活性氧生成导致PSI受体侧伤害。
本研究证明强闪光处理30 min时PSI的伤害程度已经比较高; Takagi等[24]研究中30 min的强闪光处理对PSI的伤害程度因物种的不同而存在差异。与Sejima等[13]、Zivcak等[14]、Takagi[24]的研究相比, 对叶片施加的强闪光强度不同PSI失活的程度也不同。所以, 强闪光都可能对PSI造成伤害, 只是强闪光强度相对较弱时需要更长时间的处理才能导致明显的PSI失活。另外, 还有报道认为强闪光处理的间隔时间越长对PSI的伤害越小[12]。因此, 强闪光对PSI的伤害程度与光强和间隔时间均有关。
3.2 强闪光处理抑制PSII活性
在以前的研究中, 对于强闪光处理是否伤害PSII存在着争议[13-14]。很长时间以来,v/m是各种环境胁迫下衡量PSII活性的重要参数[13]。本试验中, 强闪光处理前后v/m发生的变化很小, 强闪光仅导致v/m降低3%左右。因此, 如果仅仅依据光系统II最大光化学效率来判断强闪光对PSII活性的影响似乎很小。但是, 我们注意到, 在对棉花施加强闪光处理后OJIP曲线中J点(2 ms)的相对荧光产量有明显增加, 说明在J点造成QA–的大量积累, 即PSII受体侧电子传递受阻。此外, 我们还观察到强闪光处理之后K点的相对荧光产量也呈显著增加趋势, 证明强闪光处理后放氧复合物(OEC)失活(图2)。因此, 本研究认为强闪光不仅伤害了PSI而且明显抑制了PSII的电子传递活性, 对PSII的伤害同时涉及其供体侧和受体侧。
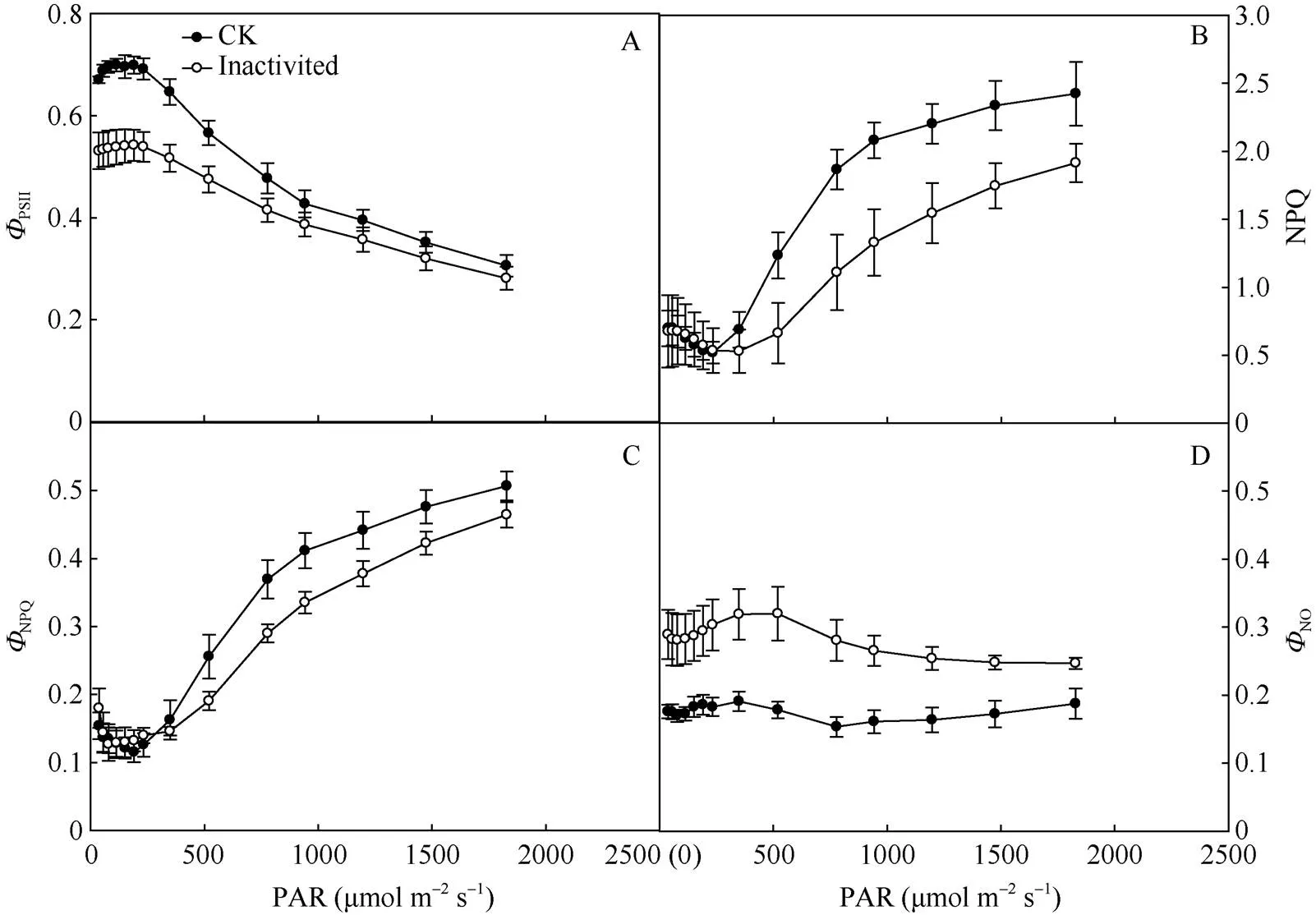
图4 强闪光对棉花叶片荧光猝灭动力学的影响
A: PSII实际光化学效率(PSII); B: 非光化学淬灭(NPQ); C: PSII调节性能量耗散的量子产量(NPQ); D: PSII非调节性能量耗散的量子产量(NO)。
A: the actual photochemical efficiency of PSII (PSII); B: non-photochemical quenching (NPQ); C: the quantum yield of regulated energy dissipation (NPQ); D: the quantum yield of non-regulated energy dissipation (NO).

图5 强闪光处理对棉花叶片光合作用光响应曲线的影响
A: 光合速率(n); B: 气孔导度(s); C: 细胞间隙二氧化碳浓度(i)。
A: photosynthetic rate (n); B: stomatal conductance(s); C: intercellular CO2concentration (i).
植物在进化中形成了很多光破坏防御机制[5]。一般来说, 植物在强光下NPQ会迅速增加, 这是保护PSII免受强光伤害的重要方面之一[5]。在本试验中, 强闪光处理后NPQ增加较处理前低, 表明强闪光处理抑制了热耗散。所以, 强闪光处理后棉花难以完全通过热耗散途径将过剩激发能无损伤地耗散掉。很可能强闪光导致光系统I和光系统II严重失活限制了光合电子传递, 进而抑制了跨膜梯度, 使非光化学猝灭下降。此外, 本研究结果表明强闪光引起NO显著上升(图4),NO反映了既不能用于光化学反应, 也不能通过天线耗散过剩激发能[25], 所以推测可能强闪光导致棉花叶片失活的PSII反应中心耗散了更多的能量。因此, 强闪光处理后棉花叶片可调节的热耗散未能大幅增加可能是其诱导PSII活性下降的重要原因。
我们也注意到前人的研究中, 不仅黑暗条件下的强闪光, 而且强光和弱光的交互作用(波动光)都可以诱导PSI活性下降[21]。不过, 两者相比, 黑暗条件下的强闪光处理更容易导致PSI的伤害[13]。相反, 光下PSII的光破坏防御机制的迅速启动或维持可以很大程度上减轻强闪光对PSII的伤害[13-15,26]。这可能是很多研究没有观察到PSII受伤害的重要原因。
3.3 强闪光导致碳同化能力下降的原因
本研究观察到伴随光合速率的降低气孔导度下降, 但胞间CO2浓度上升, 这说明强闪光处理后棉花叶片光合作用主要是非气孔限制。同时, 强闪光处理后PSI和PSII的电子传递活性均下降(图5)。光合速率的变化与2个光合系统活性电子传递的变化趋势是一致的。所以, 我们推测强闪光导致的光合电子传递活性降低是光合速率下降的重要原因。很可能, 强闪光条件下光合电子传递速率降低导致跨膜梯度和同化力生产受阻, 并进而限制了光饱和光合速率。
[1] Murata N, Takahashi S, Nishiyama Y, Allakhverdiev S I. Photoinhibition of photosystem II under environmental stress., 2007, 1767: 414–421.
[2] David J K, Zalik S. Photosystem II activity, plastoquinone A levels, andfluorescence characterization of a virescens mutant of barley., 1982, 70: 1026–1031.
[3] Takahashi S, Murata N. Interruption of the Calvin cycle inhibits the repair of photosystem II from photodamage., 2005, 1780: 352–361.
[4] Nishiyama Y, Allakhverdiev S, Murata N. Inhibition of the repair of photosystem II by oxidative stress in cyanobacteria., 2005, 84: 1–7.
[5] Huang W, Yang S J, Zhang S B, Zhang J L, Cao K F. Cyclic electron flow plays an important role in photoprotection for the resurrection plant Paraboea rufescens under drought stress., 2012, 235: 819–828.
[6] Terashima L, Funayama S, Sonoike K. The site of photoinhibition in leaves ofL.at low temperatures is photosystem I, not photosystem II., 1994, 193: 300–306.
[7] Zhang S P, Scheller H V. Photoinhibition of photosystem I at chilling temperature and subsequent recovery in, 2004, 45: 1595–1602.
[8] Huang W, Zhang S B, Cao K F. The different effects of chilling stress under moderate light intensity on photosystem II compared with photosystem I and subsequent recovery in tropical tree species., 2010, 103: 175–182.
[9] Tikkanen M, Mekala N R, Aro E M. Photosystem II photoinhibition-repair cycle protects photosystem I from irreversible damage., 2014, 1837: 210–215.
[10] Tikkanen M, Grebe S. Switching off photoprotection of photosystem I: a novel tool for gradual PSI photoinhibition., 2018, 162: 156–161.
[11] Li X G, Wang X M, Meng Q W, Zou Q. Factors limiting photosynthetic recovery in sweet pepper leaves after short-term chilling stress under low irradiance., 2004, 42: 257–262.
[12] Zhang Z S, Jia Y J, Gao H Y, Zhang H T, Li H D, Meng Q W. Characterization of PSI recovery after chilling-induced photoinhibition in cucumber (L.) leaves., 2011, 234: 883–889.
[13] Sejima T, Takagi D, Fukayama H, Makino A, Miyake C. Repetitive short-pulse light mainly inactivates photosystem I in sunflower leaves., 2014, 55: 1184–1193.
[14] Zivcak M, Brestic M, Kunderlikova K, Sytar O, Allakhverdiev S I. Repetitive light pulse-induced photoinhibition of photosystem I severely affects CO2assimilation and photoprotection in wheat leaves., 2015, 126: 449–463.
[15] Suzuki K, Ohmori Y, Ratel E. High root temperature blocks both linear and cyclic electron transport in the dark during chilling of the leaves of rice seedlings., 2011, 52: 1697–1707.
[16] Kramer D M, Johnson G, Kiirats O, Edwards G E. New fluorescence parameters for the determination of QA redox state and excitation energy fluxes.2004,79: 209–218.
[17] Genty B, Briantais J M, Bake N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence., 1989, 1: 87–92.
[18] Pfündel E, Klughammer C, Schreiber U. Monitoring the effects of reduced PSII antenna size on quantum yields of photosystems I and II using the Dual-PAM-100 measuring system., 2008, 1: 21–24.
[19] Schreiber U, Klughammer C. New accessory for the DUAL- PAM-100: the P515/535 module and examples of its application., 2008, 1: 1–10.
[20] Klughammer C, Schreiber U. Complementary PSII quantum yields calculated from simple fluorescence parameters measured by PAM fluorometry and the saturation pulse method., 2008, 1: 27–35.
[21] Suorsa M, Järvi S, Grieco M, Nurmi M, Pietrzykowska M, Rantala M, Kangasjärvi S, Paakkarinen V, Tikkanen M, Jansson S, Aro E M. PROTON GRADIENT REGULATION5 is essential for proper acclimation ofphotosystem I to naturally and artificially fluctuating light conditions., 2012, 24: 2934–2948.
[22] Sonoike K, Terashima I. Mechanism of photosystem I photoinhibition in leaves ofL, 1994, 194: 287–293.
[23] Sonoike K. Photoinhibition of photosystem I: its physiological significance in the chilling sensitivity of plants., 1996, 37: 239–247.
[24] Takagi D, Ishizaki K, Hanawa H, Mabuchi T, Shimakawa G, Yamamoto H, Miyake C. Diversity of strategies for escaping reactive oxygen species production within photosystem I among land plants: P700 oxidation system is prerequisite for alleviating photoinhibition in photosystem I., 2017, 161: 56–74.
[25] Liu Y F, Qi M F, Li T L. Photosynthesis, photoinhibition, and antioxidant system in tomato leaves stressed by low night temperature and their subsequent recovery., 2012, 196: 8–17.
[26] Sato R, Kono M, Harada K, Ohta H, Takaichi S, Masuda S. FLUCTUATING-LIGHT-ACCLIMATION PROTEIN1, conserved in oxygenic phototrophs, regulates H+homeostasis and non-photochemical quenching in chloroplasts., 2017, 58: 1622–1630.
Repetitive intense flashes inhibit photosystem II activity and thermal dissipation in cotton leaves
WU Han-Yu1,3, XIAO Fei1, ZHANG Ya-Li2, JIANG Chuang-Dao3,*, and ZHANG Wang-Feng2,*
1College of Life Science, Shihezi University, Shihezi 832003, Xinjiang, China;2College of Agriculture, Shihezi University / Key Laboratory of Oasis Ecology Agriculture of Xinjiang Production and Construction Corps, Shihezi 832003, Xinjiang, China;3Key Laboratory of Plant Resources, Institute of Botany, Chinese Academy of Sciences, Beijing 100093, China
Not only continuous high light results in the decrease of photosynthetic efficiency, but also intense flashes may affect the photosynthetic function. In this study, cotton (L) cultivar Xinluzao 45 was used to investigate the effects of repetitive intense flash treatment (leaves exposed to 20,000 µmol m–2s–1for 300 ms, with interval time of 10 s, and the whole treatment duration was 30 min) on two photosystems and photosynthetic function of cotton leaves. Chlorophyll fluorescence, P700 and gas exchange were measured before and after repetitive intense flash treatment, respectively. The content of active PSI (photosystem I) reaction center and the electron transfer activity of PSII (photosystem II) all decreased after repetitive intense flash treatment which reflected by the significant increase in J and K phases of the fluorescence induction kinetics curves after repetitive intense flash treatment.ND(the quantum yield of non-photochemical energy dissipation due to donor side limitation) of PSI decreased whileNA(the quantum yield of non-photochemical energy dissipation due to acceptor side limitation) increased, indicating that acceptor side of PSI was primarily inhibited by repetitive intense flashes. Repetitive intense flash treatment induced a distinct decrease in the quantum yield of PSII in cotton leaves under actinic light. Moreover,NPQ(the quantum yield of regulated energy dissipation) of PSII decreased significantly after repetitive intense flash treatment. However,NO(the quantum yield of non-regulated energy dissipation) increased considerably, demonstrating that the repetitive intense flashes caused PSII photoinhibition. The photosynthetic rate and the stomatal conductance decreased while the intercellular CO2concentration increased after repetitive intense flash treatment, indicating that the reduction of carbon assimilation induced by repetitive intense flash treatment is not limited by stomata. Therefore, we believe that the repetitive intense flash treatment not only induces inactivation of PSI, but also leads to PSII photoinhibition and the decrease of thermal dissipation. The suppression of photosynthetic electron transport activity may play important role in the decrease of photosynthetic rate after repetitive intense flash treatment.
cotton; repetitive intense flashs; photoinhibition; photosynthesis; electron transport
2018-07-28;
2018-12-24;
2019-02-15.
10.3724/SP.J.1006.2019.84104
张旺锋, E-mail: wfzhang65@163.com; 姜闯道, E-mail: jcdao@ibcas.ac.cn
E-mail: 1793936056@qq.com
本研究由国家自然科学基金项目(U1803234)资助。
This study was supported by the National Natural Science Foundation of China (U1803234).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20190214.1110.002.html
