液态活检在胃癌诊治中应用的研究进展*
2019-05-09曾恒综述冯丹审校
曾恒 综述,冯丹 审校
200433 上海, 海军军医大学 基础医学院5队(曾恒);200433 上海, 海军军医大学附属长海医院 肿瘤科(冯丹)
我国胃癌(gastric cancer,GC)的发病率、病死率均仅次于肺癌,位居肿瘤排行第2位,严重威胁着国人的健康,在未来很长的一段时间内,GC的诊治工作都将会是我国最重大的卫生问题之一。由于早期缺乏特异性的体征和症状,我国GC早期检出率仅仅约10%[1],极容易导致延误诊断和误诊。尽管我国GC个性化治疗效果已经取得很大进展,但晚期GC患者的无进展生存期和总生存期仍处于较低水平,5年生存率不到30%,据最新研究显示,晚期GC患者约50%发生术后复发或者转移[2],因而监测GC患者的疾病进展对提高生存率至关重要。在临床诊治过程中,GC的早期诊断、疗效监测、疾病复发转移预警等方面仍存在困境,因此寻找更敏感、无创、经济的生物标志物是临床及科研工作者不懈努力的方向。“液态活检”以其操作简便、可重复性好、非侵入性等优势,在胃癌早期诊断、疗效监测以及疾病复发转移预警等方面取得了一定进展,具有良好的应用前景。
1 循环肿瘤细胞在GC诊治中的研究进展
循环肿瘤细胞(circulating tumor cells,CTC)定义为由肿瘤原发、转移灶自发脱落或因诊疗操作而落入外周血液循环的肿瘤细胞[3]。1869年,Ashworth教授[4]首次在1例肿瘤转移患者的外周血液发现了与原发灶组织细胞生物学特性极其相似的细胞,研究表明这些细胞源于肿瘤灶。CTC从肿瘤组织脱落入外周血液后由于细胞微环境改变、机体免疫杀伤以及血液剪应力等原因,绝大部分生存期很短,患者外周血中残留的肿瘤细胞极少,平均5×109个红细胞和5×106~10×106个白细胞中才能检测到一个[5],但存留的细胞具有很强的生存力,往往能发展为微小的癌栓甚至转移灶。
目前认为转移是GC患者死亡的最重要原因,而CTC在肿瘤的远处转移上起着关键作用。为了躲避免疫杀伤以及抵抗凋亡,转移过程中的CTC会产生不同的表型变化,这其中上皮细胞-间充质型转化(epithelial-mesenchymal transition,EMT)起着最重要的作用,转化过程表现为细胞各类上皮标志物(如CK、E-钙粘蛋白)表达降低而间质细胞来源的蛋白(如波形蛋白)表达增加,从而促进肿瘤灶细胞间黏附以及紧密连接发生改变,Liu等[6]发现EMT对促进CTC向血管渗透以及维持CTC在血管内生存发挥一定的作用,这可能导致侵袭性较强的肿瘤细胞脱离连接紧密的细胞层而迁移至血管,从而形成微小转移灶。
有研究报道只有具有干细胞样特性的CTC才能形成转移灶,Zhang等[7]研究发现循环肿瘤干细胞具有极高的侵袭性、转移性以及自我更新、增殖能力,凋亡率很低且能诱导肿瘤形成,李熳等[8]应用密度梯度离心法和双重免疫荧光法(细胞角蛋白19/CD44)检测CK 19和CD44(GC肿瘤干细胞标志物)阳性的 CTC。研究共纳入45例GC患者,其中27例患者检测到CTC阳性,在CTC阳性患者中,淋巴结转移患者16例,其中14例为CD44阳性;13例患者出现远处转移,其中12例为CD44阳性;14例患者出现复发,其中13例为CD44阳性,研究结果指出,CD44阳性CTC与GC患者发生淋巴结转移、远处转移以及术后复发显著相关(P<0.05),该研究为肿瘤干细胞形成新的转移灶的观点提供了有力的支持,认为检测表达肿瘤干细胞标志物的CTC可能更有临床意义,Watanabe等[9]为评估CD44阳性CTC的临床意义,采用流式细胞术检测了26名GC患者和12名健康志愿者外周血中CD44+和CD44-CTC的数量,研究发现通过检测CD44+CTC对GC患者的鉴定敏感性和特异性分别为92.3%和100%,更重要的是,该研究还发现CD44+CTC的数量与较高的TMN分期、肿瘤深度以及静脉侵犯呈显著正相关关系(P<0.005),可以为GC患者诊断和治疗提供新的标志物。Inoue等[10]对两例晚期GC患者化疗过程中的CTC进行检测,发现在第1次、第2次化疗后CTC计数均有降低,而当患者产生化疗耐药时,CTC计数开始增加,由此认为CTC计数与疾病的进展显著相关,Ito等[11]研究显示术后7.5mL外周血中CTC计数低于5个的患者复发率显著低于5个及以上患者,研究表明患者术后CTC检出水平与癌症复发率呈显著负相关,Lee等[12]研究发现100例化疗患者中,7.5mL外周血中检测到CTC计数大于或者等于5个的患者总生存期显著短于未检测到CTC和计数小于5个的患者,在CTC阳性组与阴性组化疗效果的对比中,CTC阳性组患者对细胞毒性化疗疗效明显较差,研究证实CTC计数与疗效呈显著正相关关系,Li等[13]对晚期GC患者的CTC水平进行研究,结果发现治疗期间高水平CTC与预后不良相关,治疗后CTC水平有助于评估治疗反应,Zou等[14]对近年来Pubmed等各数据库所报道的文献进行Meta分析,经严格筛选后16项研究被纳入,其结果表明外周血中CTC的高水平表达与患者的总体生存率、无进展生存期显著相关,患者外周血中检测到高水平CTC预示着较短的无进展生存期,研究证实了胃GC患者CTC具有显著的预后价值。
目前临床上绝大部分的临床研究都支持GC患者体内CTC的含量显著高于正常人,并且随着疾病的进展、肿瘤灶尺寸的增大或者转移,肿瘤组织的恶性度增加,CTC的含量也随之增加,CTC在GC的早期诊断、监测疾病进展、复发或转移预警、判断预后以及检测疗效等方面的应用价值逐渐得到认可。最新研究表明,CTC中存在相当大的异质性,CTC在分析肿瘤的异质性以及来源上也显示出巨大的临床价值[15],这也为GC的个体化治疗提供了新的策略。
2 循环肿瘤DNA在GC诊治中的研究进展
循环肿瘤DNA(circulating tumor DNA,ctDNA)是指由肿瘤细胞释放入外周血的基因组片段,可由单链、双链DNA或单双链DNA片段混合组成,与肿瘤组织的生物学特性密切相关。ctDNA发展史最早可追溯到1948年科学家Mandel[16]首次发现游离DNA(cell free DNA, cfDNA)的存在。随后的研究发现在炎症、创伤等状态下cfDNA明显增高,但当时人们对DNA的认识不够,所以并未引起重视,1977年,Leon等[17]研究发现肿瘤转移患者cfDNA水平高于健康人,且晚期患者水平更高。由于技术受限,当时并不清楚cfDNA来源及与肿瘤组织的关系。直到1994年人们才发现这些DNA来源于原发灶、转移灶及循环血液中活的、凋亡或者死亡的肿瘤细胞,且具有肿瘤标志性突变,并称之为ctDNA[18],研究表明ctDNA在诊断、判断预后以及监测肿瘤的进展上具有重要应用价值。
ctDNA的研究关键在于检测技术,近年来数字PCR以及二代测序极大地提高了富集能力和检测的灵敏度,ctDNA的许多临床价值得以证实,Park等[19]研究发现GC患者外周血中ctDNA浓度是健康对照组的2.4倍,提示血浆ctDNA可作为GC早期诊断的肿瘤标志物。Kim等[20]对30例GC患者和34例健康者进行病例对照研究,发现早期GC cfDNA水平显著低于晚期GC患者且均高于健康者,患者术后24小时内cfDNA显著下降,研究认为cfDNA可以作为早期发现GC和预测肿瘤负荷的生物指标,Hamakawa等[21]对临床过程中TP53-ctDNA的定量值与肿瘤的状态进行比较,发现GC患者的ctDNA表达可作为监测GC进展的有用生物标志物, Gao等[22]对近年来所报道的16项关于ctDNA在GC中的表达及其临床意义的研究,共计1 193例GC患者ctDNA的表达进行Meta分析,发现ctDNA的存在与GC恶性程度有显著的正相关关系,研究证实了ctDNA的存在预示着GC患者较差的无进展生存期和总生存期(P<0.001)。Pu等[23]发现GC患者ctDNA的浓度随着TNM分期增加而显著升高(P<0.05),而在健康对照组中未检测到ctDNA,该研究认为ctDNA浓度有望作为评估GC进展的分子标志物。Gao等[24]对70例GC患者肿瘤灶和ctDNA的基因突变进行分析,发现ctDNA与原发肿瘤组织的HER2扩增具有高度一致性,研究认为基于ctDNA的评估可以部分克服肿瘤的异质性,成为GC个体化治疗新的指标,有研究发现大多数癌症患者ctDNA中有基因突变且突变频率与治疗效果也具有相关性,根据突变制定个性化治疗方案前景可观[25]。
甲基化在GC的整个演变过程中起着重要作用,评估特定位点的基因甲基化已经成癌症的诊断途径之一,Pimson等[26]对PCDH10和RASSF1A基因甲基化进行研究,结果显示两个基因在晚期GC患者中甲基化程度更高并且甲基化患者比例随着TNM分期增加而增高,甲基化阳性患者生存时间明显短于阴性患者,血液样本中的PCDH10和RASSF1A甲基化(截定值取低于6%时敏感性分别为94.06%和83.17%,)可以作为GC患者非侵入性诊断指标。Tahara等[27]在207例GC患者中使用亚硫酸氢盐焦磷酸测序定量白细胞DNA中IGF2DMR和LINE1的甲基化状态,结果发现IGF2DMR和LINE1的高甲基化与GC的进展显著相关,如淋巴道转移、腹膜侵袭以及肝转移。Hu等[28]为评估血液DNA甲基化标记物检测GC患者的准确性,对近年来报道的32项研究4 172例患者进行Meta分析,研究证实基于血液中DNA甲基化的检验具有高特异性,评估多个甲基化基因可以显著提高诊断灵敏度。
与传统活检相比较,ctDNA的优势在于不仅能早期诊断、发现肿瘤复发转移、全方位监测疾病进展以及化疗的敏感性,更重要的是检测技术微创、无风险、不同时段采集以动态监测以及更准确地反映肿瘤组织的异质性,可以更好地制定个性化治疗方案。此外ctDNA携带的基因遗传信息与相应的肿瘤组织具有很好的一致性,这为开发GC靶向治疗提供了新的途径。
3 外泌体在GC诊治中的研究进展
外泌体是一类直径约为30~150nm广泛存在于细胞外液中的亚细胞囊泡结构。细胞膜结构域经内吞作用形成囊泡,囊泡选择性包裹基质内的蛋白质、核酸等物质后形成多泡体,一部分多泡体被溶酶体水解,而另外一部分则与以钙离子依赖方式与细胞膜融合后将囊泡排除,即形成外泌体[29]。外泌体中含有丰富的蛋白组学和遗传信息,可作为信息分子参与细胞间信息传递。外泌体广泛存在于人体液中,包括唾液、尿液、精液、母乳、血清以及脑脊液[30]。
肿瘤干细胞被认为是GC患者复发和转移的根源,肿瘤干细胞与其他细胞之间的物质交流与信号通讯对维持以及形成新肿瘤灶至关重要,外泌体的释放和摄取则是其中一个重要方式。研究表明外泌体在维持肿瘤干细胞表型中起着重要作用[31],如食管癌细胞通过外泌体内容物miR-21作用于其他癌细胞PDCD4途径从而促进癌细胞的转移和侵袭[32]。Ko等[33]采用盲法研究,将3组不同疾病状态的小鼠随机打乱后通过多通道纳米流体系统分离外泌体以及qPCR检测外泌体内mRNA再次分组小鼠,成功将患癌症组小鼠、癌前病变小鼠和健康组小鼠区分,从而揭示了外泌体与肿瘤之间的关系,Arita等[34]通过超速离心从细胞条件培养基中提取外泌体,研究了肿瘤来源的外泌体对GC进展的影响,认为外泌体可能诱导间皮细胞黏附分子的表达因而在GC腹膜转移中起关键作用,Wang等[35]通过比较来源于癌组织和癌组织周围其他组织的间充质干细胞所表达miRNA的差异,发现GC组织来源的间充质干细胞通过外泌体将miRNA转移至GC细胞从而促进其增殖和转移,研究证实癌细胞衍生的外泌体通过调节肿瘤微环境促进癌症进展,Wu等[36]证明GC细胞来源外泌体激活巨噬细胞表达增加的促炎因子水平,反过来促进肿瘤细胞增殖和迁移。Zheng等[37]研究发现外泌体介导肿瘤相关性巨噬细胞分泌的功能性ApoE蛋白向肿瘤组织转移从而促进了癌症的转移。
ZFAS1是一种新发现的长链非编码RNA(long non-coding RNAs,lncRNA),可促进肿瘤生长和转移,Pan等[38]采用RT-PCR检测肿瘤组织、血清标本、GC患者血清外泌体以及正常细胞系中ZFAS1的表达,发现GC细胞、肿瘤组织、血清以及血清外泌体中ZFAS1过表达,研究认为ZFAS1可以通过外泌体递送以促进GC进展,ZFAS1可以作为GC的潜在诊断和预后生物标志物。Zhao等[39]通过RT-qPCR技术检测了126名GC患者和120名健康者血清外泌体内lncRNA HOTTIP,结果发现GC患者血清外泌体HOTTIP的表达显著高于健康者,并且其表达水平与癌组织浸润深度和TNM分期(P<0.001)显著相关,研究认为外泌体HOTTIP相较于CEA、CA19-9和CA724具有更高的诊断能力。Yang等[40]采用小鼠异种移植模型评估外来体衍生的miR-130a与体内肿瘤生长之间的相关性。研究证明了外泌体通过在体内和体外靶向c-MYB将miR-130a从GC细胞递送到血管细胞中以促进血管生成和肿瘤生长。研究表明肝细胞生长因子(hepatocyte growth factor,HGF)具有对癌细胞生长和血管生成的抑制作用,Zhang等[41]通过表征HGF使其靶向GC细胞,而后将HGF包埋于外泌体中并转运至癌细胞内,从而成功实现GC靶向治疗。
外泌体作为肿瘤细胞间信息传递和物质转运的媒介和载体,其对肿瘤组织的发展有着重要影响,相关研究表明外泌体具有抑制机体免疫功能并介导肿瘤细胞免疫逃逸、诱导肿瘤新生血管从而促进肿瘤转移,但也有不少报道称外泌体具有抗肿瘤作用,如直接诱导肿瘤细胞凋亡。活细胞分泌的外泌体内具有多种生物活性物质,包括多种蛋白、miRNA以及脂类等,近几年的多项临床研究已揭示,这其中多种miRNA在GC的早期诊断中具有重要价值。利用外泌体的转运功能以及生物学特性治疗肿瘤,这将为靶向治疗开拓一片广阔领域。
4 微小RNA在GC诊治中的研究进展
研究表明,人类基因约75%被转录,然而仅仅约1.2%的RNA会被翻译成蛋白质,学术上将不被翻译的RNA称为非编码RNA,包括lncRNA、内源性短干扰RNA、微小RNA等[42]。其中微小RNA(microRNA,miRNA)是一类长度约为22个核苷酸的小分子单链RNA。近年来的研究表明, miRNA参与调节细胞的增殖、分化以及凋亡,在GC的发生、发展、转移以及产生化疗耐药性等方面均起着重要作用。随着对miRNA的深入研究,已证实部分异常表达的miRNA通过调控癌基因或抑癌基因的表达从而影响肿瘤的发生发展,Hu等[43]对miR-103a-3p与GC 发生之间的关系进行研究,发现与邻近的非肿瘤组织相比,miR-103a-3在GC组织内表达水平显著增加并且改变了GC细胞的增殖,研究还证实基因ATF7是miR-103a-3p的直接作用靶标,沉默ATF7与过表达的miR-103a-3均显示出相似的细胞和分子效应,即促进GC细胞的增殖。Xu等[44]发现miR-543在GC患者中表达上调,研究揭示了斑点型POZ蛋白(speckle-type POZ protein,SPOP)的表达与miR-543表达呈负相关关系,SPOP为miR-543的直接靶标,miR-543通过靶向作用于SPOP而在GC患者肿瘤细胞迁移和侵袭中发挥强大的肿瘤促进作用。此外,多项研究已经证实miRNA在GC、肝癌、乳腺癌、肺癌等多种肿瘤干细胞中异常表达,在调控肿瘤干细胞的自我更新能力、多向分化能力以及介导肿瘤转移、复发和耐药上均起着重要作用[45]。Shao等[46]对miRNA-19b/20a/92a在GC干细胞(gastric cancer stem cells,GCSCs)的体外和体内的作用及相关机制进行分析,探索miRNA-19b/20a/92a与GCSCs增殖之间的关系,研究发现miRNA-19b/20a/92a通过在转录后水平上靶向E2F1和HIPK1并激活β-连环蛋白信号转导途径来促进GCSC的自我更新。 miRNA-92a在GC样本中的表达与患者的预后呈显著负相关关系,研究者认为miRNA-92a是预测GC预后的独立因子和指标。Wang等[47]对常见的47种异常表达的miRNA在GC诊疗中的临床意义进行系统分析,证实部分miRNA可以作为GC早期诊断和预测预后或评价治疗反应的生物标志物。
miRNA在GC发生发展中的作用及其机制一直是临床研究的热门领域,Zhang等[48]发现组蛋白去甲基化酶JMJD2B在GC发生中起着致癌作用,而microRNA通过与mRNA的3′UTR结合来抑制基因表达从而起着基因调节剂的作用。研究发现miR-491-5p通过直接靶向GC中的JMJD2B3′UTR来抑制细胞增殖、侵袭和迁移。与邻近正常组织相比,GC组织中miR-491-5p表达降低,与健康个体相比,GC患者血清中miR-491-5p表达较低(P<0.0001),研究表明miR-491-5p可以作为GC肿瘤抑制剂。Zhou等[49]发现GC表达上调的基因POLR2L、POLR2C、APRT和LMAN2与miR-604相互作用,致使miR-604在耐药GC中具有低表达,研究认为miR-604可能成为GC耐药诊断的新指标。近两年来临床上报道了许多miRNA在GC发展中的作用及其靶标,部分列举如下见表1。
表1 miRNA在GC中的作用及机制
Table 1. The Roles and Mechanism of miRNA in Gastric Cancer
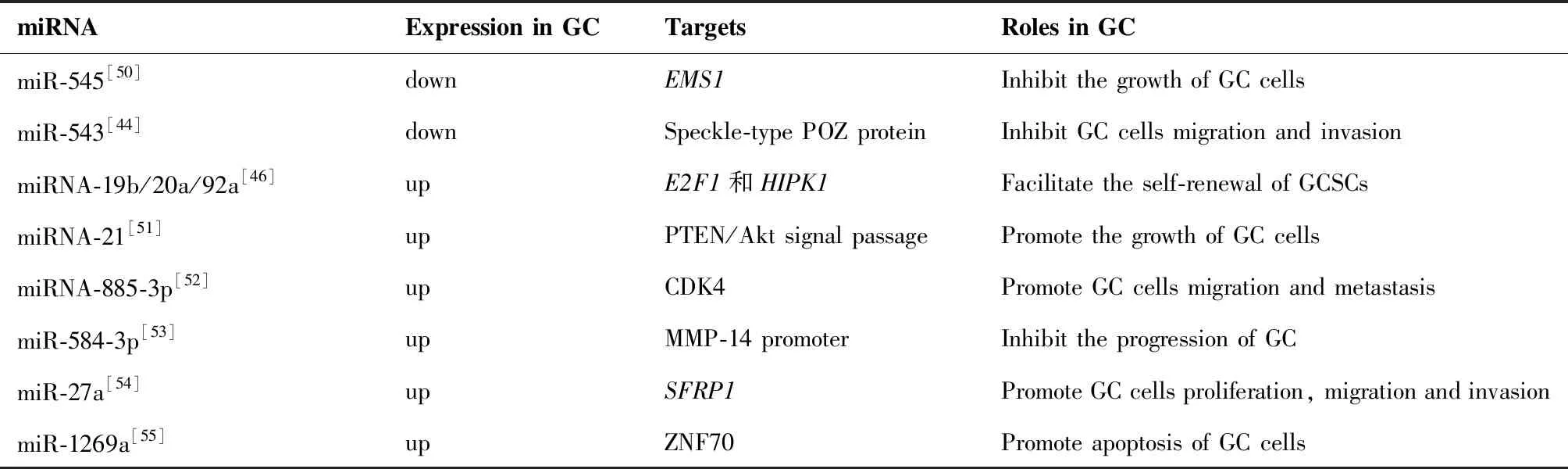
miRNAExpression in GCTargetsRoles in GCmiR-545[50]downEMS1Inhibit the growth of GC cellsmiR-543[44]downSpeckle-type POZ proteinInhibit GC cells migration and invasionmiRNA-19b/20a/92a[46]upE2F1和HIPK1Facilitate the self-renewal of GCSCsmiRNA-21[51]upPTEN/Akt signal passagePromote the growth of GC cellsmiRNA-885-3p[52]upCDK4Promote GC cells migration and metastasismiR-584-3p[53]upMMP-14 promoterInhibit the progression of GCmiR-27a[54]upSFRP1Promote GC cells proliferation, migration and invasionmiR-1269a[55]upZNF70Promote apoptosis of GC cells
miRNA在基因功能调节上发挥着重要作用,它几乎全程参与了肿瘤的发生发展、侵袭以及转移,也在调节肿瘤细胞及肿瘤干细胞的增殖、分化、凋亡以及转移上起着重要作用,研究表明部分miRNA的异常表达与肿瘤组织的状态密切相关,部分miRNA可以作为GC早期诊断的生物标志物,具有较高的诊断准确性。此外miRNA通过作用于相应的靶标而调节肿瘤细胞的生长、增殖,近几年不少miRNA以及相应的靶标被研究者们发现,利用这一特性而实现靶向治疗前景广阔。
5 总 结
随着精准医学的发展,液态活检在GC诊疗中的应用越来越受到重视,CTC、ctDNA、miRNA以及外泌体均来源于肿瘤灶,与肿瘤组织的发生发展密切相关。液态活检在实现GC的早期诊断、疗效监测、预后评估以及靶向治疗上均显示出独特的应用价值。与传统组织穿刺活检相比较,液态活检不仅仅是微创、无风险,更重要的是,液态活检能在不同的时段检测而实现动态监测、能克服肿瘤异质性,从而实现真正意义上的个体化治疗。此外利用外泌体的形成、转移机制以及miRNA的生物学特性,将药物包埋于外泌体内转运至肿瘤细胞从而实现靶向治疗的前景亦很可观。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
