胰腺神经内分泌肿瘤的靶向及免疫治疗现状*
2019-05-09邵月综述秦雷李德卫审校
邵月 综述,秦雷,李德卫 审校
400016 重庆,重庆医科大学 研究生学院(邵月,秦雷);400016 重庆,重庆医科大学附属第一医院 肝胆外科(李德卫)
神经内分泌肿瘤(neuroendocrine tumors,NETs)是一组复杂且高度异质的肿瘤,起源于神经内分泌细胞[1]。胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,PanNETs)占新发胰腺恶性肿瘤的1.3%~2.8%[2]。近年来,随着影像学和诊断技术的进步,此类肿瘤的偶然诊断率大大增加。尽管如此,大约56%的PanNETs患者确诊时已发生远处转移,严重影响其预后[3]。按是否能分泌神经内分泌激素和表现出相应的临床症状,PanNETs可分为功能性胰腺神经内分泌肿瘤和非功能性胰腺神经内分泌肿瘤,后者占所有PanNETs的70%~80%[4]。2017年,世界卫生组织发布的最新指南根据组织病理学特征和增殖率对PanNETs进行了分类:(1)分化良好的胰腺神经内分泌肿瘤,包括G1(Ki67指数<3%和有丝分裂指数<2/10HP)、G2(3%~20%Ki67指数和有丝分裂2-20/10HP)和G3(Ki67指数>20%和有丝分裂>20/10HP);(2)低分化胰腺神经内分泌肿瘤(神经内分泌癌PanNECs),Ki67指数>20%和有丝分裂>20/10HP,按照组织学特征又可分为小细胞型和大细胞型;(3)混合性神经内分泌分泌/非神经内分泌肿瘤。
根治性手术是目前唯一可治愈PanNETs的治疗策略。西班牙医学肿瘤学会指南认为,对于即使已有转移的PanNETs患者,若可完全切除肿瘤,进行根治性手术切除也是必要的[5]。不幸的是,很多PanNETs发现时常常已经发展到晚期,无法根治性手术切除。转移性PanNETs常规治疗涉及姑息性手术切除、全身化疗、肝脏局部治疗(如经动脉化疗栓塞和射频消融)。近年来靶向及免疫治疗已成为PanNETs治疗的新方法和研究热点,被寄予厚望,本文也将对此进行重点讨论。
1 靶向治疗
目前已有多项试验分析了多种靶向治疗药物用于PanNETs的效果,见表1。
表1 神经内分泌肿瘤靶向治疗的相关临床研究
Table 1. Clinical Study on Targeted Therapy of Neuroendocrine Tumors
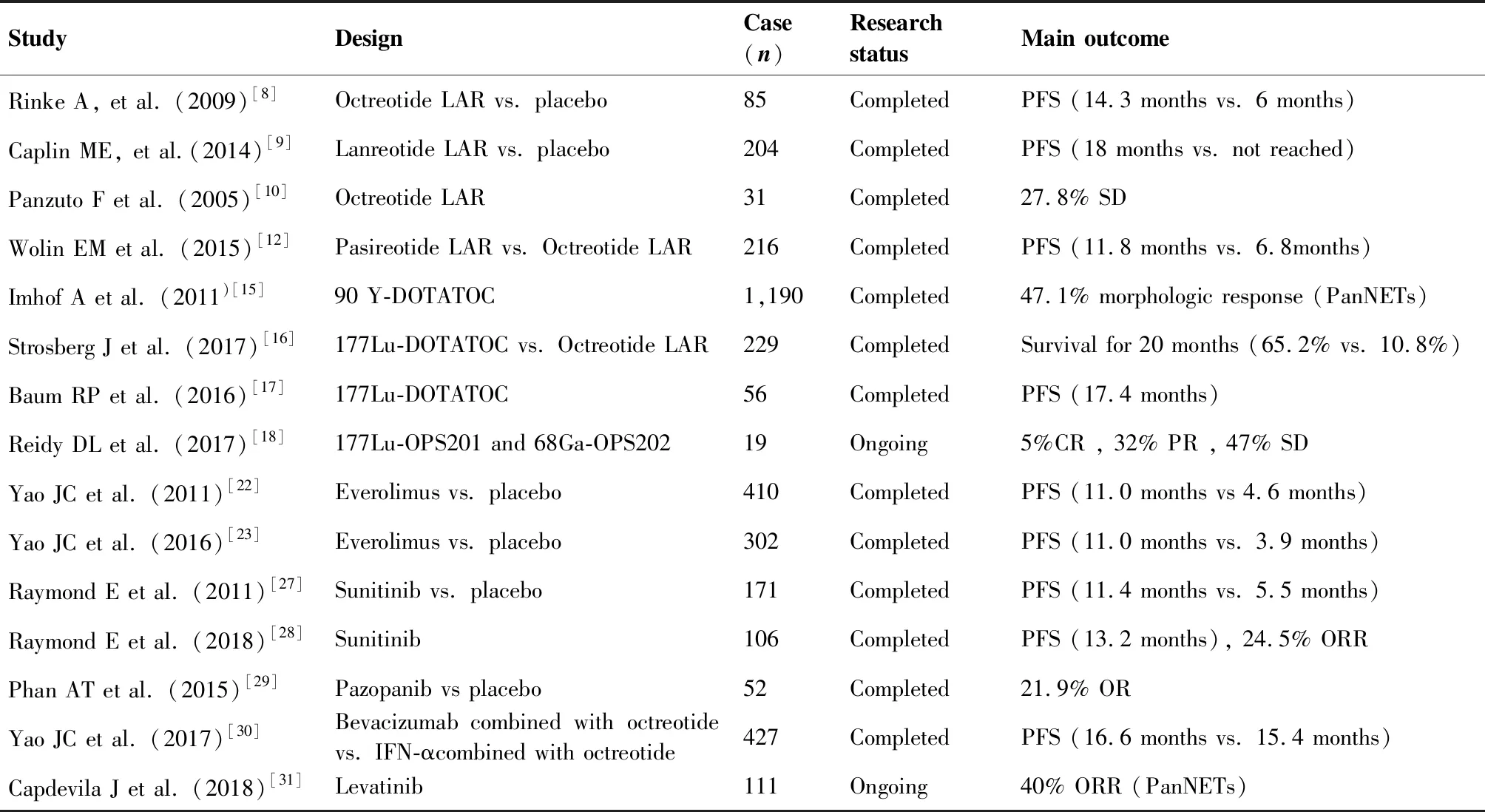
StudyDesignCase(n)Research statusMain outcomeRinke A, et al. (2009)[8]Octreotide LAR vs. placebo85CompletedPFS (14.3 months vs. 6 months)Caplin ME, et al.(2014)[9]Lanreotide LAR vs. placebo204CompletedPFS (18 months vs. not reached)Panzuto F et al. (2005)[10]Octreotide LAR31Completed27.8% SDWolin EM et al. (2015)[12]Pasireotide LAR vs. Octreotide LAR216CompletedPFS (11.8 months vs. 6.8months)Imhof A et al. (2011)[15]90 Y-DOTATOC1,190Completed47.1% morphologic response (PanNETs)Strosberg J et al. (2017)[16]177Lu-DOTATOC vs. Octreotide LAR229CompletedSurvival for 20 months (65.2% vs. 10.8%)Baum RP et al. (2016)[17]177Lu-DOTATOC56CompletedPFS (17.4 months)Reidy DL et al. (2017)[18]177Lu-OPS201 and 68Ga-OPS202 19Ongoing5%CR , 32% PR , 47% SDYao JC et al. (2011)[22]Everolimus vs. placebo410CompletedPFS (11.0 months vs 4.6 months)Yao JC et al. (2016)[23]Everolimus vs. placebo302CompletedPFS (11.0 months vs. 3.9 months)Raymond E et al. (2011)[27]Sunitinib vs. placebo171CompletedPFS (11.4 months vs. 5.5 months)Raymond E et al. (2018)[28]Sunitinib106CompletedPFS (13.2 months), 24.5% ORR Phan AT et al. (2015)[29]Pazopanib vs placebo52Completed21.9% ORYao JC et al. (2017)[30]Bevacizumab combined with octreotide vs. IFN-αcombined with octreotide427CompletedPFS (16.6 months vs. 15.4 months)Capdevila J et al. (2018)[31]Levatinib111Ongoing40% ORR (PanNETs)
PFS: progression-free survival; ORR: overall response rate; OR: objective response; PR: partial response; CR: complete response; SD: stable disease.
1.1 生长抑素类似物(somatostatinanalogues,SSAs)
SSAs与肿瘤细胞表面的生长抑素受体(somatostatin receptor,SSTR)结合后,通过调节肿瘤细胞生长微环境、抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)和胰岛素样生长因子的表达、减少肿瘤新生血管形成,发挥抑制肿瘤细胞增长及激素分泌的作用[6]。Cives等[7]研究发现,在肝脏肿瘤负荷较低(<10%)、血清CgA水平正常且肿瘤高表达SSTR5的患者中,SSAs的治疗效果更佳。
奥曲肽及兰瑞肽是临床常用的第一代SSAs,这两种药物均通过与SSTR2/5结合而发挥作用。最新的两项前瞻性多中心随机临床试验(PROMID和CLARINET)证实[8-9],两种SSAs在NETs的治疗中都具有抗增殖活性。PROMID纳入分化良好的转移性中肠NETs,与安慰剂组相比,长效奥曲肽组的无病进展生存期(progression free survival,PFS)明显延长(14.3个月vs6个月)。在此之前的一项回顾性研究,纳入分化良好的伴有转移病灶的肠胰内分泌癌患者,在接受奥曲肽6个月治疗后,只有27.8%的PanNETs患者疾病稳定,却有81.8% 的中肠NETs患者疾病稳定,并证明肝外转移是奥曲肽效力差的主要预测因子[10]。这此研究表明,奥曲肽对于PanNETs的治疗效果不如中肠NETs,但目前缺少单独针对于PanNETs的大样本临床研究去进一步探究。CLARINET研究纳入G1/G2期且SSTR表达阳性的PanNETs和肠道NETs,发现长效兰瑞肽组患者的中位PFS也有延长(18个月)。新型SSAs帕瑞肽可同时结合SSTR1、SSTR2、SSTR3和SSTR5,在奥曲肽或兰瑞肽难以治疗的肿瘤中显示出一定的潜力,或可用于PanNETs患者[11]。一项III期临床研究纳入类癌症状控制不充分的转移性NETs,结果显示,与奥曲肽组相比,接受帕瑞肽LAR治疗的患者在6个月时的肿瘤控制率有所提高(62.7%vs46.2%),但无统计学意义。帕瑞肽LAR患者的PFS比奥曲肽LAR患者长5个月(11.8个月vs6.8个月),相当于估计疾病进展或死亡的风险降低54%[12]。在NETs治疗中,帕瑞肽不仅可以作为单一药物使用,还可以与其他药物结合使用。最近的临床前研究还证明了帕瑞肽与多巴胺激动剂、Raf激活剂、化疗和COX-2抑制剂联合应用在几种癌症模型中的有效抗肿瘤活性[13],提示该药或许未来也可用于PanNETs。SSAs对胃、十二指肠运动和胆囊收缩有抑制作用,导致产生恶心、腹胀、脂肪泻和胆囊结石等。另外,帕瑞肽与高血糖相关,通常需要使用降糖药物拮抗。
1.2 肽受体放射性靶向治疗(peptide receptor radionuclide therapy,PRRT)
PRRT可以将放射性核素标记的肽靶向递送至表达SSTR的肿瘤细胞,分解产物储存在肿瘤细胞的溶酶体中,从而能够长时间照射肿瘤细胞,达到定向杀伤肿瘤的目的。理想的PRRT选择标准包括生长抑素受体能与放射性示踪剂强力结合,病灶区的放射性浓度高于正常肝组织。在选择治疗时,还需要考虑患者的肿瘤负荷、生长抑素受体的表达情况、患者偏好以及毒副反应[14]。
90Y-DOTATOC和177Lu-Dotatate是最新一代的PRRT。90Y是一种高能量β粒子发射体。一项II期单中心试验纳入了1 109例接受90Y-DOTATOC治疗的神经内分泌癌患者,其中有342例PanNETs患者;研究发现47.1%的受试者表现出肿瘤体积缩小,15.5%的受试者肿瘤标志物降低,并且26.9%的受试者临床症状改善[15]。177Lu发射β射线和γ射线。177Lu-DOTATATE被FDA批准用于SSTR阳性GEP-NETs的成年患者。最近的Ⅲ期临床试验纳入229例患者分化良好、多发转移的中肠神经内分泌肿瘤,177Lu-Dotatate组的反应率为18%,而安慰组仅为3%[16]。177Lu-DOTATOC和177Lu-OPS201是有潜力的新型PRRT,但目前缺少对PanNETs患者疗效的报告,相关的临床试验目前正在进行[17-18]。
PRRT毒性包括骨髓压迫症和肾功能不全,后者可通过输注氨基酸得到改善。除SSTR外,其他肽受体靶标如胰高血糖素样肽-1和葡萄糖依赖性促胰岛素多肽受体等,也有望用于体内靶向放射治疗,目前正处于临床前研究阶段[19]。
1.3 哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂
mTOR在调节细胞生长、增殖、凋亡和血管生成中发挥作用,并在多种癌症中被激活。在NETs的发生和进展中,mTOR也起到了重要作用[20]。临床前数据表明,PIK3CA和PTEN基因突变以及p-Akt高表达可以预测NETs细胞系对雷帕霉素的敏感性,并且在接受雷帕霉素治疗的NETs患者中证实了这种相关性[21]。
依维莫司是一种mTOR通路的抑制剂,被FDA批准用于治疗不可切除的进行性晚期NETs患者。2011年发表的RADIANT-3研究纳入410例不能手术切除的晚期中高分化PanNETs患者,结果表明依维莫司较之安慰剂能明显延长患者的中位PFS(11.0个月vs4.6个月);亚组分析提示,无论是对于高分化还是中等分化患者,该药均可带来PFS获益。遗憾的是,依维莫司治疗晚期PanNETs患者的客观缓解率(objective responserate,ORR)只有5%,中位总生存期(overall survival,OS)虽较安慰剂组有所提高,但差异均未达到统计学意义[22]。近期一项双盲的Ⅲ期 RADIANT-4 研究[23]选取了302例起源于肺或胃肠道的晚期高分化无功能神经内分泌肿瘤患者,随机予以依维莫司或安慰剂治疗,结果显示,依维莫司组较安慰剂组PFS明显延长(11个月vs3.9 个月),降低疾病进展风险达 52%。亚组分析显示,在胃肠神经内分泌肿瘤患者中,依维莫司组对比安慰剂组的中位PFS同样延长(13.1个月vs5.4个月),证实依维莫司治疗晚期NETs具有良好效果。这对晚期的PanNETs治疗有一定的启示作用。依维莫司常见的副作用有口腔炎、皮疹、腹泻、疲劳和呼吸道感染,3、4级不良反应包括贫血(6%)和高血糖(5%)。最近的临床前研究显示,αBET蛋白溴结构域抑制剂CPI203可增强雷帕霉素在PanNETs细胞系以及异种移植模型中的抗肿瘤作用,联合治疗减弱了雷帕霉素诱导的AKT活化,给mTOR抑制剂治疗带来了新希望[24]。
1.4 血管生成抑制剂
新生血管可为NETs的增殖生长提供营养,促进肿瘤的增殖、扩散。NETs过度表达与新生血管相关的VEGF、成纤维细胞生长因子和血小板衍生生长因子及其受体。血管生成抑制剂通过抑制新生血管的生成,从而抑制肿瘤的生长。
舒尼替尼是一种多激酶抑制剂,可抑制VEGFR和其他酪氨酸激酶受体。美国FDA已批准该药用于晚期PanNETs患者。携带MEN1/PDGFR/KIT/FLT3等基因突变的患者可口服舒尼替尼。可能用于预测舒尼替尼疗效的生物标志物包括:较高的血浆sVEGFR2-3和VEGF水平、较低的IL-8水平等[25]。高p-AKT表达的G3期肿瘤预示患者对舒尼替尼的反应较差[26]。一项随机对照Ⅲ期临床试验纳入了171例晚期分化良好的PanNETs患者,结果显示舒尼替尼较安慰剂能显著延长患者的中位PFS(11.4个月vs5.5个月),舒尼替尼治疗晚期PanNETs患者的客观缓解率ORR为 9.3%[27]。最近,一项针对晚期的、分化良好的、无法切除的或转移性PanNETs患者的舒尼替尼IV期临床试验显示,患者中位PFS为13.2个月,ORR为24.5%[28]。舒尼替尼主要的不良反应为骨髓抑制、胃肠道反应、高血压和蛋白尿。帕唑帕尼是一种新型的小分子多靶点激酶抑制剂,一项纳入 52 例G1/G2期NETs(37 例为PanNETs)患者的研究结果显示,21.9%的 PanNETs患者存在客观反应[29]。VEGF抑制剂贝伐珠单抗也可用于NETs的治疗,最近的Ⅲ期临床试验(SWOG S0518)纳入了晚期的G1和G2的NETs患者,将贝伐单抗联合奥曲肽和干扰素α联合奥曲肽做对比,发现两组中位PFS差异无统计学(16.6个月vs15.4个月),提示贝伐珠单抗和干扰素α是否能用于晚期PanNETs患者仍有待进一步研究[30]。乐伐替尼是一种多激酶抑制剂,对VEGFR1-3和FGFR1-4具有强大的亲和力,可以提高疗效并减少耐药情况。一项II期临床,纳入晚期高分化(G1/G2)PanNETs的患者,发现乐伐替尼用于PanNETs患者的ORR为40%,中位随访11个月发现,PanNETs患者的中位PFS估计为14.2个月[31]。最近还有研究表明,1α,25(OH)2D3类似物MART-10也具有抗血管生成的作用,有希望成为治疗PanNETs的新药物[32]。
2 免疫治疗
目前已有多项试验分析了免疫治疗用于PanNETs的效果,见表2。
表2 神经内分泌肿瘤免疫治疗相关临床研究
Table 2. Clinical Studies on Immunotherapy of Neuroendocrine Tumors

StudyDesignCase (n)Research statusMain outcomeKaufman HL et al. (2018)[38]Avelumab (Merkel cell carcinoma)88Ongoing30% PFSMehnert JM et al. (2017)[40]Levatinib41Ongoing88% SD (PanNETs)
PFS: progression-free survival; SD: stable disease.
2.1 IFNα
干扰素α(interferon α,IFNα)自20世纪80年代开始用于PanNETs的治疗,发挥抑制激素分泌和抗肿瘤增殖的作用。IFN-α的作用机制包括通过G1-S期细胞周期阻滞抑制细胞增殖和诱导干扰素诱导基因(如p21)对肿瘤细胞的直接作用[33]。 此外,IFN-α还有促进适应性免疫反应和抗血管生成作用[34]。但IFN-α的安全性并不理想,主要有流感样症状,包括发热、疲劳、厌食和体重减轻等。2016年的欧洲神经内分泌肿瘤学会共识指南建议,对于SSTR阴性的PanNETs患者可选用IFNα-2b;另外,对于某些难治性PanNETs病例,也可尝试SSA联用IFNα-2b[35]。2017年北美神经内分泌肿瘤学会指南建议,一般只有当患者没有其他选择的情况下才应考虑IFN-α。试验汇总分析显示IFN-α在40%的NETs患者有肿瘤标志物降低(类似于奥曲肽和兰瑞肽),客观肿瘤反应率RR为10%[36]。IFN-α与生长抑素类似物的联合可能具有协同作用。另一项汇总分析显示,IFN-α联合SSA与单独SSAs相比,NETs患者的死亡风险降低26%,但差异无统计学意义[37]。有史以来最大的前瞻性研究SWOG S0518试验证实了IFN-α与SSAs联合使用的效果[30]。这些研究均提示,IFN-α或可用于治疗PanNETs,但仍有待进一步的研究证实。
2.2 免疫检查点抑制剂
常用的免疫检查点抑制剂包括程序性死亡-配体1(programmed cell death-ligand 1,PD-L1)、程序性细胞死亡受体1(programmed cell death-1,PD1)或细胞毒性T淋巴细胞抗原-4的抗体,可阻断肿瘤细胞的免疫逃逸,已成功地运用于不同的实体肿瘤(如黑素瘤、肺癌和膀胱癌等)。PD-L1抗体avelumab在治疗Merkel细胞癌(一种皮肤的NETs)的临床试验中,已经获得较好的效果[38]。目前正在积极进行免疫检查点抑制剂治疗GEP-NETs的有效性与安全性的临床研究。肿瘤突变负荷和PD-L1的表达可能是免疫检查点抑制剂治疗的生物标志物。一项研究观察了24份GEP-NETs(14份PanNETs)患者肿瘤组织中的PD-L1表达情况,发现病理分级较高的PanNETs的PD-L1表达较强[39]。这项研究提示,免疫检查点抑制剂在PanNETs的治疗上可能存在较好的疗效。一项Ⅰb期临床研究KEYNOTE-028评估了作用于淋巴细胞PD1受体的pembrolizumab对PD-L1阳性且分化良好和中度分化的PanNETs患者的疗效。结果显示,14例(88%)PanNETs患者病情稳定(stable disease,SD)。其中,一例PanNET患者的反应持续时间为17.6个月[40]。免疫检查点抑制剂在PanNETs治疗方面的效果需要后续的临床研究验证。
2.3 溶瘤病毒
使用优先感染和破坏肿瘤细胞的溶瘤病毒是一种新兴的癌症免疫治疗方法。其作用机制包括肿瘤细胞死亡产生炎症反应和肿瘤相关抗原的释放刺激抗原呈递。Giandomenico等[41]已经系统开发了一种重组溶瘤腺病毒来治疗NETs,即将开展纳入了PanNETs肝转移患者的临床试验。该方法通过在病毒衣壳中引入细胞穿透肽产生了新的感染途径,提高感染效率,同时提高了病毒感染性。用天然病毒E1A启动子替换了人类色氨酸A启动子使腺病毒对神经内分泌细胞中的复制有选择性,阻止了所有非神经内分泌起源的细胞中的病毒复制。在病毒基因组中引入了肝脏特异性microRNA的靶序列,从而将病毒在健康肝细胞中的活性降至最低,减少潜在的肝毒性[42]。为了进一步提高激活适应性免疫应答效果,研究者们已经制定了一些策略,如将粒细胞巨噬细胞集落刺激因子基因、CD40L基因或者幽门螺杆菌嗜中性粒细胞激活蛋白基因导入溶瘤病毒的基因组中[43]。然而,目前还不清楚这些基因在病毒诱导的细胞死亡中是否导致有效的全身性抗肿瘤应答。
3 总结与展望
胰腺神经内分泌肿瘤的治疗仍然是一项挑战,需要采用多学科方法。治疗策略的选择应该综合考虑肿瘤的原发部位、分级、分化、SSTR表达、转移扩散的模式、生长速度和激素状态。近年来,胰腺神经内分泌肿瘤的分子生物学研究逐渐深入,新的潜在治疗靶点不断被发现,靶向药物的临床试验也在积极开展。同时对免疫系统在肿瘤进展和肿瘤控制中的作用的理解更加深刻,对于胰腺神经内分泌肿瘤的免疫微环境的研究更深入,胰腺神经内分泌肿瘤的免疫治疗试验不断增加。既往的临床研究往往将胰腺神经内分泌肿瘤和其他神经内分泌肿瘤合并一起,并且纳入的胰腺神经内分泌肿瘤的患者数量往往较少。未来的临床试验需要注重于选择适合的患者,寻找预测标志物和改善药物耐受性。随着胰腺神经内分泌肿瘤的靶向和免疫治疗基础研究和临床试验的不断发展,新型的靶向和免疫治疗药物将有望延长患者生存期,提高生存质量。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
